2.13: Vínculos Múltiples en Complejos de Coordinación
- Page ID
- 79518
Múltiples enlaces metal-ligando
En su mayor parte, hemos mirado átomos donantes que proporcionan un par de electrones a un metal. En la quelación, dos átomos donantes en el mismo ligando pueden proporcionar un total de cuatro electrones al metal. Además, algunos ligandos pueden formar dobles (o triples) enlaces a un metal, proporcionando cuatro o incluso seis electrones de un átomo donante.
Los óxidos pueden ser el ligando de unión múltiple más común. En biología, la atención se ha centrado en el papel de los óxidos de hierro y cobre como intermedios activos en una variedad de enzimas que utilizan oxígeno molecular para oxidar sustratos. El ejemplo más notable es el citocromo P450, una clase ubicua de agentes oxidantes que se encuentra en la mayoría de los organismos. En humanos, el citocromo P450 se encuentra en una variedad de tejidos, incorporando átomos de oxígeno en pequeñas moléculas por una plétora de razones. Un uso interesante del citocromo P450 es como agente desintoxicante en el hígado, donde convierte los enlaces C-H en compuestos liposolubles en grupos C-OH (alcoholes), que luego pueden ser excretados a través de los riñones y el sistema urinario. El intermedio activo involucrado en la ruptura del enlace C-H parece ser un óxido de hierro terminal, Fe=O.
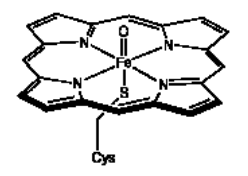
Los óxidos también son importantes industrialmente. Los catalizadores de metátesis de olefina, que se utilizan para refinar alquenos del petróleo en isómeros más útiles, suelen ser óxidos metálicos, los cuales se convierten bajo las condiciones de reacción en carbenos metálicos (ver más abajo).
Explicar, en términos de interacciones intermoleculares, por qué la oxidación por el citocromo P450 es un paso necesario para la eliminación de muchos compuestos de tejidos humanos
Mostrar cómo un orbital metálico y un orbital ligando pueden combinarse para formar un enlace pi. ¿Cuántos orbitales diferentes de metales de transición podrían participar en este vínculo?
- Responder
-
Agrega textos aquí. No elimine primero este texto.
A menudo, los enlaces múltiples metal-ligando “terminales” podrían estar en equilibrio con ligandos “puente” entre dos átomos metálicos. Mostrar, con dibujos, cómo los ligandos de óxido en dos grupos adyacentes de Fe = O podrían formar una sola unidad Fe 2 O 2
Una segunda clase importante de enlaces múltiples metal-ligando son los carbenos. Los carbenos contienen dobles enlaces metal-carbono. A menudo se dividen en dos clases: los carbenos Fischer y los carbenos Schrock o alquilidenos. Los carbenos Fischer fueron desarrollados por E.O. Fischer, quien compartió el Premio Nobel con Geoff Wilkinson en 1973 por otra obra. Los carbenos Fischer tienen un heteroátomo unido al carbono de doble enlace, como un oxígeno o nitrógeno. Pueden ser algo más estables que los alquilidenos, que solo tienen hidrógenos o carbonos unidos al carbono de doble enlace.
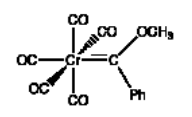
Figura\(\PageIndex{2}\): Un complejo de carbeno de Fischer.
Mostrar, con dibujos de orbitales moleculares, por qué los carbenos Fischer se estabilizan por la presencia de heteroátomos adyacentes.
- Responder
-
Agrega textos aquí. No elimine primero este texto.
Los alquilidenes fueron descubiertos por Dick Schrock, ahora en el MIT, cuando trabajaba en DuPont a principios de la década de 1970. Mientras intentaba colocar algunos grupos alquilo voluminosos en el tántalo, notó evidencia espectroscópica que sugería un doble enlace. DuPont no lo tenía haciendo este experimento por una razón en particular; estaba empleado como científico básico, cuyo trabajo era producir nueva información por su propio bien. Sin embargo, Schrock rápidamente se dio cuenta de que había encontrado algo con aplicaciones importantes: este tipo de estructuras habían sido propuestas por Chauvin como intermedios en la metátesis de olefina, un proceso utilizado en la refinación de petróleo, pero no se habían observado antes. Años después, Schrock y otros trabajadores, entre ellos Bob Grubbs de Cal Tech, pudieron desarrollar nuevos catalizadores a base de alquilideno útiles en química de polímeros y síntesis orgánica. Por sus contribuciones en esta área, Schrock, junto con Bob Grubbs en Caltech e Yves Chauvin en el IFP, compartieron el Premio Nobel de Química en 2005.
Sugerir algunos ejemplos de evidencia espectroscópica que puede haber avisado a Schrock sobre la presencia de un doble enlace metal-carbono en su producto.
- Responder
-
Agrega textos aquí. No elimine primero este texto.
Determinar el recuento de electrones en el metal en los siguientes complejos.
- Responder
-
Agrega textos aquí. No elimine primero este texto.
Múltiples enlaces Metal-Metal
Así como las interacciones orbitales adicionales pueden conducir a múltiples enlaces metal-ligando, también pueden hacer múltiples enlaces entre los metales. Los enlaces metal-metal en los complejos de coordinación son interesantes porque son una especie de estado intermedio entre los metales elementales a granel, en los que las matrices de átomos están unidas entre sí más o menos sin límite, y las moléculas, que tienen formas y tamaños discretos. Los compuestos no moleculares a veces pueden ser difíciles de estudiar (aunque también proporcionan algunas ventajas). A veces, los investigadores están interesados en el comportamiento de los compuestos que tienen enlaces metal-metal porque pueden proporcionar información sobre los metales.
No es fácil saber cuántos enlaces hay entre dos átomos metálicos. Por lo general, los investigadores especulan primero que un enlace múltiple está presente cuando una estructura de rayos X muestra que los dos átomos metálicos están muy cerca entre sí. Luego se realizan cálculos orbitales moleculares para tener una idea de la estructura electrónica del compuesto. El número de enlaces que deben dibujarse entre los dos átomos aún puede estar abierto a debate; la mayoría de los trabajadores dibujan un vínculo por cada par de electrones compartidos entre los átomos. Sin embargo, a veces también hay electrones en los niveles antiadherentes, por lo que el verdadero orden de enlace entre los metales es menor.
Un enlace sigma tiene una densidad electrónica máxima a lo largo del eje del enlace. Un enlace pi tiene una densidad electrónica máxima por encima y por debajo del eje del enlace (la densidad electrónica se divide en dos lóbulos a lo largo del enlace). Un enlace delta tiene una densidad electrónica máxima por encima y por debajo y delante y detrás del eje del enlace (la densidad electrónica se divide en cuatro lóbulos a lo largo del enlace). Mostrar cómo se pueden combinar dos orbitales d metálicos para formar un enlace delta.
- Responder
-
Agrega textos aquí. No elimine primero este texto.
Determinar el recuento de electrones en cada metal en los siguientes complejos.
Uno de los bonos metal-metal más cortos registrados fue reportado por Klaus Theopold en la Universidad de Delaware y Clark Landis en la Universidad de Wisconsin-Madison en 2007. La distancia Cr-Cr se reporta como 1.8028 (9) Angstroms (el 9 entre paréntesis es el error en el último dígito, es decir +/- 0.0009). Creen que cada átomo de cromo en el complejo tiene 18 electrones.
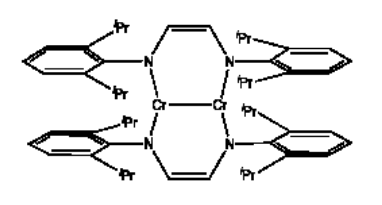
- ¿Cuántos enlaces metal-metal hay entre los átomos de cromo?
- Mostrar dibujos del solapamiento entre pares de orbitales que podrían ser responsables del enlace metal-metal.
- Responder
-
Agrega textos aquí. No borrar este texto primero

