5.13: Síntesis de péptidos y proteínas
- Page ID
- 79251
Los péptidos y proteínas son muy importantes en biología. Como resultado, la síntesis de estas moléculas se ha vuelto muy importante, lo que permite el estudio de laboratorio de compuestos modelo que nos pueden dar una idea de cómo funcionan las proteínas, así como compuestos de importancia importante desde el punto de vista farmacéutico.
La insulina y el glucagón son dos péptidos importantes (o proteínas pequeñas) que regulan el azúcar en la sangre. La insulina señala que los niveles de azúcar en la sangre son altos y que el cuerpo debe comenzar a almacenar este exceso de azúcar. El glucagón indica que los niveles de azúcar en la sangre son bajos y por lo tanto el cuerpo puede necesitar acceder a sus reservas de energía a largo plazo Ambos compuestos son importantes en medicina.
El glucagón tiene una estructura relativamente simple, para una proteína. Se trata de una cadena de tan solo 29 aminoácidos, conectados entre sí en el siguiente orden:
His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Ser-Arg-Arg-Ala-Gln-Asp-Phe-Val-Gln-Trp-Leu-Met-Asn-Thr.
La estructura está compuesta por materiales de partida fácilmente disponibles. Los aminoácidos son unidades simples que se conectan entre sí para formar una cadena. Conceptualmente, parece fácil juntar dos aminoácidos para formar una cadena lateral. Cuando dos aminoácidos se juntan, pierden una molécula de agua juntos, y las piezas restantes son capaces de unirse entre sí para hacer el dipéptido. Debe ser igual de fácil agregar un tercio, y así sucesivamente.
Estructuralmente, los enlaces amida o péptido son muy estables y resistentes a la sustitución de carboxilo. Esa estabilidad hace que las estructuras sean óptimas a partir de las cuales construir proteínas. A pesar de estar compuestas por cadenas muy largas de aminoácidos unidos, las proteínas en realidad tienen algunos límites en su flexibilidad conformacional (su “floppiness”). Eso permite que las proteínas mantengan de manera más confiable una forma particular. La forma de las proteínas es crucial para su función como enzimas y otras
Tanto la estabilidad como la rigidez estructural de los péptidos surgen de la naturaleza del enlace peptídico. La donación de pi que impide que los nucleófilos sustituyan en el carbonilo es lo suficientemente pronunciada como para que pueda considerarse que forma un enlace adicional. Por lo tanto, los péptidos se comportan como si contengan enlaces C=N en lugar de enlaces C-N. Las determinaciones de la estructura de rayos X muestran que los nitrógenos peptídicos en las proteínas son planos trigonales, no piramidales. Además, muchos péptidos exhiben isomerismo cis-trans. Por cada enlace peptídico, pueden ocurrir dos isómeros diferentes, dependiendo de si un sustituyente unido al nitrógeno está en el mismo lado del enlace C=N que el oxígeno carbonilo o el lado opuesto.
La gran estabilidad de estas estructuras no significa que sean fáciles de hacer. Parte de la dificultad proviene del hecho de que los aminoácidos son difuncionales. Para formar estructuras de cadena larga, los aminoácidos deben poder reaccionar dos veces: una con una amina, para crecer en una dirección, y una vez con un ácido carboxílico para crecer en la otra dirección. En otras palabras, un aminoácido contiene tanto un nucleófilo como un electrófilo.
Supongamos que íbamos a tratar de hacer el dipéptido, ala-phe. Este péptido contiene una alanina conectada a una fenilalanina a través de un enlace peptídico. El enlace peptídico se forma entre el ácido carboxílico de la alanina y la amina de la fenilalanina.
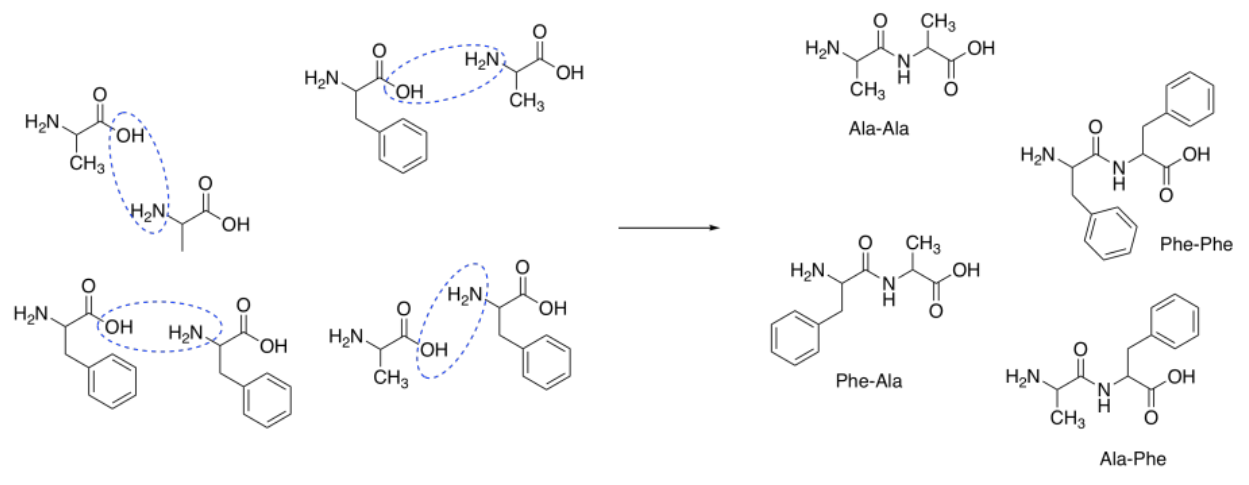
Suponiendo que los aminoácidos reaccionan juntos para formar el péptido, la combinación de estos dos reactivos probablemente produciría una mezcla de cuatro dipéptidos:
Ala-Phe Ala-Ala Phe Phe Phe
En otras palabras, la formación de péptidos a partir de aminoácidos no es selectiva.
Ejercicio\(\PageIndex{1}\)
Dibujar estructuras para los cuatro péptidos formados combinando glicina y leucina.
- Contestar
-

Ejercicio\(\PageIndex{2}\)
¿Qué tripéptidos se producirían mezclando Ala, Gly y Val?
- Contestar
-
Esa combinación daría los siguientes dipéptidos:
ala-ala ala-gly ala-val
gly-gly gly-ala gly-val
val-val val-ala val-gly
Por supuesto, también podríamos obtener tripéptidos, como ala-ala-gly-val, y así sucesivamente.
Ejercicio\(\PageIndex{3}\)
La simple combinación de estos péptidos podría no dar como resultado ninguna formación de péptidos en absoluto. ¿Por qué no?
- Contestar
-
Los ácidos carboxílicos suelen requerir activación antes de que puedan actuar como nucleófilos. Ese problema es realmente complicado aquí porque el ácido carboxílico está en equilibrio con una sal carboxilato (leer más en la página).
Una complicación adicional en la síntesis de péptidos es que las aminas y los ácidos carboxílicos no existen realmente juntos. En cambio, un protón se transfiere del ácido carboxílico a la amina, formando una sal. El carboxilato ya no es muy electrofílico, debido a su carga negativa. Debido a su carga positiva, el ion amonio ya no es muy nucleofílico.
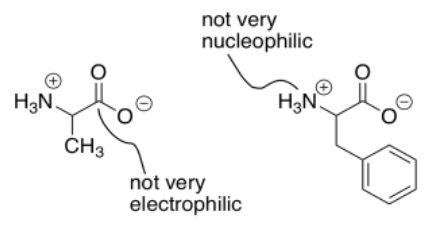
Como resultado, en realidad hay dos problemas distintos en la síntesis de péptidos. Existe un problema de selectividad, porque cada aminoácido tiene una parte nucleofílica y una parte electrófila. No hay forma de pedirle a un compuesto que reaccione solo usando su electrófilo y otro compuesto que reaccione solo usando su nucleófilo. También hay un problema de reactividad: el grupo carboxilo en este caso es un terrible electrófilo, y la amina es un nucleófilo terrible.
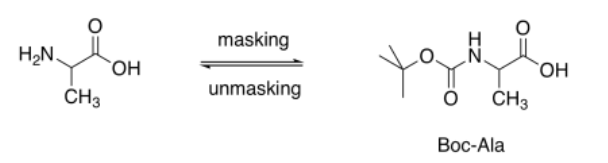
En síntesis de laboratorio, se han utilizado varias técnicas para hacer selectiva la síntesis de péptidos. Con mayor frecuencia, se utilizan grupos protectores. Un grupo protector “enmascara” uno de los dos grupos funcionales sobre un aminoácido, pero deja al otro abierto. Si un aminoácido tiene su amina protegida, solo puede reaccionar a través de su ácido carboxílico. Si el otro aminoácido tiene su ácido carboxílico protegido, solo puede reaccionar a través de su grupo amino. Sólo resultará una combinación.
La clave para proteger grupos es que la reacción utilizada para enmascarar uno de los grupos funcionales debe ser reversible. Debes poder retirar al grupo protector cuando ya no sea necesario.
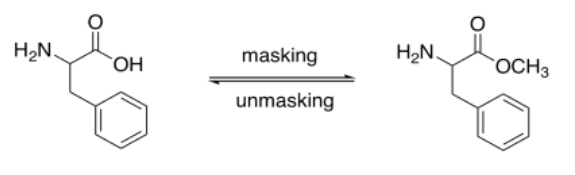
Los ácidos carboxílicos normalmente se protegen como ésteres. Los ésteres se pueden eliminar mediante hidrólisis catalizada por ácido o base (al igual que las amidas, pero los ésteres son más reactivos, estando más arriba de la colina de esquí).
Las aminas normalmente se protegen como amidas. No obstante, necesitamos poder quitarle amidas específicas: las que enmascaran las aminas, no las que hemos formado para unir dos aminoácidos entre sí. Como resultado, en la síntesis de péptidos, las aminas generalmente se protegen como carbamatos. Los carbamatos se pueden escindir más fácilmente que las amidas.
Ejercicio\(\PageIndex{4}\)
Proponer una razón para la reactividad relativamente mayor de los carbamatos en comparación con las amidas.
- Contestar
-
La reactividad relativa de los carboxiloides es el resultado de un equilibrio entre los efectos de extracción de electrones sigma y la donación de pi. Un átomo electronegativo unido a un carbonilo tiende a retirar la densidad electrónica, lo que hace que el carbonilo sea aún más positivo y electrófilo. Por otro lado, la pi-donación de un átomo vecino con un par solitario en realidad disminuye la electrofilicidad al formar un sistema estable y conjugado.
En un carbamato, se agrega un átomo electronegativo adicional al carbonilo: tiene un oxígeno así como un nitrógeno adyacente al grupo C=O. Ese átomo aleja la densidad electrónica del carbonilo, haciéndolo más electrófilo. Sin embargo, la pi-donación a partir del oxígeno adicional no resulta en un sistema conjugado más estable. El sistema pi máximo tiene todavía solo tres átomos de largo; o bien implica la conjugación de la unidad O-C=O o la unidad N-C=O. No conduce, por ejemplo, a un sistema conjugado aún más estable de cuatro átomos de longitud.
Como resultado, el oxígeno agregado probablemente contribuye más al efecto de extracción de electrones que a la estabilización del sistema pi.
Ejercicio\(\PageIndex{5}\)
Rellene los espacios en blanco en la siguiente síntesis de péptidos.
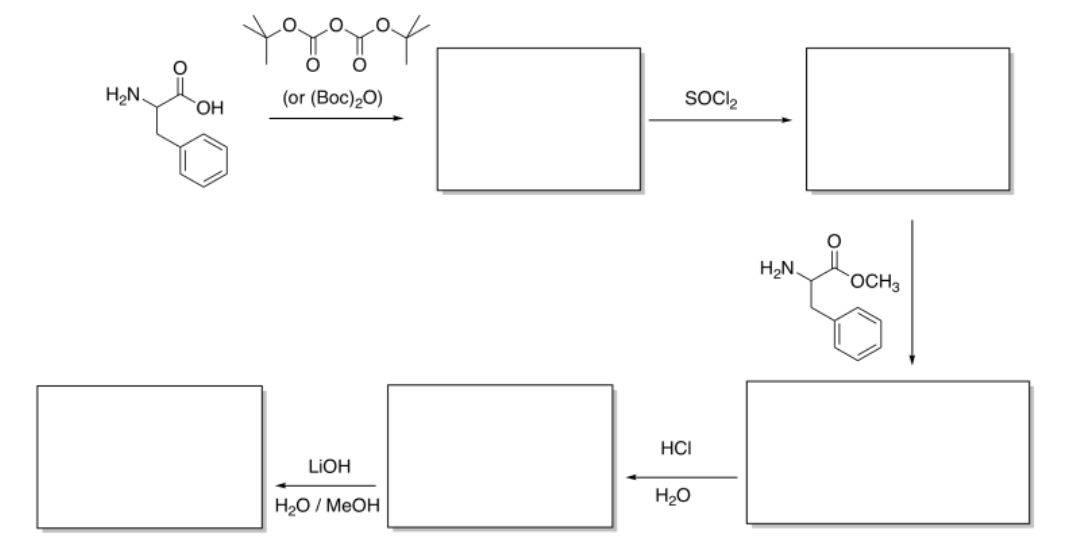
Contestar-

Para sortear el problema de la baja electrofilicidad del ácido carboxílico, se han desarrollado varios agentes de acoplamiento. Un agente de acoplamiento puede convertir temporalmente el anión carboxilato en un electrófilo más reactivo. Para ello, explota la nucleofilia del anión carboxilato. Después de donar al agente de acoplamiento, el compuesto carbonilo se vuelve más electrófilo.
El cloruro de tionilo (SOCl 2) puede lograr este objetivo, por supuesto. Convierte los ácidos carboxílicos relativamente no electrofílicos en cloruros de ácido mucho más electrófilos. El cloruro de tionilo puede ser un poco duro, sin embargo, por lo que los químicos han buscado desarrollar condiciones más suaves que puedan tejer dos aminoácidos juntos sin la necesidad de formar un cloruro de ácido reactivo.
Algunos de los agentes de acoplamiento más utilizados para la síntesis de péptidos son las carbodiimidas. Estos compuestos contienen una unidad electrófila N=C=N para actuar como electrófilo inicial. Diisopropilcarbodiimida (DIC) y diciclohexilacarbodiimida (DCC) fueron algunos de los ejemplos más tempranos y simples de estos compuestos desarrollados para la síntesis de péptidos.
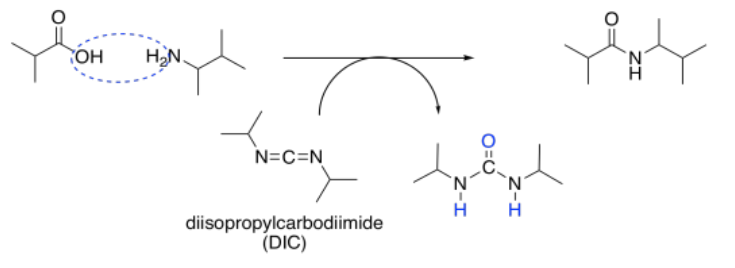
Una vez que un carboxilato ha donado al carbono electrófilo de la carbodiimida, se forma un mejor grupo de salida. Los átomos de nitrógeno adyacentes actúan como sitios básicos, recogiendo un protón del ácido carboxílico en un aminoácido y del ion amonio intermedio formado por el otro aminoácido.
Ejercicio\(\PageIndex{6}\)
Proponer una ventaja de EDCI como agente de acoplamiento para aminoácidos.
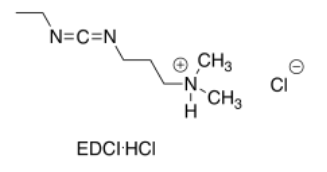
Contestar-
A menudo se usa la sal hidrocloruro más polar de EDCI, como se muestra en la imagen. Este compuesto más polar se disuelve bien en disolventes polares, como el agua, que también disuelven los aminoácidos.
También se puede imaginar el grupo amino en EDCI actuando como un sitio para la catálisis, transportando protones de un lugar a otro.

