5.12: Polímeros de condensación y polimerización de transesterificación con apertura de anillo
- Page ID
- 79286
Los carboxiloides, como los ésteres, pueden interconvertirse entre sí en presencia del nucleófilo apropiado. En el caso de los ésteres, resultará un equilibrio. Si se agrega un alcohol a un éster, en las condiciones adecuadas podríamos obtener un nuevo éster. También aparecería un nuevo alcohol, originario del antiguo grupo OR del éster original. Dos ésteres diferentes y dos alcoholes diferentes estarían en equilibrio. Este equilibrio podría perturbarse en una dirección u otra, por ejemplo, por la adición de un exceso de un nucleófilo.
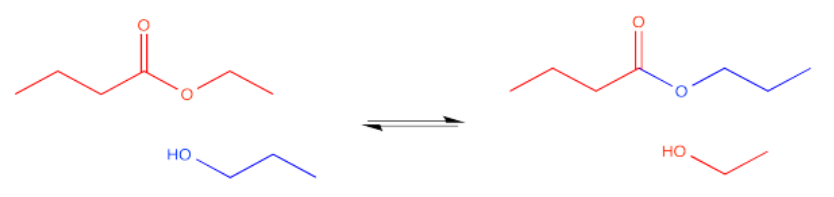
En la jerga de la química orgánica sintética, un éster es un grupo funcional. Es un sitio en la molécula en el que tienen lugar las reacciones. También es un sitio en la molécula que es fácilmente sujeto a transformaciones sintéticas. En otras palabras, un grupo funcional podría convertirse fácilmente en otro. En el caso de una reacción de transesterificación, un éster simplemente se convierte en otro.
Algunos compuestos tienen más de un grupo funcional. Un compuesto podría ser tanto un éster como un alcohol, por ejemplo. Podríamos llamar a este compuesto un hidroxiéster. Pero espera, si un alcohol puede reaccionar con un éster, para hacer un nuevo éster, ¿no tiene este compuesto ambos componentes de una reacción incorporados? ¿Podría reaccionar consigo mismo?
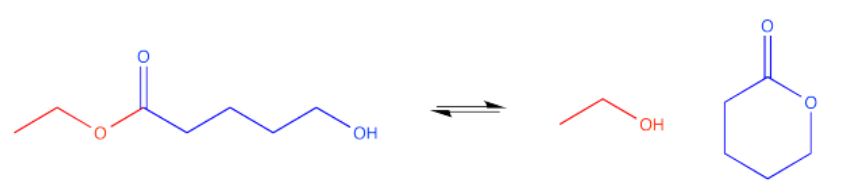
Hay un par de formas que podrían suceder. Si la cadena entre el carbonilo y el grupo hidroxilo es lo suficientemente larga (recuerde, una interacción de seis átomos entre el oxígeno hidroxilo y el carbono carbonilo puede ser óptima), el hidroxilo podría envolverse y formar un éster cíclico. Esa es una reacción intramolecular, una reacción dentro de una molécula.
Alternativamente, si hay otra de estas moléculas alrededor de algún lugar, podría ocurrir una reacción intermolecular. Esa es una reacción entre dos moléculas distintas. El grupo hidroxilo en una molécula puede llegar y reaccionar con el carbonilo en otra molécula.
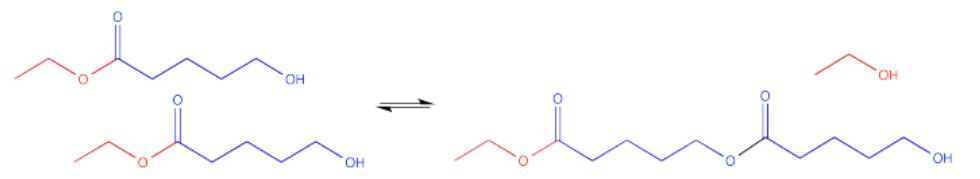
Ahora hay dos moléculas del mismo tipo unidas entre sí. Esta molécula doble se llama dímero. Las moléculas individuales que se han unido entre sí para hacer el dímero se denominan monómeros.
Ese dímero tiene dos ésteres en él, no sólo uno. Por supuesto, todavía tiene un grupo hidroxilo en un extremo. Ese grupo hidroxilo aún puede reaccionar con otro carbonilo en otra molécula.
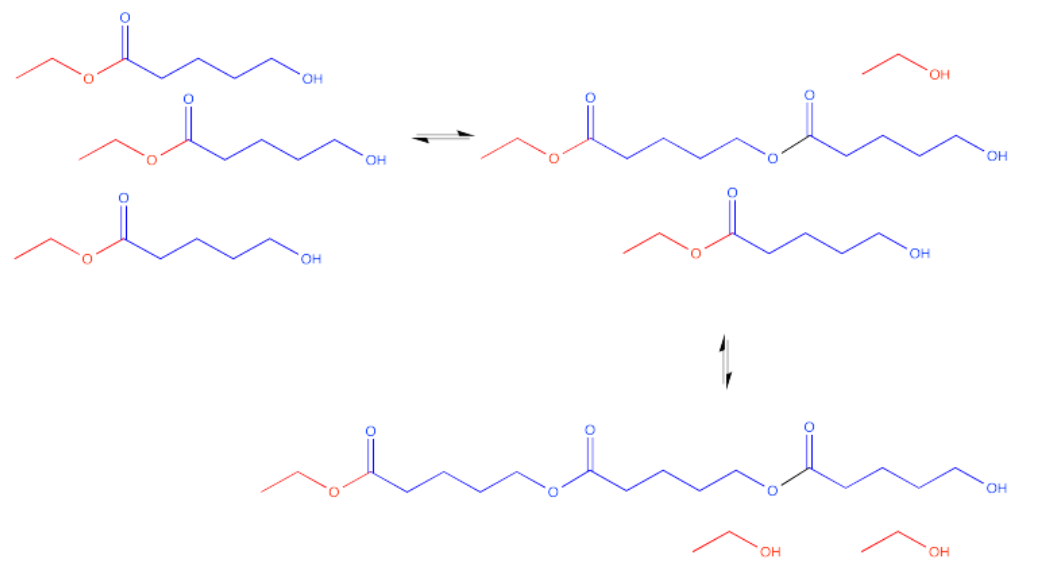
Ahora hay tres moléculas unidas entre sí. Esta molécula se llama trímero.
Este proceso podría continuar indefinidamente, claro. Podríamos terminar con una molécula muy grande, compuesta por muchas moléculas individuales (antiguas) que se han unido entre sí. Esta molécula muy grande compuesta por unidades repetitivas se llama polímero. Un polímero se construye a partir de muchos monómeros unidos entre sí. Este tipo particular de polímero se llama poliéster.
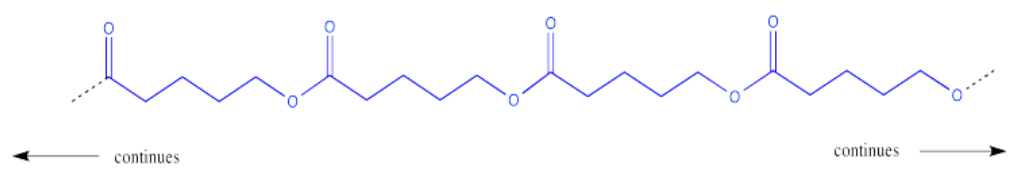
Este polímero se dibuja frecuentemente de una manera que enfatiza el patrón repetitivo de monómeros que se han incorporado a la cadena.
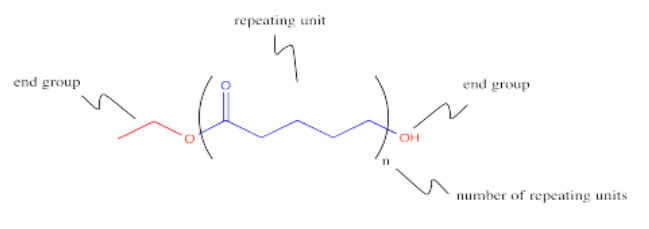
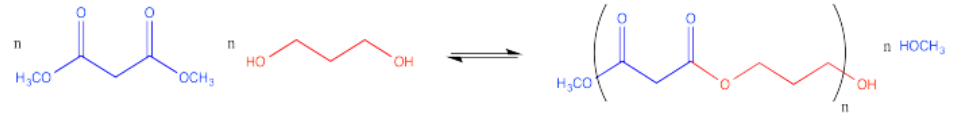
Los poliésteres también se pueden hacer copolimerizando dos monómeros diferentes juntos. Un monómero podría ser un diéster, por ejemplo. El otro monómero podría ser un diol. Estas dos moléculas están listas para reaccionar juntas, con una molécula actuando como electrófilo y la otra molécula actuando como nucleófilo.

Juntos, el diéster y el diol podrían polimerizarse. El resultado sería un copolímero alterno, en el que las unidades monoméricas de diéster y diol se alternan a lo largo de la cadena polimérica.
Los polímeros constituyen una clase importante de materiales con muchos usos. Muchos polímeros son materiales ligeros y fuertes que se utilizan para fabricar piezas para automóviles y otros productos. Los polímeros también pueden ser muy flexibles o elásticos. Las propiedades físicas de los polímeros son muy diferentes de las propiedades de otros compuestos moleculares. Estas diferencias son resultado directo del gran tamaño de las moléculas de polímero. Una molécula de polímero podría tener miles de monómeros de largo, con un peso molecular en millones.
Ejercicio\(\PageIndex{1}\)
Problema CX8.1.
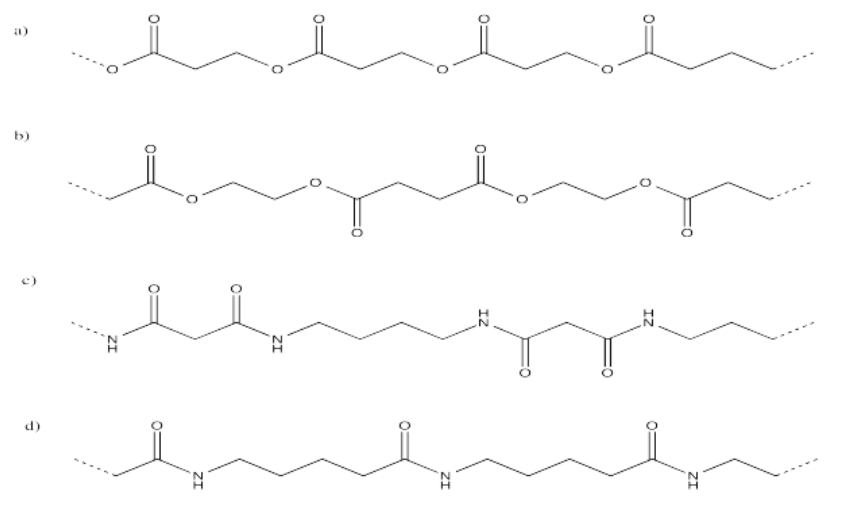
Expresar las siguientes estructuras poliméricas en estructuras abreviadas que muestran n unidades repetitivas entre paréntesis.
Ejercicio\(\PageIndex{2}\)
Mostrar las estructuras de los polímeros que resultarían de los siguientes monómeros. En cada caso, mostrar un dibujo con varios monómeros encadenados.
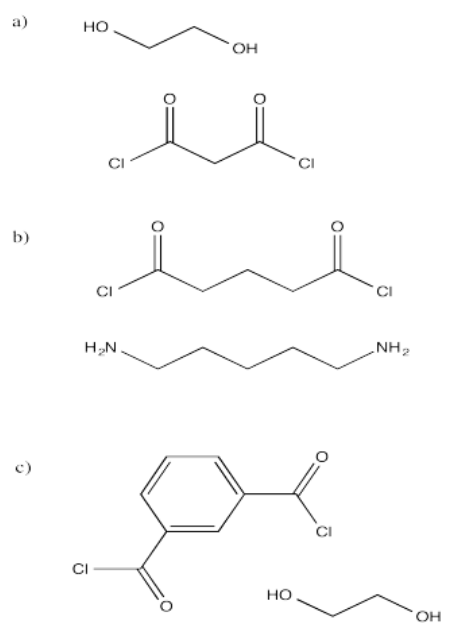
Ejercicio\(\PageIndex{3}\)
La polimerización por apertura de anillo implica una reacción de múltiples etapas en la que un compuesto cíclico, como una lactona (abajo) se abre en una cadena a través de la adición de un nucleófilo (llamado el “iniciador”). La cadena resultante es capaz de actuar como nucleófilo y abrir la siguiente lactona, y así sucesivamente, hasta que se haya formado un polímero. Mostrar un mecanismo para la formación del oligómero en el que n = 3.
Ejercicio\(\PageIndex{4}\)
Las polimerizaciones por apertura de anillo se aceleran frecuentemente a través de la adición de pequeñas cantidades de compuestos metálicos, como dietilzinc (Et 2 Zn) u octoato de estaño (Sn (O 2 CCH (CH 2 CH 3) CH 2 CH 2 CH 3) 2 . Explicar el papel de estos compuestos en el mecanismo de reacción.
Ejercicio\(\PageIndex{5}\)
Karen Wooley de Texas A&M reportó recientemente la siguiente síntesis de un polifosforamidato para su uso como agente de administración farmacéutica. El objetivo es utilizar un agente de administración benigno que sea fácilmente descompuesto y excretado por el organismo, resultando en baja toxicidad y mínimos efectos secundarios.
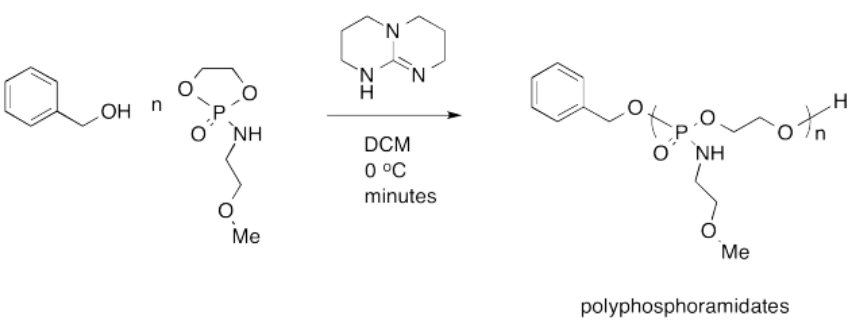
- Proporcionar un mecanismo para la síntesis.
- Explique por qué se espera que el polifosforamidato sea descompuesto y excretado fácilmente por el cuerpo.
En la polimerización con apertura de anillo, el monómero no es difuncional. En cambio, está incrustado en un anillo. Idealmente, hay una pequeña cepa de anillo en la molécula, volviéndola en energía solo un poco para que reaccione más fácilmente. Los ejemplos comunes incluyen caprolactona y lactida, utilizados para hacer bolsas biodegradables para desechos de jardín y producir contenedores, respectivamente (entre muchas otras aplicaciones). Estos ésteres cíclicos a veces se denominan “lactonas”.
Si se agrega un alcohol, puede actuar como un “iniciador” en una “reacción en cadena”. El alcohol es un nucleófilo, y dona al carbonilo, eventualmente escindiendo el enlace carboxilo C-O y abriendo el anillo.
En algún momento, un protón se transfiere al oxígeno que solía incrustarse en el anillo. Ahora tenemos un nuevo alcohol. ¿Qué hace? Reacciona con otro éster cíclico, abriéndolo y formando un nuevo alcohol. El ciclo se repite.
- Una reacción en cadena sigue ocurriendo una y otra vez.
- Una reacción en cadena debe ser iniciada por un iniciador.
- Una reacción en cadena conduce a un producto que se parece a un reactivo anterior, por lo que el producto reacciona de nuevo.
En realidad, las polimerizaciones de apertura de anillo realmente no funcionan si solo le agregas un alcohol a una lactona. Típicamente, también se agrega un catalizador. Los catalizadores más comúnmente son los ácidos de Lewis, como los compuestos de aluminio, hierro o estaño. Uno de los catalizadores más comunes es el octoato de estaño, más propiamente llamado 2-etilhexanoato de estaño (II).
Ejercicio\(\PageIndex{6}\)
Proporcionar un mecanismo, con flechas, para la polimerización de apertura de anillo de caprolactona con octoato de estaño.
Ejercicio\(\PageIndex{7}\)
Realizar análisis de grupo final en los siguientes casos para determinar
- el grado de polimerización (¿cuál es el valor de “n”?).
- el peso molecular.
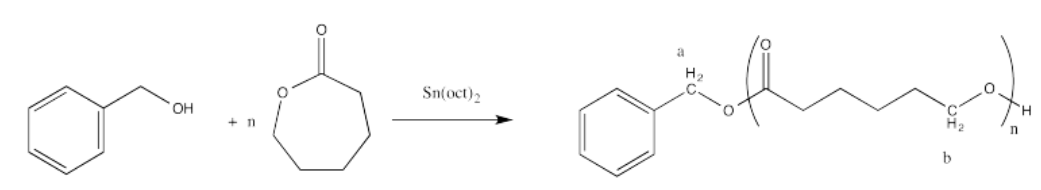
i. La relación de las integrales para los picos de RMN 1H que representan las posiciones b:a es 50:1.
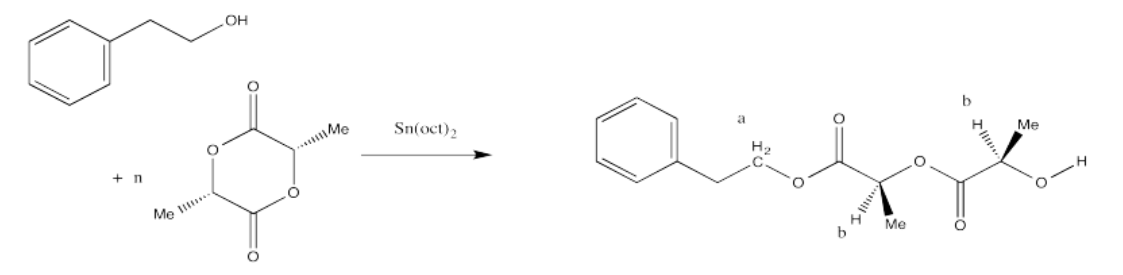
ii. La relación de las integrales para los picos de RMN 1H que representan las posiciones b:a es 80:1.
Contestar i-
En general, comparamos un pico en la unidad repetida (que ocurre una y otra vez) con un pico en un grupo final (que ocurre solo una vez en cada cadena) para encontrar el número de unidades repetidas o el grado de polimerización. Por ejemplo, si la cadena fuera un dímero (n = 2) esperaríamos que la integral para el pico b fuera el doble de grande que la integral para el pico a.
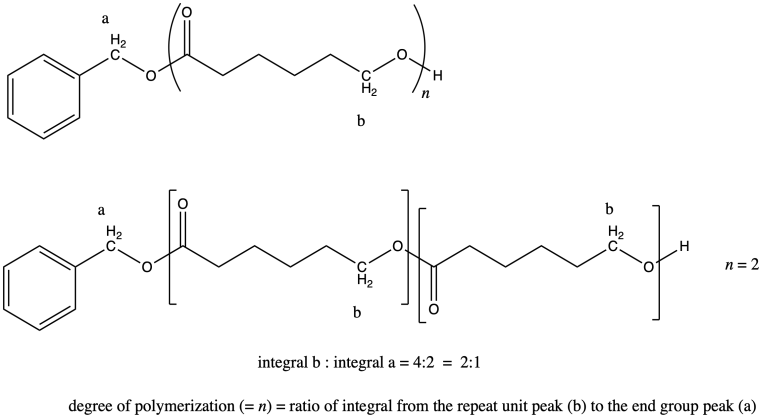
Así funciona porque en cada unidad repetida, el pico b representa dos hidrógenos, y en el grupo final, el pico a representa dos hidrógenos. Es el mismo número de hidrógenos en cada posición, por lo que comparar la integración de los dos picos te indica directamente cuántas unidades repetitivas hay.
Si eso no fuera cierto (si el pico b representara solo 1H y el pico 1 representara 2 H), entonces tendríamos que factorizar esa diferencia en la respuesta.
La pregunta establece que la relación de integración de b:a es 50:1, por lo que significa el grado de polimerización = 50.
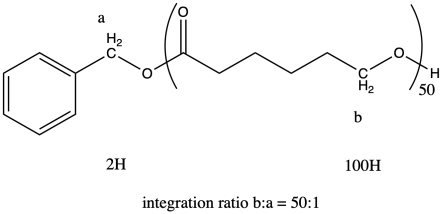
Por lo tanto, el peso molecular es aproximadamente 50 veces el peso molecular del monómero (114.4 g/mol), o 5.720 g/mol (a veces expresado como 5.720 Da; un Dalton es solo 1 g/mol). También hay grupos terminales (del alcohol bencílico) que aportan un poco de peso, por lo que el peso molecular total es de 5,720 + 108 g/mol = 5,828 g/mol.
- Respuesta ii
-
Una vez más, el pico a representa dos hidrógenos, y también el pico b (aunque los hidrógenos del pico b ocurren en dos lugares diferentes de la molécula y difieren estereoquímicamente entre sí). Eso quiere decir que, una vez más, la relación de integrales del pico b al pico a nos indica el grado de polimerización. Si la relación fuera 3:1, tendríamos n = 3.
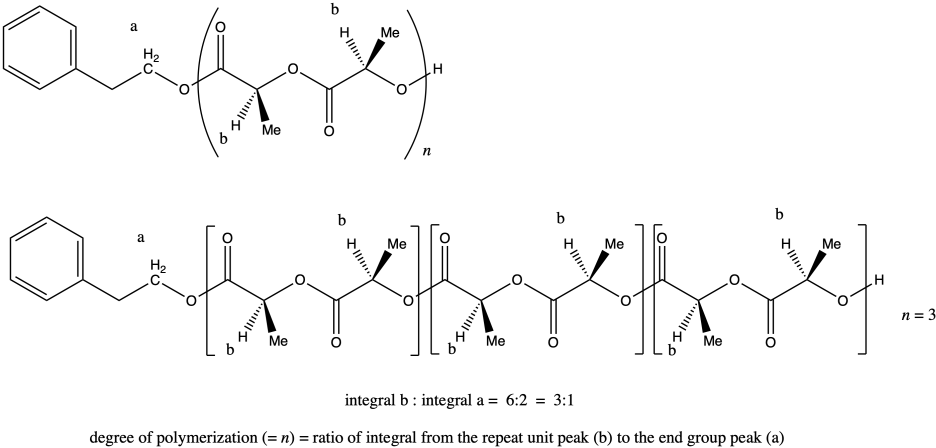
La pregunta establece que la relación de integración de b:a es 80:1, por lo que significa el grado de polimerización = 80.

Por lo tanto, el peso molecular es aproximadamente 50 veces el peso molecular del monómero (144.1 g/mol), o 11,530 g/mol. Añadiendo en los grupos terminales (del alcohol bencílico), el peso molecular total es de 11,530 + 108 g/mol = 11,638 g/mol.
Tenga en cuenta que en ciertos diastereómeros de lactida (LLA o DLA) podríamos dibujar la unidad repetida como una unidad C 3 H 4 O 2 en lugar de como la unidad C 6 H 8 O 4 más grande, pero en este caso los dos centros quirales son realmente diferentes, por lo que tenemos para mantener la unidad de repetición más grande para mostrar la presencia de ambas configuraciones estereoquímicas.

