1.2: Tasas de reacción
- Page ID
- 78701
Para empezar, pensemos en lo que se entiende por “tasa”. La velocidad de una reacción es solo su velocidad. Así como su velocidad al conducir por la autopista puede describirse en términos de su progreso a lo largo del tiempo (en millas o kilómetros por hora), se puede describir una reacción en términos del progreso de la reacción a lo largo del tiempo.
- La velocidad de reacción es el progreso de la reacción a lo largo del tiempo.
Veamos una comparación muy sencilla de tarifas. Veremos lo que podría pasar cuando rodamos una pelota por una acera. Haremos rodar dos bolas, una al lado de la otra: una roja y otra azul. Le daremos un empujón un poco más fuerte a la bola roja, y le daremos un toque más suave a la azul. Después tomaremos algunas fotos de las dos bolas a medida que ruedan.
Los siguientes dibujos son una secuencia de estas imágenes. Supongamos que tomamos una foto cada segundo. Notarás que algún niño ha marcado una línea cada metro usando tiza de acera.
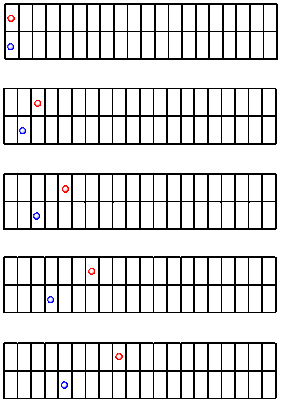
¿Qué vemos? El balón rojo va un poco más rápido que el azul. Está progresando más a lo largo del tiempo.
En ocasiones, es útil hacer una gráfica de nuestras observaciones.
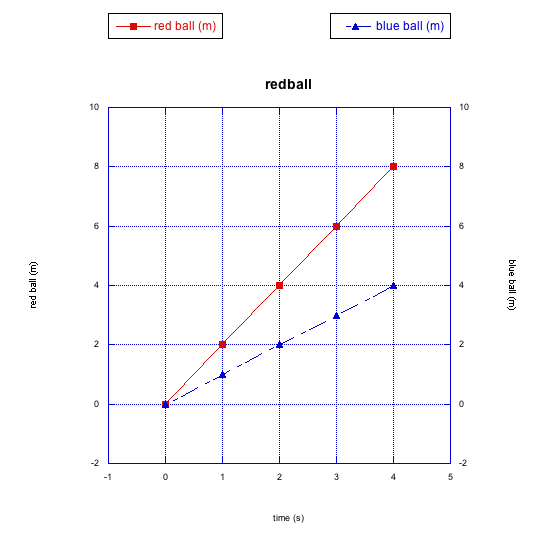
Una gráfica nos permite ver las relaciones entre los datos que hemos observado. En este caso, los datos son solo la distancia que ha movido la pelota (en metros) y el tiempo (en segundos). Esta relación particular se describe como una “relación lineal”; eso solo significa que, cuando graficamos la distancia que la pelota ha movido a lo largo del tiempo, vemos una línea recta. Esto es cierto tanto para la bola azul como para la bola roja. En este caso, nos dice que ambas bolas se mueven a una velocidad constante.
- Trazar datos en una gráfica nos permite ver las relaciones muy fácilmente.
No obstante, la bola roja se mueve más rápido que la bola azul. Podemos usar fácilmente la gráfica para medir exactamente cuánto más rápido se mueve (también puede hacerlo con solo mirar nuestras fotos de la pelota rodando por la acera. Podemos usar la pendiente de la línea para determinar la tasa de cambio de distancia con el cambio de tiempo.
- Para una línea recta, pendiente = “subir” /"correr”
- “subir” /"correr” = distancia/tiempo
- distancia/tiempo = velocidad
La bola roja se mueve 8 m en 4 s. Su velocidad es de 2 m/s. La bola azul se mueve 4 m en 4 s. Su velocidad es de 1 m/s. La bola roja se mueve el doble de rápido que la bola azul.
Ese tipo de comparación de tasas de cambio es similar a lo que se hace en la cinética química. Además, podríamos tratar de explicar por qué hay una diferencia entre las dos tasas (en este caso, empujamos la bola roja más fuerte que la bola azul).
- A veces podemos cuantificar comparaciones mediante análisis gráfico.
Veamos otra carrera entre la bola roja y la bola azul. Esta vez, ¿quién sabe? A lo mejor ganará el azul.
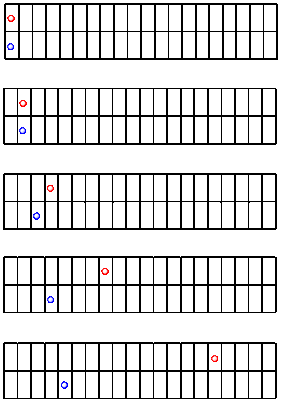
Claramente, la bola roja vuelve a ser más rápida que la azul. Pero veamos qué más queda claro al graficar los datos.
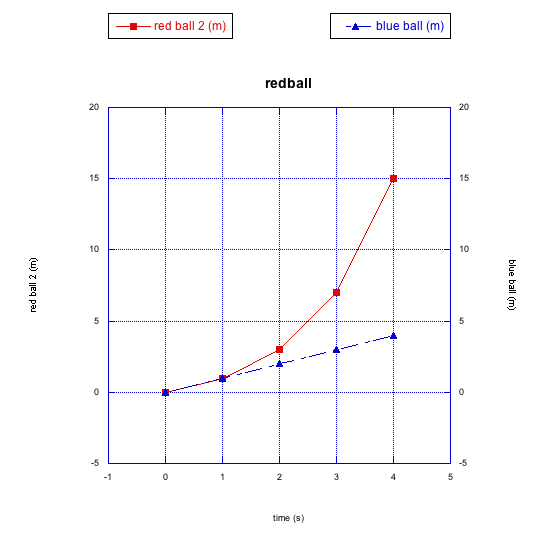
El balón azul sigue moviéndose a un ritmo constante. No obstante, esta vez la bola roja se está volviendo cada vez más rápida. La pendiente de la línea entre los dos últimos puntos de datos es mucho mayor que entre los dos primeros puntos de datos. En este caso la bola roja se está acelerando; su velocidad va aumentando con el tiempo.
El balón rojo no obedece una relación lineal entre distancia y tiempo. Esta es una relación no lineal, en cambio. Puede ajustarse a una expresión polinómica, o a alguna otra función no lineal.
- En ocasiones, las tasas no son lineales. La velocidad cambia con el tiempo.
Nuevamente, la tasa podría ser interpretada físicamente. La bola roja puede estar acelerando debido a algún factor que la está haciendo ir cada vez más rápido. A lo mejor la acera está inclinada por un lado, de modo que la bola roja en realidad está rodando ligeramente cuesta abajo.
Veamos una carrera más entre la bola roja y la bola azul. Esta vez, las bolas ya han estado rodando desde hace algún tiempo cuando empezamos a tomar fotos.

Parece que la bola azul empieza adelante, pero pronto es pasada por la bola roja. Cuando se grafica el progreso, podemos ver un tipo diferente de relación no lineal.
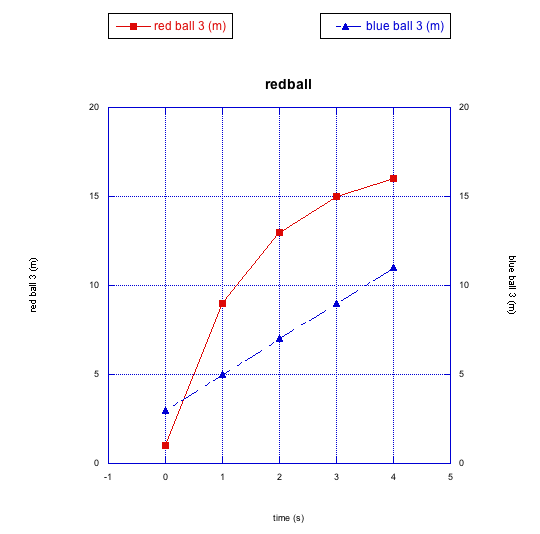
Esta vez la bola roja está desacelerando. Se está volviendo cada vez más lento. Te puedes imaginar que, si la bola azul sigue rodando de manera constante como lo ha hecho hasta ahora, eventualmente puede volver a pasar la bola roja. Esta desaceleración de la bola roja es un tipo diferente de relación no lineal.
¿Por qué la bola roja se está desacelerando, pero la azul no lo es? A lo mejor la acera vuelve a ser desigual, pero esta vez la bola roja va cuesta arriba. Quizás también puedas llegar a otras razones.
Tasas de reacción
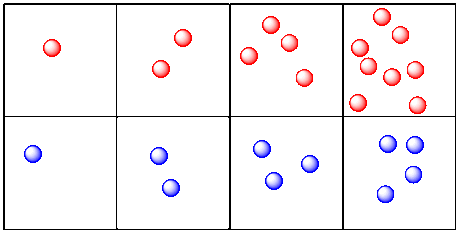
Echemos un vistazo a las moléculas y reacciones. Esta vez, en lugar de rastrear la distancia a lo largo del tiempo, veremos el número de moléculas presentes a lo largo del tiempo. A lo mejor estamos viendo dos reacciones. Una reacción produce moléculas rojas. El otro produce moléculas azules.
Esto se parece más a lo que estamos hablando cuando miramos la cinética química. Estamos viendo cambios en la cantidad de un compuesto a lo largo del tiempo. En este caso, la imagen hace que parezca que las moléculas rojas se producen más rápidamente que las moléculas azules. Las moléculas rojas y azules se producen a dos velocidades diferentes.
- La cinética de reacción analiza los cambios en la cantidad de compuestos presentes a lo largo del tiempo.
Este ejemplo puede parecer un poco poco realista. Las moléculas están apareciendo de la nada, y claro que no pueden hacer eso. Algo no se puede hacer de la nada. Veremos otros ejemplos en los que el origen de las nuevas moléculas es más claro.
a) Dibujar una gráfica que muestre la tasa de producción de moléculas rojas en la imagen de arriba (graficar el número de moléculas rojas vs. tiempo).
b) Dibujar una gráfica que muestre la tasa de producción de moléculas azules.
c) Comparar las tasas de producción de los dos tipos de moléculas.
a) Hacer un dibujo de moléculas cambiando con el tiempo. Esta vez, en lugar de que aparezcan más moléculas con el tiempo, hacen que las moléculas desaparezcan con el tiempo, a un ritmo constante.
b) Dibuja una gráfica correspondiente a tu serie de imágenes.
Las siguientes filas de matraces muestran dos escenarios diferentes.

a) Describir lo que sucede en la primera fila.
b) Graficar lo que está happeing en la primera fila.
c) Describir lo que sucede en la segunda fila.
d) Gráfica lo que está sucediendo en la segunda fila.
e) Comparar lo que está sucediendo en la primera fila con lo que sucede en la segunda fila.
Las siguientes gráficas muestran cambios en el número de moléculas a lo largo del tiempo. Describir lo que está pasando con el número de moléculas (¿aumentando? decreciente?) y a la tasa a la que se están produciendo los cambios (¿permaneciendo igual? ¿cada vez más rápido? cada vez más lento?).
a)
b)
c)
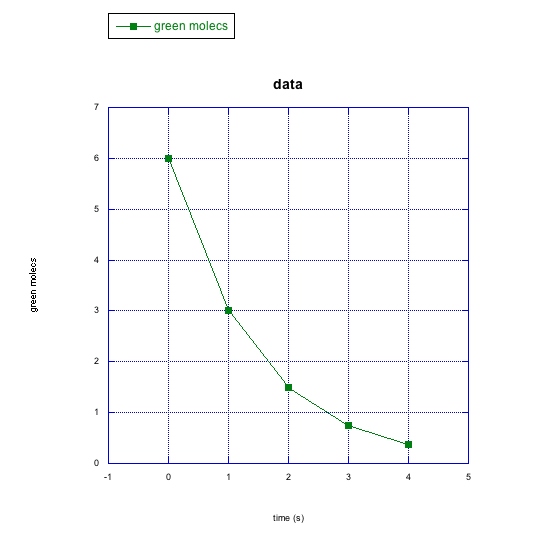
d)
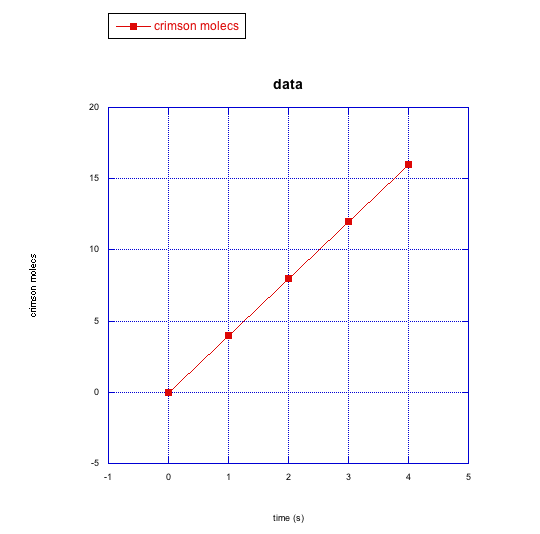
e)
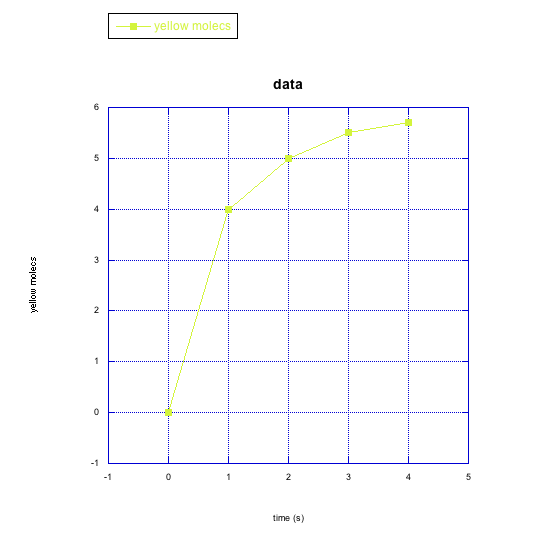
f)
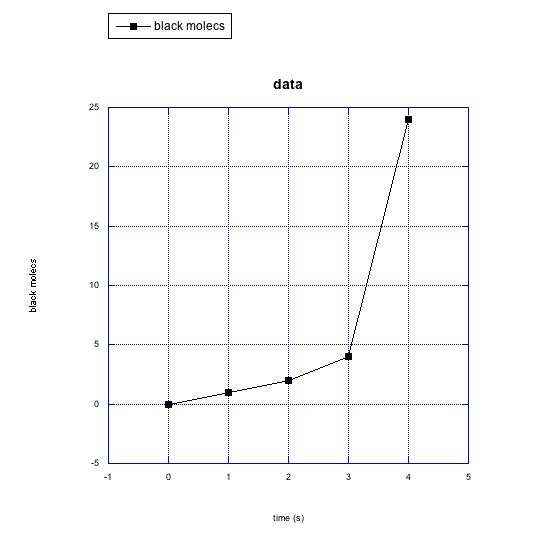
g)
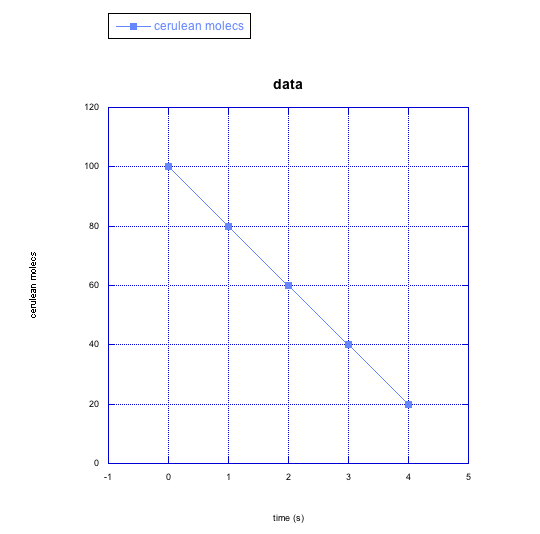
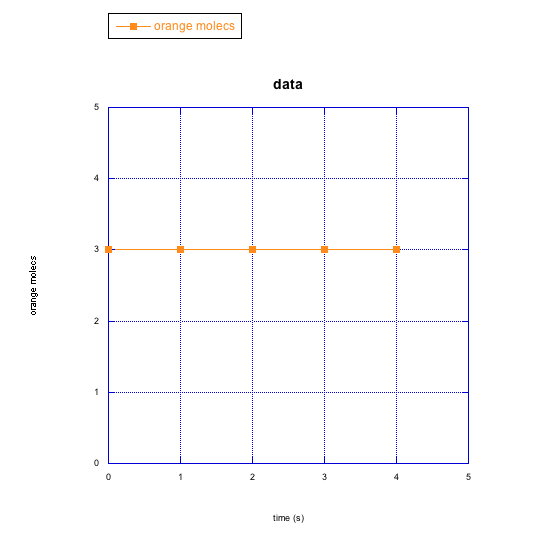
Para los siguientes casos en problema RK4, haz una gráfica cualitativa que muestre lo que crees que está sucediendo con la velocidad de la reacción a lo largo del tiempo (por ejemplo, ¿Crees que la tasa va aumentando con el tiempo? ¿Cómo lo mostrarías en una gráfica?)
a) moléculas cerúleanas
b) moléculas de naranja
c) moléculas verdes
d) moléculas carmesí
e) moléculas amarillas
f) moléculas negras
g) moléculas rosadas
¿Cómo describirías las similitudes entre los cambios en las moléculas verdes y las moléculas rosadas en las preguntas anteriores? ¿Y las diferencias?
Con frecuencia, en lugar de simplemente trazar cambios en un compuesto, podríamos graficar cambios en dos cosas a la vez. De esa manera, podemos buscar relaciones entre ellos.
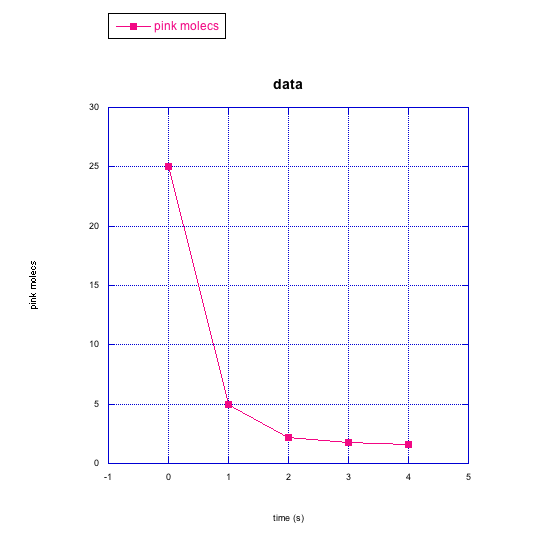
En las siguientes gráficas, las moléculas rosadas están reaccionando para formar otro tipo de molécula.
¿Las moléculas rosadas se están convirtiendo en moléculas negras o moléculas índigo? ¿Cómo se puede decir?
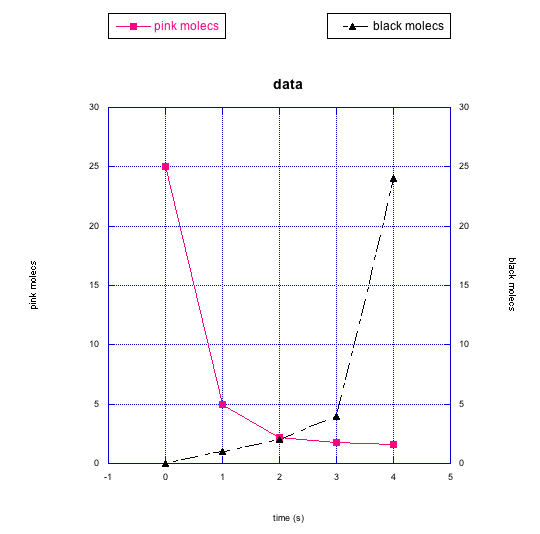
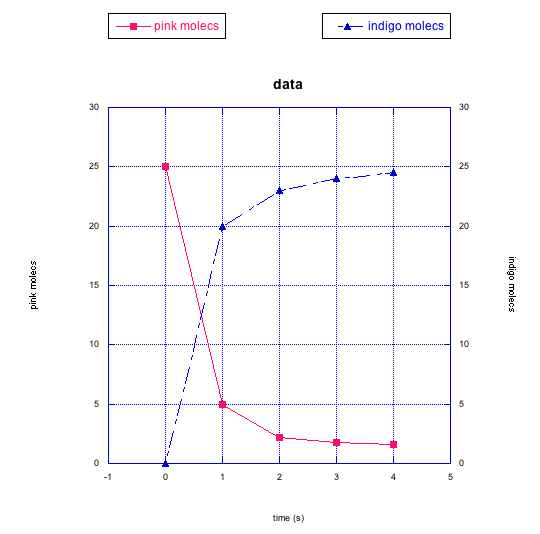
Las siguientes gráficas también muestran cambios en dos compuestos diferentes a la vez. Describe lo que crees que está sucediendo en cada caso.
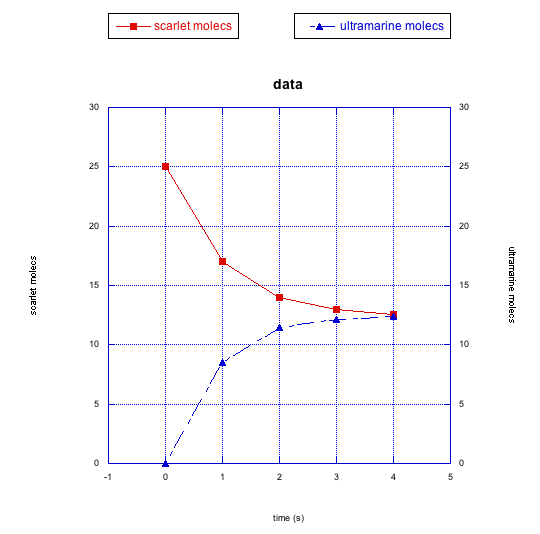
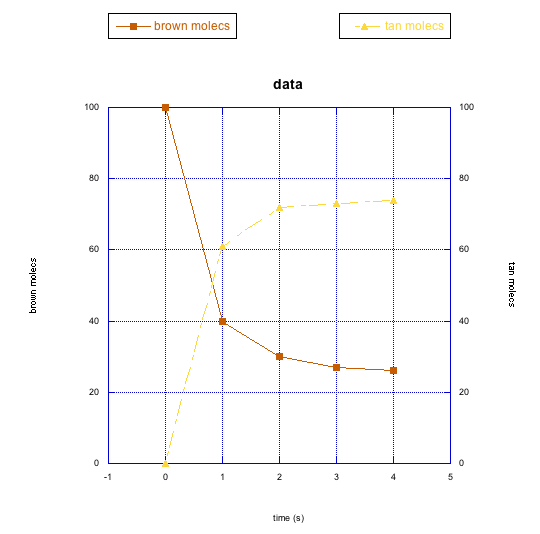
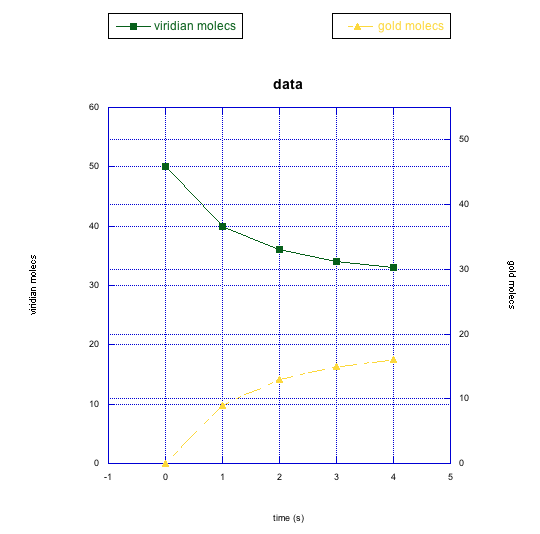
- Responder a
-
Las moléculas escarlata están desapareciendo con el tiempo. Con el tiempo aparecen moléculas ultramarinas. Sin embargo, el número de moléculas escarlata parece estabilizarse alrededor de la mitad de su número original; el número de moléculas de ultramar alcanza aproximadamente el mismo nivel. Es posible que las moléculas escarlata se conviertan en las ultramarinas, pero alcancen un equilibrio. En este equilibrio, sucede que hay cantidades aproximadamente iguales de los dos compuestos.
- Respuesta b
-
Debido a que la tasa de crecimiento de las moléculas de bronceado parece rastrear la tasa de pérdida de las marrones, parece probable que las marrones se estén convirtiendo en moléculas de bronceado. En algún momento, el cambio se nivela, por lo que se alcanza un equilibrio. En este equilibrio, las moléculas de bronceado superan en número a las marrones.
- Respuesta c
-
Las moléculas viridianas parecen estar convirtiéndose en oro pero el sistema alcanza el equilibrio, momento en el que todavía hay más moléculas viridianas que las de oro.

