1.3: Barreras de activación
- Page ID
- 78710
¿Por qué las reacciones tienen lugar a diferentes ritmos? ¿Por qué algunos suceden rápidamente y otros proceden muy despacio? ¿Por qué la misma reacción podría proceder a diferentes velocidades bajo diferentes condiciones? Hay una serie de factores que influyen en las velocidades de reacción, pero el primero que veremos es la barrera de activación.
Una barrera de activación es una especie de obstáculo energético que una reacción debe superar. Algunas reacciones tienen obstáculos más altos y otras tienen obstáculos más bajos. Es mucho más fácil superar obstáculos más bajos, por lo que las reacciones con barreras de activación bajas pueden proceder más rápidamente que las que tienen barreras de activación más altas.
- Una barrera de baja activación permite que una reacción ocurra rápidamente.
- Una barrera de alta activación hace que una reacción vaya más lentamente.
Una reacción puede ser exergónica en general (puede emitir energía), pero generalmente seguirá teniendo una barrera de activación al principio. Incluso si los compuestos bajan de energía al final de la reacción, generalmente subirán en energía antes de que eso suceda.
- Incluso si una reacción emite energía en general, al principio se debe poner algo de energía para comenzar la reacción.
Esta situación es un poco como invertir en un negocio. Un negocio generalmente requiere algún tipo de inversión financiera para comenzar. Si el negocio tiene éxito, eventualmente hará productos y devolverá el dinero a los inversionistas. Si el negocio es incapaz de recuperar su inversión inicial, puede fallar.
Las reacciones requieren alguna inversión inicial de energía. Esta energía puede provenir de las moléculas circundantes o del ambiente en general. Si la reacción es exitosa, procederá a elaborar productos y devolverá energía a su entorno.
- Siempre “cuesta” una energía molecular entrar en una reacción; “toma prestada” esa energía de su entorno.
- Esa inversión inicial de energía puede ser “devuelta” a medida que avanza la reacción.
Todas las reacciones deben superar las barreras de activación para que ocurran. La barrera de activación es la suma de la energía que se debe gastar para que la reacción continúe. A menudo se piensa en una barrera de activación, caricaturesamente, como una colina sobre la que la molécula tiene que trepar durante la reacción. Una vez, allí, puede simplemente deslizarse por el otro lado de la colina para convertirse en productos. En lo alto del cerro, la molécula existe en lo que se llama el “estado de transición”. En el estado de transición, la estructura se encuentra en algún lugar entre su forma original y la estructura de los productos.
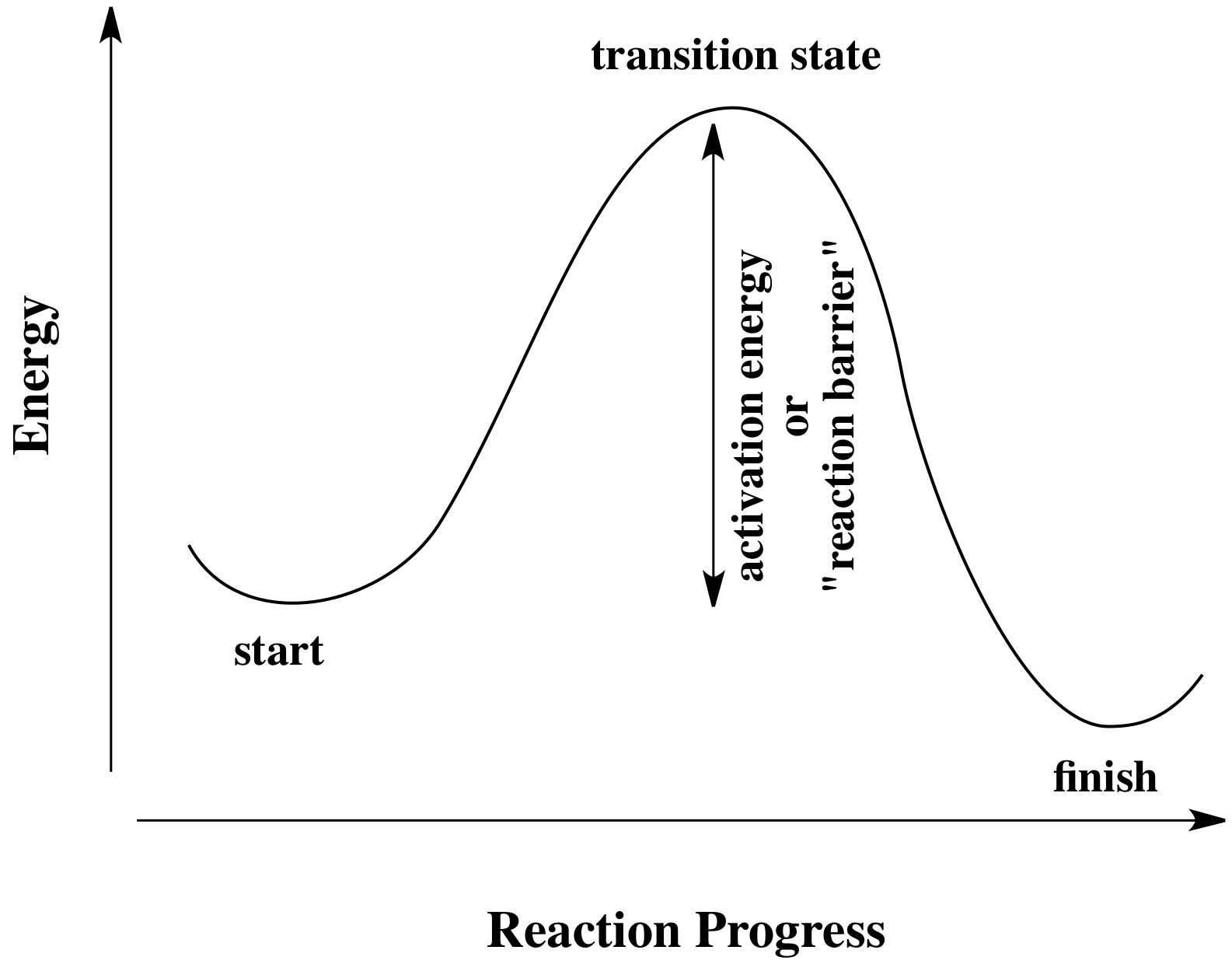
El tipo de diagrama que se muestra arriba a veces se denomina “diagrama de progreso de reacción”. Muestra los cambios de energía en el sistema a medida que avanza una reacción. Una o más barreras de activación pueden ocurrir a lo largo de las vías de reacción, ya que varias etapas elementales ocurren en la reacción.
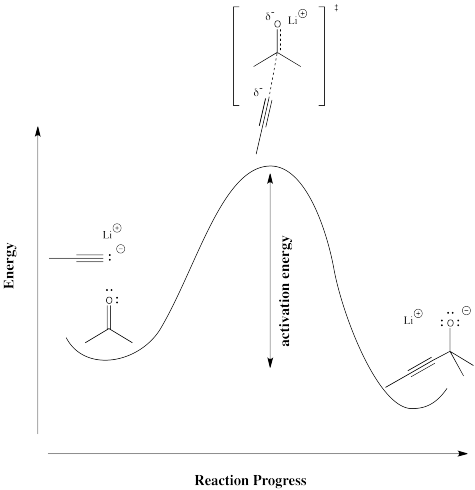
Para ver más concretamente qué significan términos como “progreso de reacción” y “estado de transición”, veamos una reacción real. Supongamos que un nucleófilo, como un ion acetiluro, dona sus electrones a un carbonilo electrófilo. El enlace π se rompe y se forma un ion alcóxido.
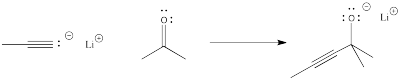
El progreso de la reacción simplemente se refiere a hasta qué punto ha avanzado la reacción. Está apenas comenzando, está casi terminado, ¿está justo a mitad de camino ahí? El estado de transición se refiere específicamente al punto de energía más alto en la ruta de los reactivos a los productos. Se refiere a la estructura en ese punto, y a la energía asociada a esa estructura.
En el siguiente diagrama, el término “progreso de reacción” ha sido sustituido por una ilustración que muestra hasta dónde ha avanzado la reacción en ese punto en la curva de energía que está por encima del dibujo de reacción. La estructura entre corchetes es el estado de transición, correspondiendo al punto más alto de la curva. El símbolo de “doble daga” (un poco como una cruz patriarcal u ortodoxa rusa, con dos travesaños en un poste vertical) es el símbolo que te dice que estás mirando una estructura de estado de transición.
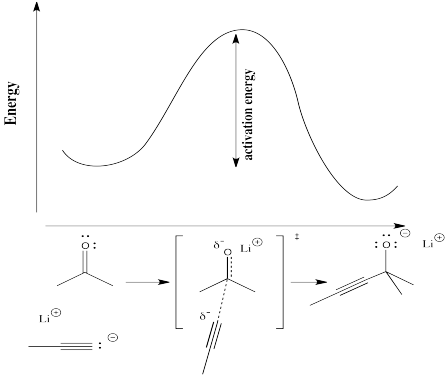
El estado de transición no se refiere a una estructura química regular. No necesariamente obedece las reglas de las estructuras de Lewis, porque algunos nuevos lazos han comenzado a formarse y algunos viejos lazos han comenzado a romperse; realmente no se pueden dibujar vínculos parciales en una estructura de Lewis.
Físicamente, la estructura del estado de transición no es algo que pueda aislarse y almacenarse en una botella. Debido a que se asienta en la parte superior de una curva de energía, el estado de transición está motivado para convertirse en otra cosa. No importa en qué dirección vaya para cambiar su estructura, irá a bajar la energía. Recuerda, las cosas siempre proceden a la energía más baja si es posible. Tan pronto como se forme el estado de transición, se deslizará de nuevo en los materiales de partida originales o se deslizará hacia adelante en los productos finales.
- El estado de transición es inherentemente una estructura inestable de alta energía, con una vida útil muy corta. Tan pronto como entra en existencia, vuelve a desaparecer.
Dibuja cómo crees que podría ser el estado de transición para las siguientes reacciones elementales.
Más comúnmente, los diagramas de progreso de reacción no se dibujan como el anterior. En cambio, las estructuras de reactivos, estados de transición y productos se muestran simplemente a lo largo de la curva de energía potencial, como se muestra a continuación.
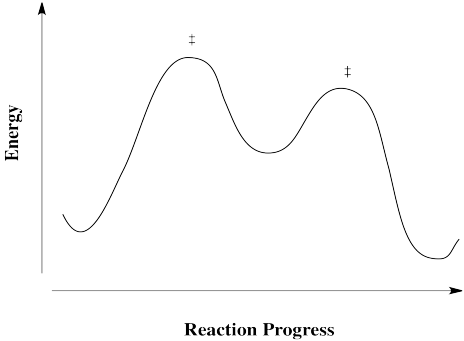
Las reacciones no siempre ocurren en un solo paso. A veces hay un intermedio, o más de uno. Un intermedio difiere de un estado de transición en que tiene una vida útil finita. Aunque no es tan estable como los reactivos o los productos, es lo suficientemente estable como para que no se descomponga inmediatamente. Ir adelante a los productos o volver a los reactivos es energéticamente cuesta arriba.
Dibuje diagramas de progreso de reacción para las siguientes reacciones. Tenga en cuenta que las reacciones pueden estar compuestas por más de un paso elemental.
Constante de velocidad
Existe un parámetro medible que se puede utilizar para hacerse una idea sobre la barrera de activación de una reacción. Se llama la constante de velocidad. La constante de velocidad para una reacción está relacionada con la rapidez con la que procede la reacción. Una constante de velocidad grande corresponde a una reacción muy rápida. Una constante de velocidad muy pequeña corresponde a una lenta.
- La constante de velocidad es un índice de la velocidad de la reacción.
Las constantes de velocidad tienen diferentes unidades dependiendo de cómo proceda la reacción, pero solo para darte una idea de cómo varían, una reacción con una constante de velocidad de “primer orden” de 0.001 s -1 (o 10 -3 s -1; aprenderás lo que significa “primer orden” después) terminaría en aproximadamente una hora. Una reacción con una constante de velocidad de primer orden de 10 -6 s -1 podría tomar un par de semanas.
La constante de velocidad da una visión directa de lo que está sucediendo en el estado de transición, porque se basa en la diferencia de energía entre los reactivos y el estado de transición. A partir de esa información, obtenemos algunas ideas de lo que está sucediendo en el camino hacia el estado de transición.
La constante de velocidad se puede descomponer en pedazos. Matemáticamente, a menudo se expresa como
\[k = \frac{RT}{Nh} e^{- \Delta \frac{G}{RT}} \nonumber\]
En donde R = la constante de gas ideal, T = temperatura, N = número de Avogadro, h = constante de Planck y D G = la energía libre de activación.
La constante de gas ideal, la constante de Planck y el número de Avogadro son constantes típicas utilizadas para modelar el comportamiento de moléculas o grandes grupos de moléculas. La energía libre de activación es esencialmente el requerimiento de energía para conseguir que una molécula (o un mol de ellas) se someta a la reacción.
Para cada uno de los siguientes pares, utilice < or > para indicar qué cantidad es mayor.
a) e 2 o e 10
b) e 1/4 o e 1/2
c) e -3 o e -4
d) e -1/2 o e -1/3
- Contestar a
-
e 2 < e 10
- Respuesta b
-
e 1/4 < e 1/2
- Respuesta c
-
e -3 > e -4
- Respuesta d
-
e -1/2 < e -1/3
Tenga en cuenta que k realmente depende de solo dos variables:
- constante de velocidad depende de ΔG o de la energía requerida para la reacciónli>
- constante de velocidad depende de T o la temperatura del entorno, que es un índice de cuánta energía está disponible
La relación entre la energía libre de activación y la temperatura compara la energía necesaria con la energía disponible. Cuanta más energía esté disponible en comparación con la energía necesaria, menor será esta relación. Como resultado, la parte exponencial de la función se hace más grande (ya que la potencia tiene un signo menos). Eso hace que la constante de velocidad sea más grande, y la reacción se vuelve más rápida.
Grandes grupos de moléculas se comportan como poblaciones de cualquier otra cosa. Tienen promedios, así como valores atípicos en el extremo alto y bajo. Sin embargo, cuanto mayor sea la temperatura, más energía tendrá un grupo de moléculas en promedio.
En el siguiente dibujo, la curva azul representa el contenido de energía en una población de moléculas a baja temperatura. El pico de la curva está cerca de la energía promedio para esta colección de moléculas. Algunas de las moléculas tienen más energía que la media (están más a la derecha en la curva azul) y otras tienen menos (más a la izquierda).
El corte negro a través de esta curva indica cuánta energía se necesita para superar la barrera de activación para una reacción en particular. Observe que, a baja temperatura, no tantas moléculas tienen suficiente energía para superar la barrera en cualquier momento. La reacción procederá muy lentamente. Sin embargo, probablemente haya más energía disponible de los alrededores, por lo que después de algún tiempo la mayoría de las moléculas habrán obtenido suficiente energía para que eventualmente puedan saltarse sobre la barrera.
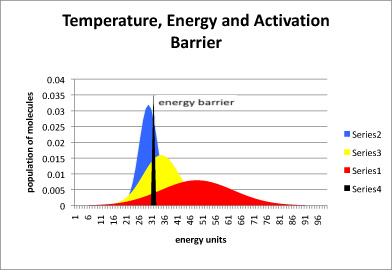
La curva amarilla representa moléculas a mayor temperatura, y la curva roja es una población a mayor temperatura todavía. A medida que aumenta la temperatura, fracciones cada vez más grandes de las moléculas tienen suficiente energía para superar la barrera de activación, y así la reacción avanza más rápidamente.
- la constante de velocidad compara la energía necesaria con la energía disponible
- con base en esa comparación, una fracción específica de la población podrá reaccionar a la vez
Energía Libre de Activación
Realmente hay más en la energía de activación de lo que hemos visto hasta ahora. La energía libre de activación es constante para una reacción dada a una temperatura dada. Pero a diferentes temperaturas, ΔG cambia. Al igual que en la termodinámica, se puede desglosar a su vez para:
\[\Delta G = \Delta H - T \Delta S \nonumber\]
en el que ΔH = entalpía de activación y ΔS = entropía de activación.
La entalpía de activación es la parte que más se corresponde con la energía requerida para la reacción, la forma en que hemos estado describiendo la barrera de activación hasta el momento.
La entropía de activación trata de cómo se debe redistribuir la energía dentro de la molécula para que ocurra la reacción. Uno de los principales factores que influyen en la distribución de energía en el transcurso de la reacción es la geometría molecular.
Por ejemplo, supongamos que dos moléculas necesitan unirse para que se produzca una reacción. Necesitan chocar entre sí. Sin embargo, una reacción podría no ocurrir cada vez que las moléculas chocan. A veces, las moléculas pueden estar apuntando de manera incorrecta cuando chocan entre sí, para que la reacción no pueda ocurrir. A menudo, los átomos necesitan alinearse en el lugar apropiado donde estarán formando un nuevo vínculo.
Cuando las moléculas están restringidas solo a ciertas orientaciones o geometrías, tienen menos grados de libertad. Con menos grados de libertad, la energía se puede almacenar de menos maneras. Como resultado, a menudo hay un costo de entropía en iniciar una reacción.
Por otro lado, una reacción podría comenzar de una manera muy diferente, con una molécula rompiendo un enlace y dividiéndose en dos pedazos. Debido a que cada pieza individual puede moverse independientemente de la otra, los grados de libertad aumentan. La energía se puede almacenar de más maneras de las que podrían ser antes de que comenzara la reacción. Como resultado, aunque esta reacción aún tendría una barrera de activación, el componente de entropía en realidad puede bajar un poco esa barrera.
En los siguientes dibujos, es más probable que una orientación de los reactivos conduzca al producto mostrado. Selecciona cuál será el más exitoso en cada set y explica qué es lo que está mal con cada uno de los demás.
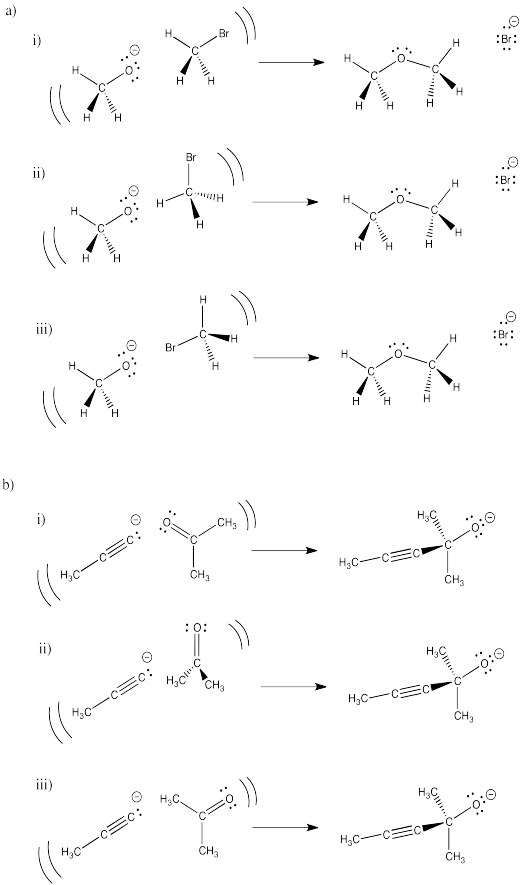
- Contestar a
-
La orientación (i) parece más probable que resulte en conexión del oxígeno al carbono con desplazamiento del bromuro. En la orientación (iii), el oxígeno parece listo para colisionar con el átomo de bromo. y en la oreientación (ii), puede colisionar con un átomo de hidrógeno.
Además, verá más adelante que traer el oxígeno a lo largo del eje C-Br (pero lejos del bromo) también es más probable que rompa el enlace C-Br, por razones que involucran superposición orbital molecular.
- Respuesta b
-
La orientación (ii) parece que el anión de carbono en el ion acetiluro es más probable que se una con el carbono carbonilo. En la opción (i), el carbono va a colisionar con el oxígeno carbonilo. En la opción (iii), puede colisionar con el carbono alfa, junto al carbonilo. Tener el enfoque nucleofílico desde fuera del plano del carbonilo, como en la opción (ii), disminuye la posibilidad de colisión con átomos distintos al carbono carbonilo.
Nuevamente, también hay razones orbitales moleculares que hacen de este enfoque el preferido.
Debido a que la barrera de activación depende en parte de la energía necesaria para romper los enlaces a medida que la molécula se dirige al estado de transición, la fuerza de unión comparativa puede ser un factor útil para obtener una sensación cualitativa de las barreras de activación relativas.
Las fuerzas de enlace metal-carbonilo (M-CO) de los complejos de coordinación M (CO) 6 se han estimado mediante calorimetría fotoacústica y se enumeran a continuación, por metal.
Cr: 27 kcal/mol Mo: 32 kcal/mol W: 33 kcal/mol
a) Con base en esa información, esbozar barreras cualitativas de activación para la pérdida de un ligando de CO de Cr (CO) 6, Mo (CO) 6 y W (CO) 6.
b) Predecir las tasas relativas para estas tres reacciones (¿más rápidas? ¿más lento?).
- Contestar a
-
Esperaríamos la barrera más baja para romper el enlace Cr-Co. La barrera para romper el enlace Mo-Co sería ligeramente menor que para romper el enlace W-CO.
- Respuesta b
-
Solo con base en esta información, podríamos esperar que la escisión de Cr-Co ocurra más rápidamente. La escisión de Mo-CO sería ligeramente más rápida que la escisión de W-CO.
Comparar las fortalezas de los enlaces que se romperán en una reacción suele ser una buena manera de obtener una primera estimación de las barreras de activación relativas.
a) Utilizar las siguientes fuerzas de unión para estimar las barreras a la adición de un nucleófilo (como NaBH 4) a los siguientes dobles enlaces: C=O (180 kcal/mol); C=N (147 kcal/mol); C=C (145 kcal/mol). Haz un boceto de los tres diagramas de progreso de reacción.
b) En general, los enlaces C=O son los más reactivos de estos tres grupos hacia los electrófilos, seguidos de los enlaces C=N. ¿Estas barreras relativas son consistentes con esta observación?
c) ¿Qué otro (s) factor (s) podría (n) ser importante para determinar la barrera de la reacción?
d) Modifique su diagrama de progreso de reacción para ilustrar estos otros factores.
- Contestar a
-
Solo sobre esta base, esperaríamos la barrera más baja para la escisión C=C, seguida de C=N y luego C=O con la barrera más alta.
- Respuesta b
-
Esta tendencia es exactamente lo contrario de lo que acabamos de predecir en base a las fortalezas de los bonos.
- Respuesta c
-
Puede haber algunas razones diferentes para estas diferencias. Por ejemplo, la electrofilicidad del carbono puede ser un factor. Con base en las diferencias de electronegatividad, el carbono C=O debería ser más positivo, el carbono C=N menos y el carbono C=C no en absoluto. Esa electrofilicidad puede elevar un poco el reactivo en energía.
Alternativamente, puede haber factores de estabilización de carga en el intermedio primero formado, que pueden reflejarse en el estado de transición en el camino hacia allí. Estos tres átomos diferentes (O, N, C) se encuentran todos en una fila de la tabla periódica, por lo que las diferencias de electronegatividad deberían dominar la estabilidad de carga. El ion alcóxido sería el más estable, el ion amida de estabilidad media y el anión alquilo menos estable de todos. Esa tendencia reduciría la barrera a la formación de alcóxido y elevaría la barrera a la formación de un anión alquilo basado en carbono.

