1.4: Colisiones y Fase
- Page ID
- 78680
Las velocidades de reacción dependen de la energía requerida (la barrera de activación) y de la energía disponible. También pueden implicar colisiones entre moléculas.
Si dos moléculas necesitan colisionar para que se produzca una reacción, entonces serán importantes los factores que influyan en la facilidad de las colisiones.
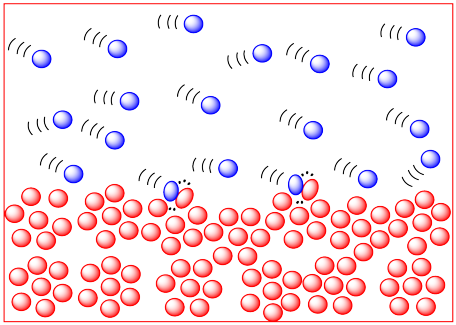
Cuanta más energía haya disponible para las moléculas, más rápido pasarán por ahí. Cuanto más rápido se dan la vuelta, más probabilidades hay de que se toparan entre sí. Por lo tanto, temperaturas más altas deberían conducir a más colisiones y una mayor frecuencia de reacciones entre moléculas. En el dibujo de abajo, las moléculas frías y lentas de la izquierda no parecen estar en peligro de chocar con nada, pero las moléculas calientes y cremalleras de la derecha parecen ser debidas a un choque en cualquier momento.
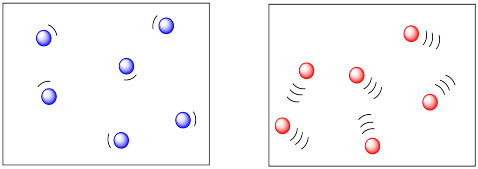
Ya sabíamos que las temperaturas más altas incrementaban las velocidades de reacción. Esta nueva observación es solo una razón adicional por la que la temperatura es importante en la cinética.
- La temperatura afecta a la movilidad molecular
- Cuanto mayor sea la temperatura, más móviles serán las moléculas, y más probabilidades hay de que colisionen y reaccionen.
La fase también tiene un efecto pronunciado sobre la movilidad de las moléculas. Las moléculas en fase gaseosa son bastante libres de moverse, y lo hacen con bastante rapidez. Por otro lado, están bastante bien dispersos. Sin embargo, las colisiones en la fase gaseosa ocurren con bastante facilidad, lo que podría ayudar a que las reacciones en fase gaseosa ocurran más fácilmente.
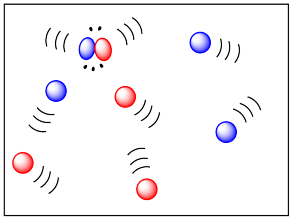
En el extremo opuesto, las moléculas en la fase sólida no son muy móviles en absoluto. (Las reacciones pueden involucrar átomos o iones, en lugar de moleules, pero se aplican los mismos argumentos). No ocurren muchas colisiones. Como resultado, las reacciones a menudo ocurren extremadamente lentamente en estado sólido. Las reacciones se limitan principalmente a los límites de grano: las superficies de los granos, donde están en contacto entre sí. No pasa nada en medio de un bulto de sólido, que permanece sin reaccionar.
Si se calienta un sólido, las moléculas pueden moverse un poco más. Incluso pueden dejar su red cristalina (si el sólido es cristalino) y difundirse muy lentamente a través del sólido. Muchas reacciones en estado sólido se llevan a cabo a temperatura elevada.
También hay muchas reacciones en estado sólido que se llevan a cabo en combinación con reactivos en fase gaseosa. Los reactivos sólidos a menudo se calientan en un horno mientras que los reactivos en fase gaseosa fluyen sobre ellos.
Muchas reacciones se realizan en estado líquido, ya sea porque los reactivos ya son líquidos o porque los reactivos sólidos se calientan más allá de su punto de fusión. En la fase líquida, las moléculas son mucho más móviles y las colisiones son mucho más frecuentes que en la fase sólida.
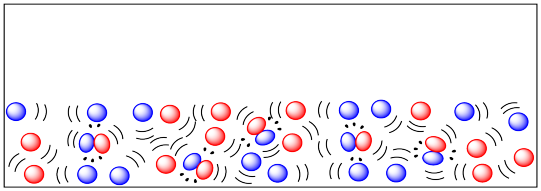
También es muy común ejecutar reacciones en solución. En solución, un compuesto que está destinado a someterse a reacción se disuelve en un disolvente. El solvente necesita ser un líquido a la temperatura a la que se ejecutará la reacción, para que las moléculas sean muy móviles, pero seguirán estando muy juntas, por lo que se favorecen las colisiones.
Hay muchas ventajas al ejecutar reacciones en solución. Las moléculas reaccionantes son muy móviles y bastante juntas, por lo que se facilitan las colisiones. Si la reacción es exotérmica y da mucho calor, el exceso de calor puede ser absorbido por las moléculas del disolvente y arrastrado. Eso puede ser importante para controlar las reacciones y evitar la descomposición. También, veremos que la velocidad de colisiones se puede controlar agregando más solvente o menos, con el fin de ralentizar la reacción o acelerarla. De esta manera, la velocidad de reacción puede controlarse hasta cierto punto.
Hay muchos líquidos que se utilizan comúnmente como solventes. El diclorometano, el tolueno, la dimetilformamida, el tetrahidrofurano y el acetonitrilo son algunos disolventes “orgánicos” comunes, llamados así porque se basan en carbono, que forma la base de las moléculas en los organismos. Estos diferentes disolventes ofrecen una gama de polaridades, por lo que diferentes pueden disolver diferentes reactivos.
El agua puede ser el solvente más común en el planeta, y no es tóxico, por lo que es muy atractivo para su uso en reacciones industriales a gran escala. Sin embargo, no es muy bueno para disolver reactivos no polares.
El compuesto reactivo podría ser un líquido o un sólido. Solo tiene que tener atractivos intermoleculares lo suficientemente fuertes con las moléculas solventes para que pueda disolverse. Las moléculas individuales del reactivo se pierden entre las moléculas de disolvente y nadan con facilidad.
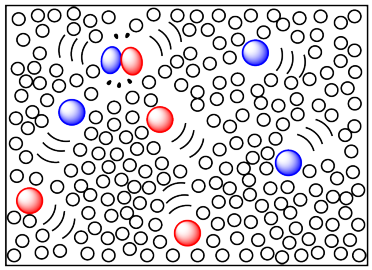
La desventaja de usar un disolvente es que el disolvente debe eliminarse al final de la reacción, de manera que el producto deseado pueda aislarse y usarse. Eso significa que el solvente eventualmente puede ser desechado como desecho. Esa práctica es menos eficiente y menos respetuosa con el medio ambiente, aunque el solvente posiblemente podría reciclarse.
Un método de disolución de reactivos que es potencialmente más verde es el uso de fluidos supercríticos. En este enfoque, los gases como el dióxido de carbono se presurizan hasta que se convierten en líquidos. En esta forma, el dióxido de carbono es un disolvente bastante bueno, y las reacciones se pueden ejecutar cuando los reactivos se disuelven en él. Al final de la reacción, se abre una válvula, liberando la presión, y el dióxido de carbono vuelve a convertirse en un gas. Se puede almacenar y volver a presurizar para otra reacción.
La difusión en estado sólido se ve grandemente potenciada por defectos en la red cristalina. Muestra por qué con el siguiente dibujo.
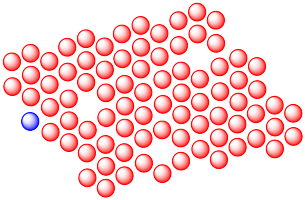
Contestar-
Las vacantes en las celosías cristalinas dan a otros átomos lugares para moverse, por lo que actúan como un camino a través del cual los átomos pueden moverse. La difusión a través del sólido se acelera enormemente.
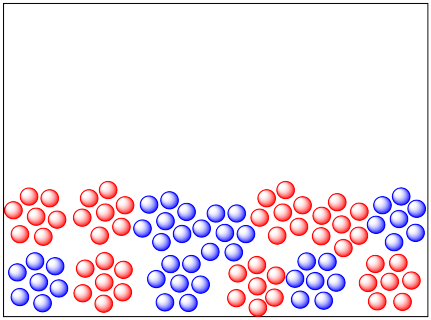
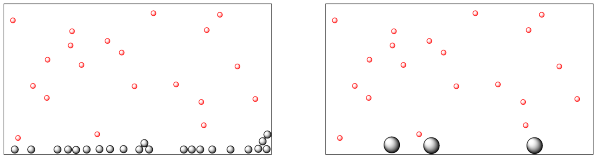
El siguiente dibujo representa una reacción entre moléculas en fase gaseosa y moléculas en fase sólida.
- ¿Qué material está en fase gaseosa y cuál está en la fase sólida?
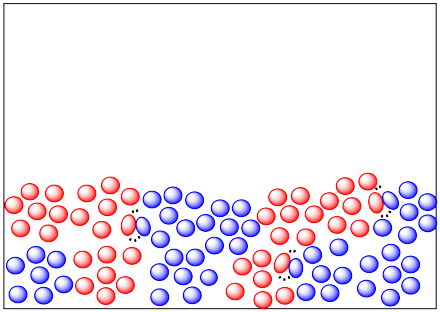
- Ambas imágenes contienen la misma masa de cada material. Sin embargo, uno de estos materiales parece estar distribuido de manera diferente en cada imagen. Explique cómo esa diferencia puede afectar la velocidad de reacción.
- Contestar a
-
Los pequeños puntos rojos están en fase gaseosa, por lo que se distribuyen por todo el contenedor. Los puntos grises más grandes son los sólidos, que se encuentran a lo largo del fondo del contenedor.
- Respuesta b
-
El sólido de la izquierda se divide en partículas más finas, con mucha más superficie. Si el gas reacciona sobre la superficie del sólido, la reacción será mucho más rápida a la izquierda.
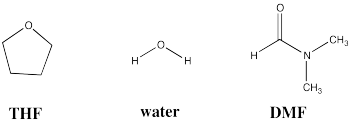
A continuación se muestran tres disolventes comunes. Compara y contrasta estos tres solventes en términos de cómo interactúan con otras moléculas.
- Contestar
-
Los tres disolventes tienen momentos dipolares. Además, las tres moléculas tienen pares solitarios de oxígeno, por lo que son capaces de aceptar enlaces de hidrógeno de donantes de enlaces de hidrógeno.
Sin embargo, algunos de los disolventes son mucho más polares que otros. El agua es capaz de donar enlaces de hidrógeno, debido a su hidrógeno parcialmente positivo unido al oxígeno. Es el más polar de estos solventes.
La DMF también es muy polar, porque tiene un enlace polar C=O. Este carbonilo en particular se parece más a + N=C-O -debido a la donación de pares solitarios del nitrógeno, por lo que es bastante polar e interactuará fuertemente con otras especies a través de fuerzas dipolo-dipolo (o fuerzas ión-dipolo, si la otra molécula es una sal).
El THF solo tiene un dipolo moderado en comparación con los demás. Aunque seguirá interactuando a través de fuerzas dipolo-dipolo (o ión-dipolo), lo hace de manera menos efectiva que el agua o DMF.
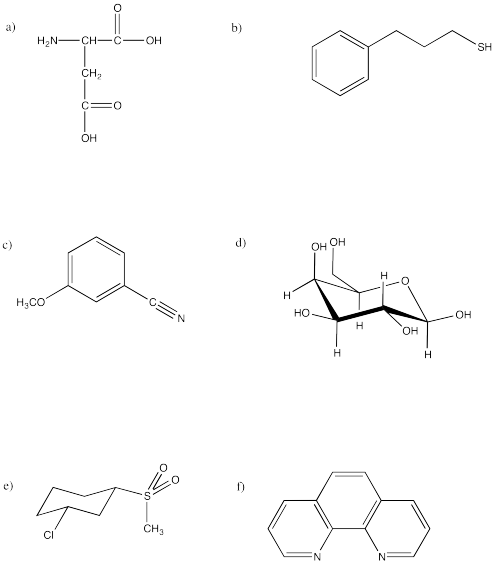
Indique qué tan bien piensa que cada uno de los tres solventes en la pregunta anterior (THF, agua, DMF) podría disolver cada uno de los siguientes compuestos. Justifica tus respuestas en términos de interacciones entre moléculas.
- Contestar
-
El agua sería un muy buen disolvente para (a) y (d), porque ambas moléculas serían muy buenas en enlaces de hidrógeno. Aunque el agua puede ser capaz de disolver pequeñas cantidades de las otras, su solubilidad estaría limitada por la necesidad de que las moléculas de agua liberen enlaces de hidrógeno entre sí para dejar espacio a las porciones no polares de estas moléculas.
El THF podría disolver bastante bien las otras moléculas: (b), (c), (e) y (f). Todas esas moléculas contienen enlaces polares, como THF, y podrían interactuar a través de fuerzas dipolo-dipolo. El THF podría disolver pequeñas cantidades de (a) y (d) pero puede no ser lo suficientemente polar como para superar las fuerzas intermoleculares más fuertes entre estas moléculas.
La DMF puede ser capaz de disolver todas estas moléculas en un grado moderado. Aunque no es un solvente prótico, su dipolo es suficiente para ayudar a superar los enlaces de hidrógeno entre (a) y (d).

