1.5: Colisiones y Concentración
- Page ID
- 78690
Sabemos que para que dos moléculas reaccionen entre sí, primero deben ponerse en contacto entre sí. Pensamos en ese contacto como una “colisión”. Cuanto más móviles son las moléculas, más probabilidades hay de que colisionen. Además, cuanto más cerca estén juntas las moléculas, más probabilidades hay de que colisionen.
En los siguientes dibujos, las moléculas están más juntas en la imagen de la derecha que en la imagen de la izquierda. Las moléculas tienen más probabilidades de chocar y reaccionar en la imagen de la derecha.
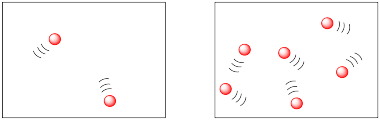
Podríamos describir los dos dibujos anteriores en términos de densidad de población. Ambos dibujos parecen ofrecer la misma cantidad de espacio, pero tienen diferentes cantidades de moléculas en ellos.
La diferencia se parece mucho a la diferencia entre las densidades de población humana en diversos lugares del mundo. Algunos lugares, como la Ciudad de México o Tokio, están muy concurridos; tienen altas densidades de población. Algunos lugares, como el interior australiano o el Ártico canadiense, tienen bajas densidades de población.
¿En qué ubicación crees que es probable que te encuentres con otra persona: el Upper East Side de la ciudad de Nueva York o 75 grados al norte, 45 grados oeste, Groenlandia?
- Responder
-
Upper East Side. Mucha más gente por pie cuadrado.
Clasificar los siguientes lugares en términos de densidad de población (el número de personas por kilómetro cuadrado).
- Rusia: pop. 143 millones; área 17 millones km 2
- Bahrein: pop. 1.2 millones; área 750 km 2
- Argentina: pop. 41 millones; área 2.7 millones km 2
- China: pop. 1.3 mil millones; área 9.6 millones de km 2
- Malawi: pop. 15 millones; área 118 mil km 2
- Ciudad del Vaticano: pop. 850; área 0.44 km 2
- Jamaica: pop. 2.7 millones; área 10,990 km 2
- Responder a
-
8.41 personas km -2
- Respuesta b
-
1,600 personas km -2
- Respuesta c
-
15.2 personas km -2
- Respuesta d
-
13.5 personas km -2
- Respuesta e
-
12.7 personas km -2
- Respuesta f
-
1,930 personas km -2
- Respuesta g
-
24.6 personas km -2
- Responder
-
Ranking: Baréin > Vaticano > Jamaica > Argentina > China > Malawi > Rusia
En ocasiones, mucha gente vive en un área pequeña, y la densidad de población es alta. En ocasiones, la población es grande, pero la zona también lo es. La densidad poblacional depende de dos factores diferentes: el número de personas y el área en la que se encuentran dispersas.
Concentración es el término que utilizamos para describir la densidad poblacional de moléculas (y otras entidades químicas como átomos o iones). Describe el número de moléculas que hay, pero también la cantidad de espacio, o volumen, que tienen que moverse. Así, mientras que una densidad de población humana puede describirse en términos de personas por kilómetro cuadrado, la concentración de una solución puede describirse en términos de moléculas por litro.
Describa lo que está sucediendo con las concentraciones de las tres soluciones a medida que avanza de izquierda a derecha.
a)
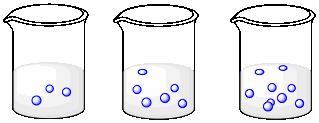
b)

- Responder a
-
El volumen es constante, pero el número de moléculas va en aumento. La concentración va en aumento.
- Respuesta b
-
El número de moléculas es constante, pero el volumen disminuye. La concentración va en aumento.
En los casos anteriores, describa qué pasaría con las tasas de colisiones entre moléculas a medida que avanza de derecha a izquierda en los dibujos.
- Responder
-
En ambos casos, las moléculas están cada vez más densamente empaquetadas. Las colisiones se harían más frecuentes a medida que avanzamos de izquierda a derecha.
a) En los siguientes dibujos, indiquen lo que está pasando a la concentración de moléculas de cada tipo a medida que avanza de izquierda a derecha.
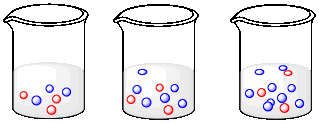
b) Explique qué pasaría con la tasa de colisiones entre moléculas rojas y moléculas azules a medida que se mueve de izquierda a derecha.
c) ¿Cómo cambiaría su respuesta sobre las tasas si la situación aquí se revivirtiera: si el número de moléculas azules permaneciera igual y el número de moléculas rojas aumentara?
d) ¿Cómo cambiaría su respuesta sobre las tasas si los números de las moléculas rojas y azules aumentaran al mismo tiempo?
- Responder a
-
El número de moléculas azules va en aumento, pero el número de moléculas rojas se mantiene igual.
- Respuesta b
-
Las colisiones entre moléculas rojas y azules se volverían más frecuentes a medida que avanzamos de izquierda a derecha. La mayor densidad de moléculas azules hace que las colisiones sean más probables.
- Respuesta c
-
La respuesta permanecería igual.
- Respuesta d
-
La respuesta se mantendría igual cualitativamente, pero diferiría cuantitativamente. El número de colisiones aumentaría más bruscamente si aumentaran las concentraciones de moléculas tanto rojas como azules, en lugar de solo aumentar una concentración.
Por lo general, no contamos moléculas individuales en una solución. Tratamos con grupos de moléculas porque es más conveniente. Las moléculas individuales son demasiado pequeñas para trabajar con ellas. Al tratar con moléculas a granel, usualmente usamos una unidad llamada mole, a menudo abreviada como mol. Es como tratar con huevos por docena. Las moléculas son más fáciles de rastrear por el lunar, en lugar de individualmente.
- En las siguientes soluciones, ¿cuántas docenas de moléculas azules hay en cada caso?
- ¿Qué pasa con la concentración del vaso de precipitados a medida que pasas de un vaso a otro? Cuantifica tu respuesta.
- Responder a
-
Media docena, una docena, dos docenas.
- Respuesta b
-
La concentración se está duplicando a medida que vamos de izquierda a derecha de un vaso de precipitados al siguiente.

En realidad, no contamos moléculas ni siquiera moles de moléculas. Cuando queremos trabajar con un compuesto, simplemente lo pesamos en la balanza. Entonces podemos usar el peso conocido del compuesto para averiguar cuántos moles tenemos.
Por supuesto, si vamos a estar midiendo moléculas por peso, necesitaremos saber cuánto pesa cada molécula. Por ejemplo, si necesitamos un número igual de moléculas rojas y moléculas azules, y las moléculas rojas pesan tres veces más que las moléculas azules, tendremos que pesar tres veces más de las cosas rojas que las azules.
Estás desarrollando un nuevo paseo en parque de diversiones “extreme sport”. Cada paseo (para una persona) es impulsado por un ratón y un elefante. Tienes bastantes elefantes para empezar, pero tendrás que ir a comprar algunos ratones.
- Si un elefante pesa 6,800 kg, ¿cuántos gramos pesa?
- Si tienes 47,600 kg de elefantes, ¿cuántos paseos puedes montar?
- Si un ratón pesa 25 g, ¿cuántos g de ratones necesitarás comprar?
- Supongamos que decides conseguir tres ratones extra (a veces ocurren accidentes alrededor de elefantes). ¿Cuál es el peso total de los ratones que necesitarías, incluyendo estos extras?
- Responder a
-
El elefante pesa 6,800 kg x 1,000 g/kg = 6,800,000 g = 6.8 x 10 6 g.
- Respuesta b
-
Tenemos 47,600 kg x 1 elefante/6,800 kg = 7 elefantes. Muy afortunado.
- Respuesta c
-
7 ratones x 25 g/ratón = 175 g.
- Respuesta d
-
10 ratones x 25 g/ratón = 250 g.
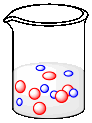
Supongamos que cada uno de los siguientes vasos de precipitados contiene un peso igual de cada tipo de molécula. El peso molecular de una molécula azul es de 60 g/mol. ¿Cuál es el peso molecular de una molécula roja, naranja y gris?
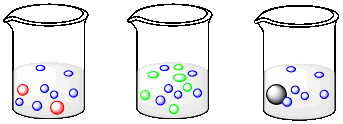
El peso de una molécula se puede determinar sumando los pesos de todos sus átomos. Por ejemplo, una molécula de dióxido de carbono tiene un peso molecular de 44 amu (el carbono es 12 amu más dos oxígenos a 16 amu cada uno). El peso de un mol de dióxido de carbono es el mismo que el peso molecular, pero en gramos en lugar de amu. Un mol de dióxido de carbono es de 44 g, es decir, el peso molecular (MW) del carbono es de 44 g/mol.
- Responder
-
El peso de 7 moléculas azules = el peso de 2 moléculas rojas. 1 molécula roja = 7/2 x el peso de una molécula azul. MW rojo = 3.5 x MW azul = 3.5 x 60 g mol -1 = 210 g mol -1.
El peso de 6 moléculas azules = el peso de 6 moléculas de naranja. MW naranja = MW azul = 60 g mol -1.
El peso de 6 moléculas azules = el peso de 1 molécula gris. MW gris = 6 x MW azul = 6 x 60 g mol -1 = 360 g mol -1.
¿Cuánto pesa un mol de cada una de las siguientes moléculas?
- óxido nítrico, NO 2
- glucosa, C 6 H 12 O 6
- benzaldehído, C 7 H 6 O
- pentóxido de fósforo, P 2 O 5
- Responder a
-
Un mol de material se corresponde con el equivalente numérico de la suma de masas atómicas en una molécula, en gramos.
masas atómicas en NO 2: 14 amu (N) + 32 amu (2 x O) = 46 amu. 1 mol de NO 2 es 46 g de NO 2.
- Respuesta b
-
180 g
- Respuesta c
-
106 g
- Respuesta d
-
142 g
¿Cuántos moles de cada uno de los siguientes compuestos hay en los pesos dados?
- 3 gramos de glucosa
- 10 gramos de benzaldehído
- 30 gramos de pentóxido de fósforo
- Responder a
-
3 g x 1 mol/180 g = 0.017 mol
- Respuesta b
-
10 g x 1 mol/106 g = 0.094 mol
- Respuesta c
-
30 g x 142 mol/g = 0.21 mol
¿Cuál es la concentración de cada una de las siguientes soluciones (en moles por litro)?
- 5 g de glucosa en 50 mL de agua
- 11 g de benzaldehído en 25 mL de THF
- 9 g de mentol (MW 156 g/mol) en 60 mL de DMF
- Contestar a
-
5 g x 1 mol/180 g = 0.028 mol; 0.028 mol/50 mL = 5.6 x 10 -4 mol/mL x 1000 ml/L = 0.56 mol L -1.
- Respuesta b
-
11 g x 1 mol/106 g = 0.104 mol; 0.104 mol/25 mL = 4.16 x 10 -3 mol/mL x 1000 ml/L = 4.2 mol L -1.
- Respuesta c
-
9 g x 1 mol/156 g = 0.058 mol; 0.058 mol/60 mL = 9.61 x 10 -4 mol/mL x 1000 ml/L = 0.96 mol L -1.

