1.6: Leyes de tarifas
- Page ID
- 78711
Hasta el momento, hemos hablado de cambios en el número de moléculas a lo largo del tiempo a medida que avanza una reacción. El número de moléculas reaccionantes disminuye a medida que aumenta el número de moléculas de producto. Prácticamente, la forma más fácil de medir la velocidad de una reacción es medir la concentración a lo largo del tiempo. Podemos medir la concentración de los reactivos o los productos. Recuerde, la concentración se refiere a cuán densamente poblada está una solución con un compuesto en particular.
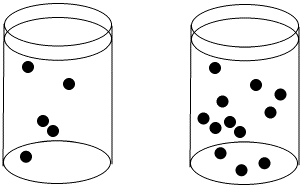
La concentración de puntos negros es mayor en el vaso de precipitados de la derecha que en el vaso de precipitados de la izquierda.
Las reacciones suelen ser monitoreadas por algún tipo de espectroscopia. En espectroscopia, la “luz” o alguna otra frecuencia de radiación electromagnética brilla a través de una muestra en la que se está produciendo una reacción. La luz puede interactuar con las moléculas de la muestra. Las moléculas absorben frecuencias particulares de luz, por lo que si la luz se encuentra con las moléculas en su camino a través de la muestra, se absorbe un poco de la luz a esas frecuencias. Menos luz lo hace todo el camino a través de la muestra; la cantidad que la hace pasar es medida por un detector en el otro lado.
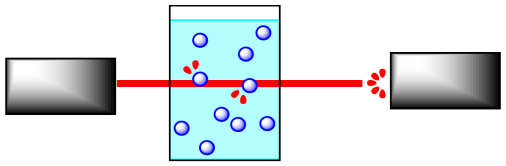
Si la concentración de la muestra es diferente, se absorberá una cantidad diferente de luz del espectrómetro. Por ejemplo, supongamos que la muestra está más concentrada. Cuantas más moléculas haya, más luz se absorbe. Y debido a que el haz de luz viaja a través de la muestra en línea recta, cuanto más concentrada sea la solución, más moléculas encontrará.
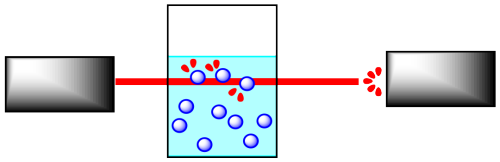
Es bastante sencillo calibrar el instrumento para poder determinar la concentración a partir de la cantidad de luz absorbida. Además, la luz puede interactuar con las moléculas reaccionantes y las moléculas del producto de diferentes maneras. Eso significa que puedes monitorear la absorción de una frecuencia que sabes que es absorbida por las moléculas reaccionantes, pero no por las moléculas del producto, y puedes detectar cambios en la concentración de reactivos. También podrías hacer lo mismo para detectar cambios en la concentración del producto.
A veces escribimos la velocidad de la reacción como:
\[Rate = \frac{d[product]}{dt} \nonumber\]
Es decir, la tasa es el cambio en la concentración del producto con cambio en el tiempo.
La concentración podría medirse en cualquier unidad. Con frecuencia, se trata de una solución, y utilizamos unidades como gramos por litro o, mucho más comúnmente, moles por litro. El cambio en el tiempo se mide con mayor frecuencia en segundos.
También podríamos escribir la velocidad de la reacción como:
\[Rate = \frac{-d[reactant]}{dt} \nonumber\]
Es decir, la tasa es el cambio en la concentración de reactivo con cambio en el tiempo. El signo menos solo significa que la reacción se está consumiendo con el tiempo a medida que se convierte en producto, por lo que su concentración está disminuyendo.
Los estudios cinéticos son importantes para comprender las reacciones. No sólo son importantes en la industria, sino que también se utilizan para entender los procesos biológicos, especialmente las reacciones catalizadas por enzimas. También juegan un papel en la química ambiental y atmosférica, como parte de un esfuerzo por comprender una variedad de temas que van desde el destino de los medicamentos recetados en las aguas residuales hasta la cascada de reacciones involucradas en el ciclo del ozono.
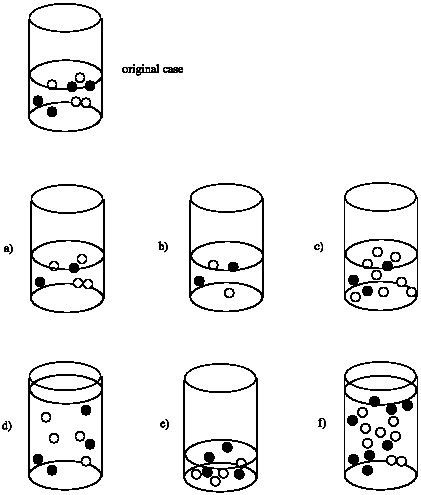
Supongamos que la velocidad de reacción entre los círculos negros y los círculos blancos depende únicamente de la concentración de los círculos negros. Es decir, tasa = k [círculo negro]. Comparar la velocidad en cada caso con la velocidad de la reacción que ocurriría en el vaso de precipitados original.
- Contestar a
-
Tasa de (a) = 1/2 x Tasa de original
- Respuesta b
-
Tasa de (b) = 1/2 x Tasa de original
- Respuesta c
-
Tasa de (c) = 3/4 x Tasa de original
- Respuesta d
-
Tasa de (d) = 1/2 x Tasa de original; aunque el número de moléculas es el mismo que el original, el volumen se duplica. Como resultado, la concentración se reduce a la mitad.
- Respuesta e
-
Tasa de (e) = 2 x Tasa de original; aunque el número de moléculas es el mismo que el original, el volumen se reduce a la mitad. En consecuencia, la concentración se duplica.
- Respuesta f
-
Tasa de (f) = Tasa de original; aunque se duplica el número de moléculas, el volumen también se duplica, dejando la concentración sin cambios.
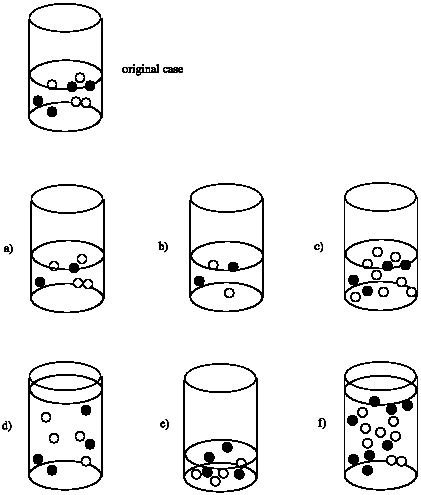
Supongamos que la velocidad de reacción entre los círculos negros y los círculos blancos depende tanto de las concentraciones de los círculos negros como de los círculos blancos. Es decir, tasa = k [círculo negro] [círculo blanco]. Comparar la velocidad en cada caso con la velocidad de la reacción que ocurriría en el vaso de precipitados original.
- Contestar a
-
Tasa de (a) = 1/2 x Tasa de original
- Respuesta b
-
Tasa de (b) = 1/2 x 1/2 = 1/4 x Tasa de original
- Respuesta c
-
Tasa de (c) = 2 x Tasa de original
- Respuesta d
-
Tasa de (d) = 1/2 x 1/2 = 1/4 x Tasa de original; aunque el número de moléculas es el mismo que el original, el volumen se duplica. Como resultado, la concentración se reduce a la mitad.
- Respuesta e
-
Tasa de (e) = 2 x 2 = 4 x Tasa de original; aunque el número de moléculas es el mismo que el original, el volumen se reduce a la mitad. Como resultado, se duplica la concentración de cada reactivo.
- Respuesta f
-
Tasa de (f) = Tasa de original; aunque se duplica el número de moléculas, el volumen también se duplica, dejando la concentración sin cambios.
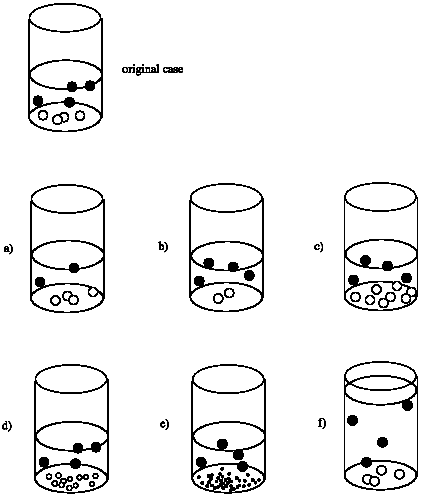
Supongamos que la velocidad de una reacción en el vaso de precipitados depende de la superficie del sólido en el fondo del vaso de precipitados. Es decir, tasa = k x (superficie de círculos blancos). Comparar la velocidad en cada caso con la velocidad de la reacción que ocurriría en el vaso de precipitados original.
- Contestar a
-
Tasa de (a) = Tasa de original; la superficie del sólido blanco parece ser la misma.
- Respuesta b
-
Tasa de (b) = 1/2 x Tasa de original; la superficie del sólido blanco parece estar cortada por la mitad.
- Respuesta c
-
Tasa de (c) = 2 x Tasa de original; la superficie del sólido blanco parece estar duplicada.
- Respuesta d
-
Los tamaños más pequeños de las partículas en (d) hacen que sea más difícil responder a esta pregunta. Supongamos que estos sólidos blancos son esféricos y que el radio de una esfera en (d) es la mitad que el de una esfera en el original. El área de superficie de una esfera es A = 4 π r 2. La relación de áreas superficiales de una esfera a otra es\ frac {A_ {1}} {A_ {2}} =\ frac {4\ pi r_ {1} ^ {2}} {4\ pi r_ {2} ^ {2}} =\ frac {r_ {1}} {r_ {2}} ^ {2}\). La relación de las áreas superficiales de una esfera original a una esfera en (d) es\(\frac{A_{d}}{A_{0}} = \frac{1}{2}^{2} = \frac{1}{4}\). Sin embargo, hay 12 esferas en (d) y sólo 4 esferas en el original. Así, la relación de las áreas superficiales totales\ (\ frac {A_ {dT}} {A_ {0T}} =\ frac {12} {4}\ veces\ frac {1} {4} =\ frac {3} {4}. La tasa estimada de (d) = 3/4 x la Tasa de original.
- Respuesta e
-
Supongamos que estos sólidos blancos son esféricos y que el radio de una esfera en (e) es un cuarto el de una esfera en el original. La relación de las áreas superficiales de una esfera original a una esfera en (e) es\(\frac{A_{e}}{A_{0}} = \frac{1}{4}^{2} = \frac{1}{6}\). No obstante, hay 40 esferas en la (e) y sólo 4 esferas en el original. Así, la relación de las áreas superficiales totales\(\frac{A_{eT}}{A_{0T}} = \frac {40}{4} \times \frac{1}{16} = \frac {5}{8}\). La tasa estimada de (e) = 5/8 x la Tasa de original.
- Respuesta f
-
Tasa de (f) = Tasa de original; la superficie del sólido blanco parece ser la misma.
A menudo, en el estudio de la cinética de reacción, la concentración cambiante de un reactivo o un producto se representa en función del tiempo. En un método, muchos puntos de datos se recogen muy temprano en una reacción (cuando menos del 5% del material ha reaccionado), y la pendiente de la línea resultante se utiliza para determinar la “tasa inicial”. Explique por qué este método podría no funcionar si los puntos de datos se trazan hasta que termine la reacción.
- Contestar
-
Al inicio mismo de la reacción, las concentraciones de reactivos no han cambiado mucho. Eso significa que la velocidad de la reacción permanece aproximadamente constante a medida que se consume el primer porcentaje de reactivos. Trazar [producto] vs. tiempo da una línea recta con la pendiente = tasa. Sin embargo, en el transcurso de la reacción, la concentración de reactivos disminuye a medida que se consumen los reactivos. Eso significa que la tasa de formación del producto se ralentiza y una gráfica de [producto] vs. tiempo se curva. No podremos medir la pendiente de una manera sencilla.
Supongamos que se obtuvieron las siguientes gráficas antes de la conversión del 5% para la reacción:
\[A + B \rightarrow C \nonumber\]
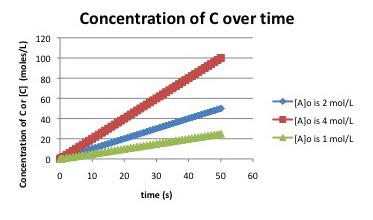
¿Qué sabes de la ley de tarifas para la reacción?
- Contestar
-
La pendiente de la primera curva, con [A] o = 1 mol L -1, se puede estimar observando que [C] aumenta de cero a 25 mmol L -1 en 50 segundos. La pendiente es de aproximadamente 25/50 = 0.5 mmol L -1 s -1. La pendiente de la siguiente curva, con [A] 0 = 2 mol L -1, es de 1.0 mmol L -1 s -1 (50 mmol L -1/50 s). La concentración inicial se duplica y la tasa se duplica. La pendiente de la curva final, con [A] 0 = 4 mol L -1, es de 2.0 mmol L -1 s -1 (100 mmol L-1/50 s). La concentración inicial se duplica y la tasa se duplica. La reacción depende linealmente de la concentración de A. Lo que pase con [A] también le sucede a la velocidad.
En cuanto a las leyes de tarifas, existe un enfoque matemático para demostrar esta relación.
Supongamos\(Rate = k [A]^{x}\); x es el poder de la relación matemática.
La relación de tasas en dos experimentos es\(\frac{Rate_{1}}{Rate_{2}} = \frac{k[A_{1}]^{x}}{k[A_{2}]^{x}}\).
Si tomamos el logaritmo de ambos lados:\(ln \frac{Rate_{1}}{Rate_{2}} = ln (\frac{[A_{1}]}{[A_{2}]})^{x} = x ln \frac{A_{1}}{A_{2}}\)
Entonces\(x = ln \frac{Rate_{1}}{Rate_{2}}/ ln \frac{[A_{1}]}{[A_{2}]}\)
Supongamos que se obtuvieron las siguientes gráficas antes de la conversión del 5% para la reacción:
\[A + B \rightarrow C \nonumber\]
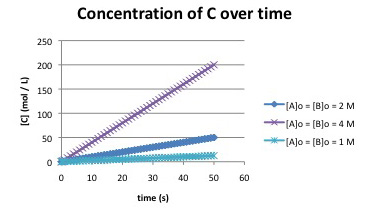
a) ¿Cuál es una ley de tasa posible para la reacción?
b) Dos leyes diferentes de tarifas podrían explicar estos datos. ¿Cuál es la segunda ley de tarifas posibles?
c) Proponer un experimento para distinguir entre estas dos posibles leyes tarifarias.
- Contestar a
-
Cada vez que las concentraciones se duplican (por ejemplo, de 2 a 4 mol L -1), la tasa se cuadruplica (por ejemplo, de 50/50 = 1 mmol L -1 s -1 a 200/50 = 4 mmol L -1 s -1). Una explicación es\(Rate = k[A][B]\)
- Respuesta b
-
Otra explicación es\(Rate = k[A]^{2}\) o\(Rate = k[B]^{2}\).
- Respuesta c
-
Podríamos ejecutar una serie de experimentos en los que [A] se cambia manteniendo [B] constante (o viceversa).
Supongamos que se obtuvieron los siguientes datos monitoreando la siguiente reacción hasta su finalización:
\[A + B \rightarrow C \nonumber\]
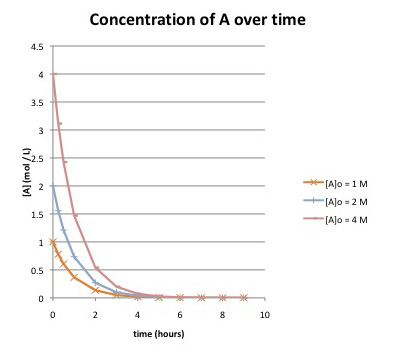
a) Cuánto tiempo tarda hasta que la reacción se termina esencialmente, si la concentración inicial de A es:
i) ¿1 mol/L?
ii) ¿2 mol/L?
iii) ¿4 mol/L?
b) ¿Qué sabe de la ley tarifaria para la reacción? Explique.
Supongamos que se obtuvieron los siguientes datos monitoreando la siguiente reacción hasta su finalización:
\[A + B \rightarrow C \nonumber\]
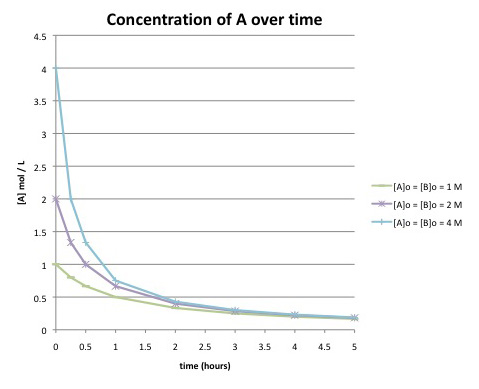
Compara esta gráfica con la del problema anterior. ¿Qué diferencias puedes detectar en las curvas? ¿Crees que esta reacción tiene la misma ley de tarifas que la anterior?

