1.7: Reacciones elementales
- Page ID
- 78679
El mecanismo de una reacción es una serie de pasos que conducen desde los materiales de partida hasta los productos. Después de cada paso, se forma un intermedio. El intermedio es efímero, porque rápidamente se somete a otro paso para formar el siguiente intermedio. Estos sencillos pasos se llaman reacciones elementales.
Debido a que una reacción general está compuesta por una serie de reacciones elementales, la velocidad general de la reacción depende de alguna manera de las velocidades de esas reacciones más pequeñas. Pero, ¿cómo están relacionados los dos?
Veamos dos casos. Lo mantendremos simple y ambos casos serán reacciones de dos pasos.
El primer caso comienza con una reacción que tiene una barrera de activación bastante baja. A lo mejor hay mucha vinculación involucrada al principio, por lo que esta reacción tiene un comienzo fácil. Sin embargo, después de eso, las cosas se ponen más difíciles. El segundo escalón tiene una mayor barrera de activación.
Ambas reacciones ocurren a tasas particulares. El primer paso tiene una barrera baja, por lo que ocurre rápidamente. El segundo escalón tiene una barrera alta, por lo que ocurre sólo lentamente.
En ese caso, el intermedio se formará rápidamente y se sentará un rato antes de que el segundo paso tenga oportunidad de suceder. El segundo paso es como un cuello de botella o un atasco de tráfico. No importa lo rápido que vayan las cosas en el primer paso, la reacción tiene que esperar para pasar por el segundo paso. La velocidad de la reacción general realmente depende del segundo paso. Llamamos a este paso el “paso determinante de la tasa”.
Cada paso tiene su propia constante de velocidad asociada a él. Llamaremos a estas constantes k 1 y k 2. Cuanto menor sea la barrera, más rápida será la tasa y mayor será la constante de velocidad.
Podemos predecir leyes de tasas para reacciones elementales (aunque lo mismo no es cierto para las reacciones generales). La ley de velocidad para una reacción elemental es simplemente su constante de velocidad, multiplicada por las concentraciones de cualquier especie involucrada en ese paso.
La tasa de formación del producto estará determinada por la velocidad de ese segundo paso, el paso determinante de la velocidad. La velocidad de ese segundo paso es la constante de velocidad, k 2, multiplicada por la concentración del intermedio.
\[\frac{d[Product]}{dt} = k_{2}[Intermediate]\]
Pero, ¿cuál es la concentración del intermedio? El intermedio se produce en el primer paso, por lo que su concentración depende de la rapidez con la que se produzca a partir de los reactivos. Sin embargo, si la barrera de activación es baja, ese primer paso puede ser reversible; realmente puede ser una reacción de equilibrio. Entonces hay un tercer paso en esta reacción, y va hacia atrás del intermedio al reactivo. Llamaremos a la constante de velocidad para este paso k -1.
En términos de cinética, un equilibrio es realmente solo una relación de pasos hacia adelante y hacia atrás. Si el paso adelante es mucho más rápido, esta relación es mayor que uno, y se favorecen los productos. Si el paso inverso es mucho más rápido, la relación es menor que uno, y se favorecen los reactivos.
\[K_{eq} = \frac{k_{1}}{K_{-1}} = \frac{[Intermediate]}{[Reactant]}\]
O, reordenando,
\[\frac{k_{1}}{k_{-1}} [Reactant]=[Intermediate]\]
Ahora conocemos la concentración del intermedio. Eso significa que la velocidad de la reacción general es
\[\frac{d[Product]}{dt}= \frac{k_{2}k_{1}}{k_{-1}}[Reactant]\]
La lección para llevar a casa es esta: el segundo paso es el paso determinante de la tasa, por lo que ese paso nos dice qué tan rápido se forma el producto. Sin embargo, ese paso depende de un intermedio formado en un paso anterior, por lo que ese paso anterior también influye en la rapidez con la que se forma el producto.
- La etapa de determinación de la velocidad controla la velocidad de la reacción.
- Las etapas previas a la etapa de determinación de la velocidad influyen en la velocidad de la reacción suministrando los intermedios necesarios para la etapa de determinación de la velocidad.
Ahora pensemos en el caso contrario. Supongamos que el primer escalón tiene una barrera muy alta y el segundo escalón tiene una menor. Tenemos que esperar y esperar y esperar a que se produzca el intermedio, pero una vez que está ahí, reacciona bastante rápido para dar productos.
En este caso, el primer paso es el paso determinante de la tasa. Ese es el paso que controla la velocidad de la reacción. Tan pronto como ese paso continúe, el resto de la reacción puede ocurrir rápidamente.
En este caso,
\[\frac{d[Product]}{dt} = k_{1}[Reactant]\]
- Cualquier paso después de la etapa de determinación de la velocidad no influye en la velocidad de la reacción.
En algunos casos, podemos usar nuestro juicio para tratar de predecir qué estados de transición son los más altos en energía en un mecanismo de varios pasos. Sin embargo, gran parte del conocimiento sobre lo que está sucediendo entre el reactivo y el producto provendría realmente de la química computacional. En la química computacional, las energías de los intermedios y los estados de transición se pueden calcular usando mecánica cuántica. Esta tarea no es necesariamente fácil.
Considera la reducción de borohidruro de una cetona en metanol.
- Dibuja un mecanismo para esta reacción. (Si conoces la reacción que compite entre borohidruro y metanol, ignórala. Si no sabías nada de eso, olvida que dije algo.)
- Asignar constantes de velocidad (k 1, k 2, k 3...) para cada paso elemental en la reacción.
- Uno de los pasos a lo largo de esta reacción es probablemente reversible. ¿Cuál? ¿Por qué?
- ¿Cuál crees que es el paso determinante de la tasa en esta reacción?
- Dibuja un diagrama de progreso de reacción para esta reacción.
- Predecir una ley de velocidad para esta reacción.
- Contestar a
-
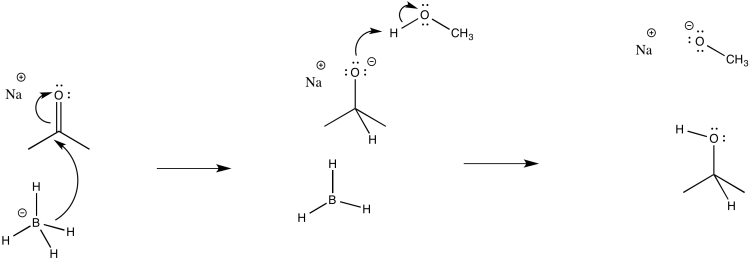
- Respuesta b
-
El primer paso procede en k 1; el segundo en k 2.
- Respuesta c
-
El segundo paso es probablemente reversible. Es sólo el intercambio de un protón de un grupo OH a otro.
- Respuesta d
-
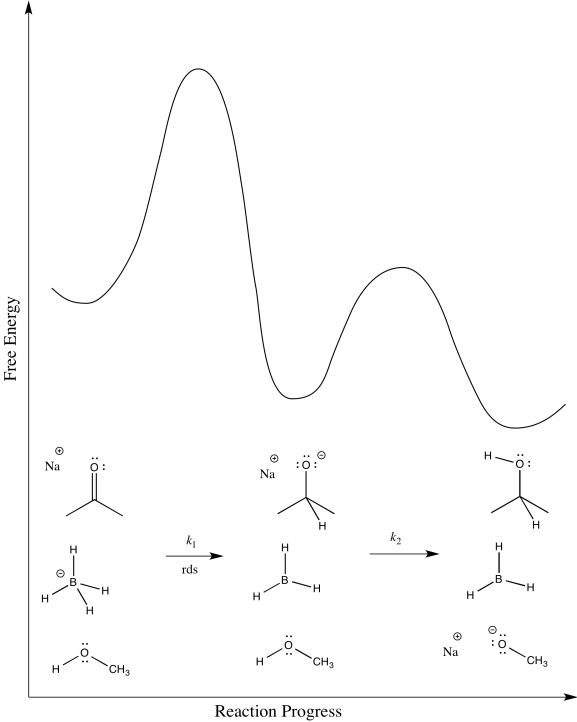
- Respuesta e
-
\[Rate = k_{1}[ketone][NaBH_{4}] \nonumber\]
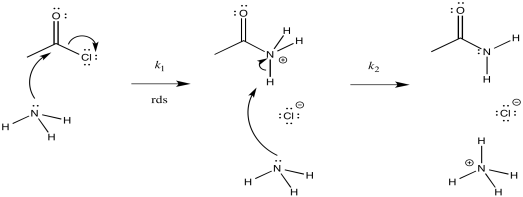
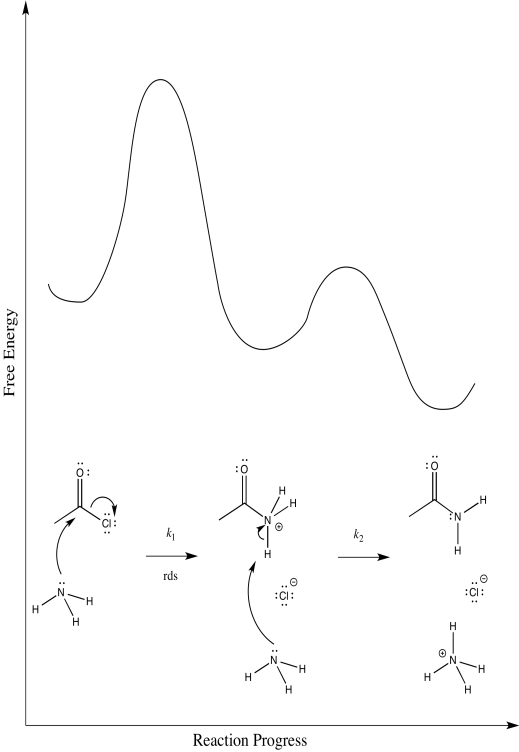
Considera la amonólisis del cloruro de acetilo.
- Dibuja un mecanismo para esta reacción.
- Asignar constantes de velocidad (k 1, k 2, k 3...) para cada paso elemental en la reacción.
- Dibuje diagramas de progreso de reacción alternativos para esta reacción. En cada caso, asuma un paso de determinación de velocidad diferente.
- Predice la ley de tasas correspondiente a cada uno de tus posibles diagramas de progreso de reacción. ¿Se puede utilizar la ley tarifaria para distinguir entre todas las posibilidades?
- Considera tus diagramas alternativos de progreso de reacción y decide cuál es el más probable. Justifica tus elecciones para eliminar la otra (s).
- Predecir una ley de velocidad para esta reacción.
- Contestar a
-
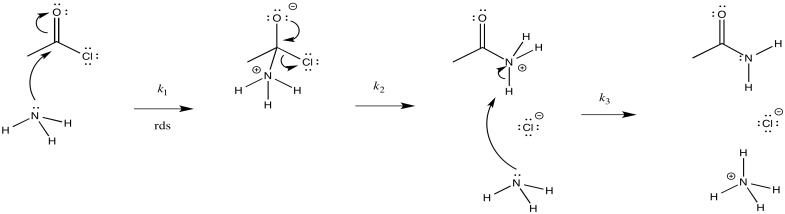
- Respuesta b
-
El primer paso procede en k 1; el segundo en k 2; el tercero en k 3.
- Respuesta c
-
Hay tres pasos diferentes, cada uno de los cuales podría ser determinante de la tasa.
El primero:
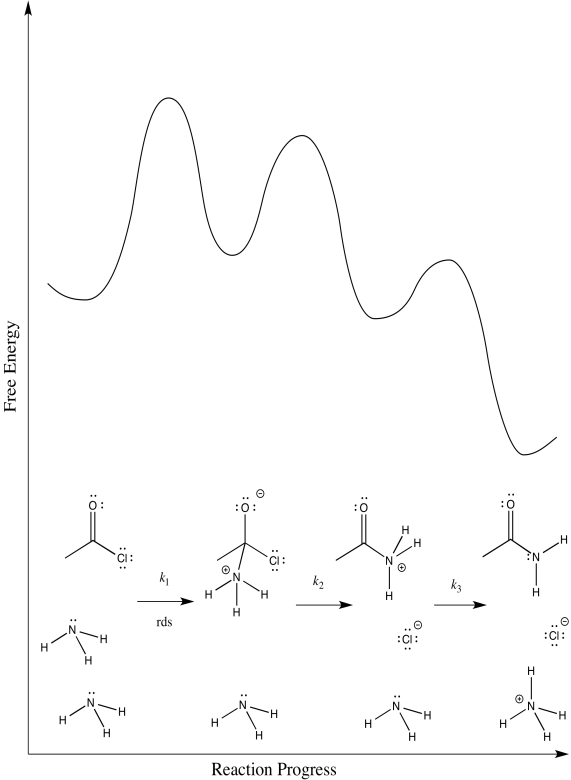
El segundo:
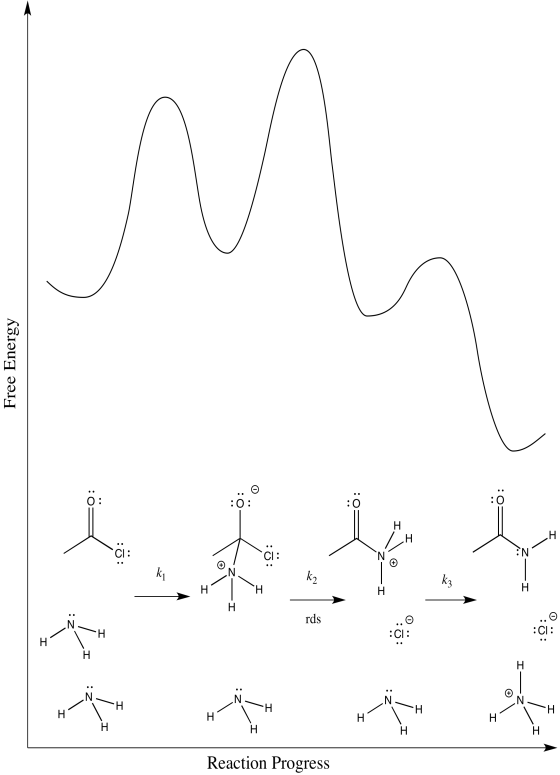
El tercero:
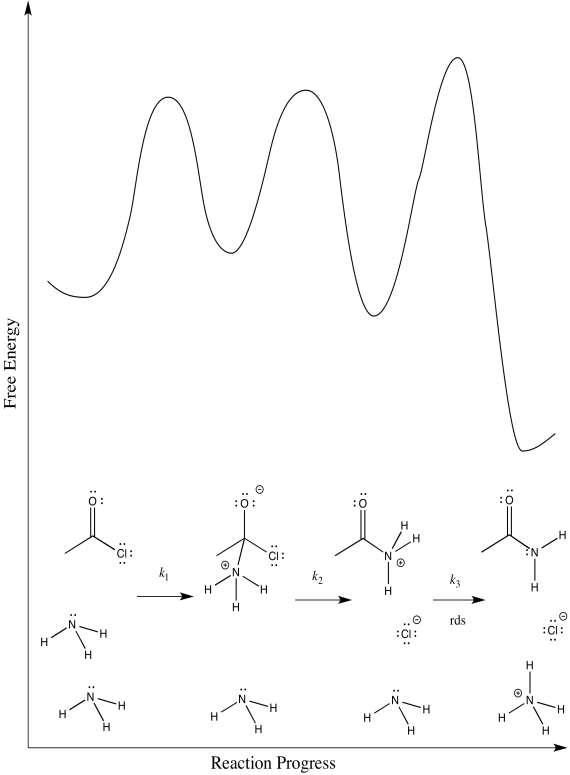
- Respuesta d
-
Primera:\(Rate = k_{1}[CH_{3}COCl][NH_{3}]\)
Segundo:\ (Tasa = k_ {1} k_ {2} [CH_ {3} CoCl] [NH_ {3}]
Tercero:\(Rate = k_{1}k_{2}k_{3}[CH_{3}COCl][NH_{3}]^{2}\)
La ley tarifaria podría utilizarse para distinguir la tercera de las dos primeras. No obstante, sería imposible decir la diferencia entre los dos primeros utilizando únicamente la ley de tarifas.
- Respuesta e
-
Probablemente podamos descartar la tercera posibilidad de inmediato. Las transferencias de protones tienden a ocurrir con bastante rapidez, especialmente en presencia de una base razonable como el amoníaco. Medir la ley de tarifas confirmaría rápidamente esta suposición.
Los escenarios 1 y 2 son mucho más difíciles de distinguir. En ambos casos, se está rompiendo un vínculo ya que se está haciendo otro vínculo. Podríamos hacer una suposición educada de que la formación del buen grupo de salida de cloruro es bastante fácil; eso haría del paso 1 el paso determinante de la tasa.
No obstante, siempre nos queda cierta ambigüedad en casos sutiles como éste. Para tener una mejor idea sobre qué estados de transición son los más altos, tendríamos que realizar química computacional.
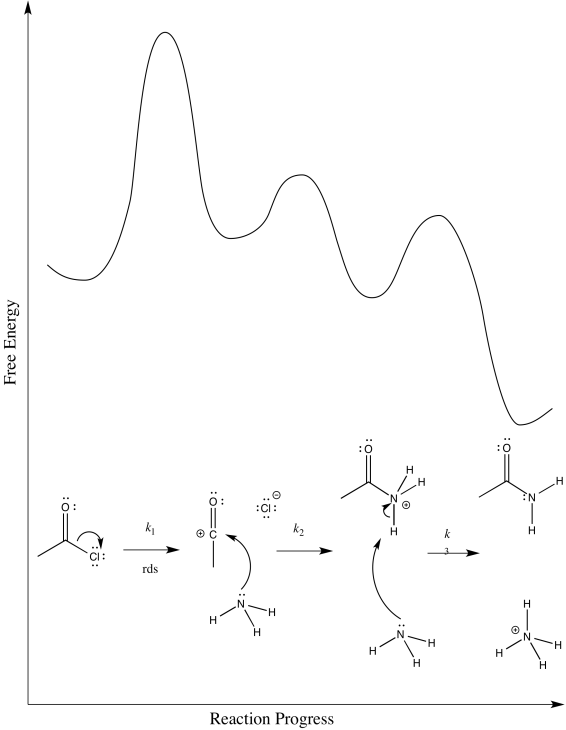
Existen otros dos mecanismos posibles para la amonólisis del cloruro de acetilo. Ya sabes que no son el mecanismo adecuado, pero veamos la razón por la que sabemos eso.
- La primera posibilidad es que el ion cloruro salga en el primer paso. El amoníaco entra después.
- Dibuja este mecanismo.
- Proporcionar un diagrama de progreso de reacción.
- Identificar el paso determinante de la tasa y la ley de tarifas.
- La segunda posibilidad es que el cloruro se expulsa a medida que entra el amoníaco (en lugar de romper el enlace C=O π). Dibuja este mecanismo.
- Dibuja este mecanismo.
- Proporcionar un diagrama de progreso de reacción.
- Identificar el paso determinante de la tasa y la ley de tarifas.
- Dada la ley experimental de tarifas\(\text{Rate} = k [\ce{CH3COCl}][\ce{NH3}]\), ¿se puede descartar alguna de estas posibilidades?
- Contesta a i
-
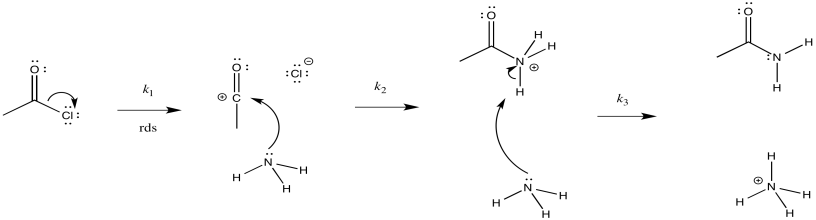
- Responder a ii
-
- Responder a iii
-
\[Rate = k_{1}[CH_{3}COCl] \nonumber\]
- Respuesta b i
-
- Respuesta b ii
-
- Respuesta b iii
-
\[Rate = k_{1}[CH_{3}COCl][NH_{3}] \nonumber\]
- Respuesta c
-
Sobre la base de la ley tarifaria, se puede descartar la posibilidad a), pero no la posibilidad b
Otro experimento comúnmente utilizado en cinética es un experimento de efecto de isótopos cinéticos. Aunque dos isótopos de un átomo tienen propiedades casi idénticas, la diferencia de masa entre los dos isótopos puede causar diferencias sutiles en las velocidades de reacción. Por razones bastante complicadas, dos isótopos muestran diferentes sensibilidades a los cambios de geometría que ocurren hasta e incluyendo el paso de determinación de la velocidad.
Por ejemplo, si el carbono carbonilo en el cloruro de acetilo es reemplazado por un isótopo de 13 C (normalmente es de 12 C), reaccionará a una velocidad diferente a la del compuesto normal, pero solo si ese carbono experimenta un cambio de geometría en algún momento antes de que termine la etapa de determinación de la velocidad. Si los dos compuestos reaccionan a la misma velocidad, no se ha producido tal cambio de geometría.
La relación de las velocidades de reacción de CH 3 13 COCl: CH 3 12 COCl es de aproximadamente 0.9.
- ¿Qué le dice esta observación sobre el mecanismo?
- ¿Descarta alguna posibilidad en el Ejercicio\(\PageIndex{3}\)?
- Contestar a
-
Hay un cambio de geometría antes o durante el paso de determinación de la velocidad.
- Respuesta b
-
Se puede descartar la posibilidad (b).
a) Dibujar el producto de la siguiente reacción.
b) Proporcionar un mecanismo para la reacción.
c) Describir brevemente lo que se entiende por el término “termodinámica” en el contexto de la reactividad.
d) Definir brevemente lo que se entiende por el término “cinética” en este contexto.
e) ¿En qué paso del mecanismo es ΔS positivo?
f) Escribe una ley de tasa para la reacción basada en tu mecanismo.
g) ¿Qué sucede con la velocidad de reacción a medida que aumenta la temperatura?
h) ¿Qué nos dice la teoría de colisiones sobre las tasas de reacción?
i) Se observaron las siguientes constantes de velocidad para la reacción que involucra diferentes sustituyentes X.
| -X | k mol L -1 s -1 |
| -OCH 3 | 0.17 |
| -SCN | 1.76 |
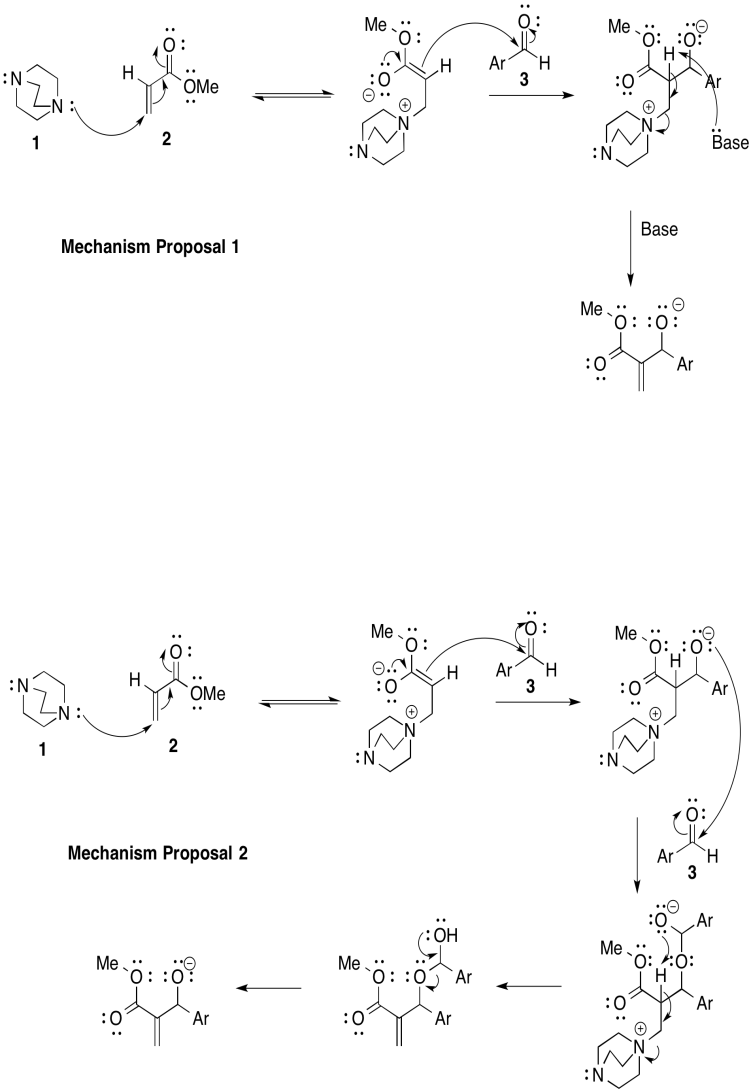
La reacción de Bayliss-Hillman se usa ampliamente en síntesis de productos farmacéuticos. Sin embargo existen dos mecanismos posibles, que se muestran a continuación (Price, Broadwater, Walker y McQuade, J. Org. Chem., 2005, 70, 3980-3987).
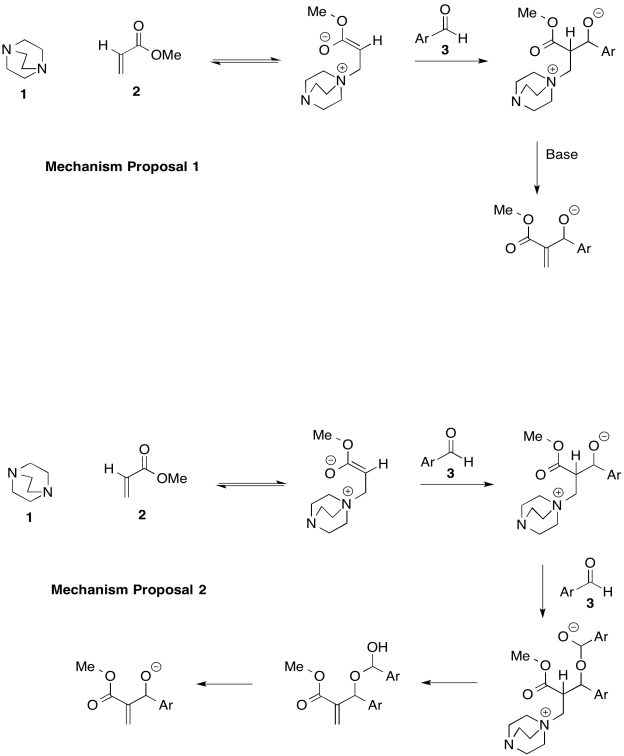
- Proporcione flechas para mostrar el flujo de electrones para cada mecanismo.
- Proporcionar una ley de tasas para cada propuesta mecanicista, basada en las concentraciones de los compuestos 1, 2 y 3.
- Indicar el orden en cada compuesto con base en las gráficas a continuación.
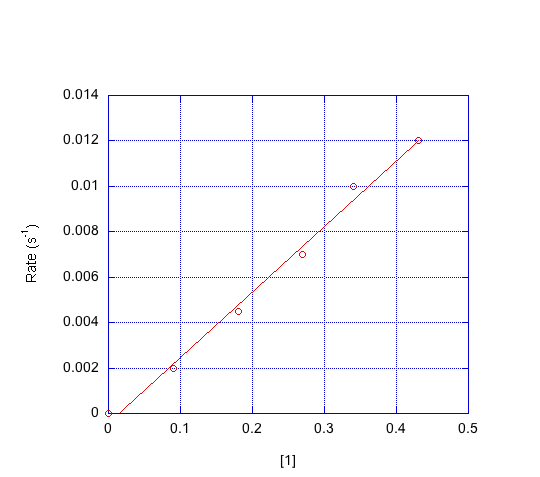
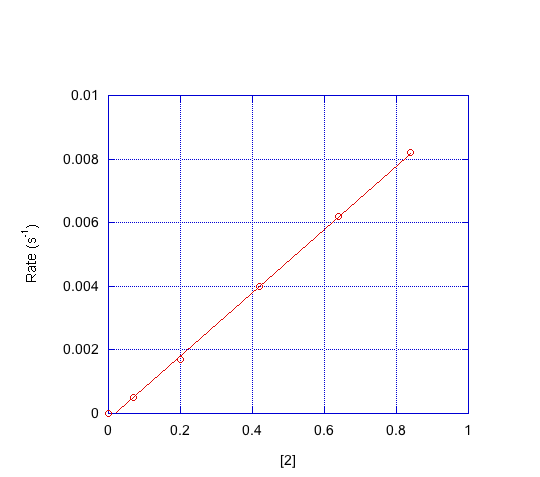
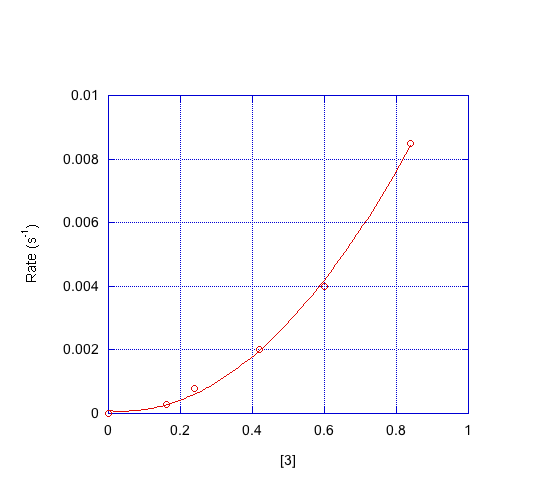
d) ¿Qué mecanismo es consistente con los datos?
- Contestar a
-
- Respuesta b
-
Mecanismo 1: k [1] [2] [3]
Mecanismo 2: k [1] [2] [3] 2
- Respuesta c
-
Primer orden en [1]; primer orden en [2]; segundo orden en [3]
- Respuesta d
-
Mecanismo 2.

