4.4: Estereoquímica
- Page ID
- 78890
Además de medir las velocidades de reacción y deducir la ley de velocidad, existen otras líneas de evidencia que pueden sugerir cómo está ocurriendo la reacción. Para la sustitución nucleofílica alifática, la estereoquímica de los productos proporciona alguna evidencia adicional.
Supongamos que lleva a cabo una reacción de sustitución nucleofílica utilizando un material de partida quiral. Usted decide convertir (S) -3-clorooctano en la azida correspondiente. Las azidas son reactivos bastante utilizados (pero ligeramente peligrosos y potencialmente explosivos). Se emplean en una clase de reacciones llamadas “química clic”; acabas de escuchar sobre estas reacciones y quieres probar una por ti mismo.

Tienes un control completo sobre el mecanismo de la reacción (no es tan fácil en la realidad, pero en este experimento de pensamiento puedes ajustar el dial de tu placa de revolver al mecanismo deseado). Usted elige hacer que la reacción ocurra a través de una vía S N 2.
Sabes que el producto será quiral, por lo que planeas verificar su rotación óptica. El problema es que, una vez terminada la reacción, la rotación óptica es exactamente lo contrario de lo que esperabas, basado en los valores de otros compuestos como este. Hiciste la reacción con éxito pero obtuviste el enantiómero inesperado.
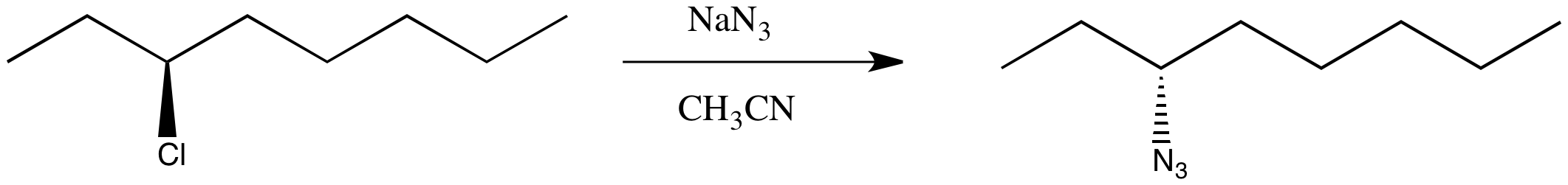
No estás preocupado. Has estado tomando esta clase ingeniosa de química y tienes una idea de otra cosa que probar. Esta vez seleccionas una vía S N 1.
Termina la reacción y obtiene el producto correcto, pero no muestra rotación óptica alguna. Esta vez tienes una mezcla racémica.
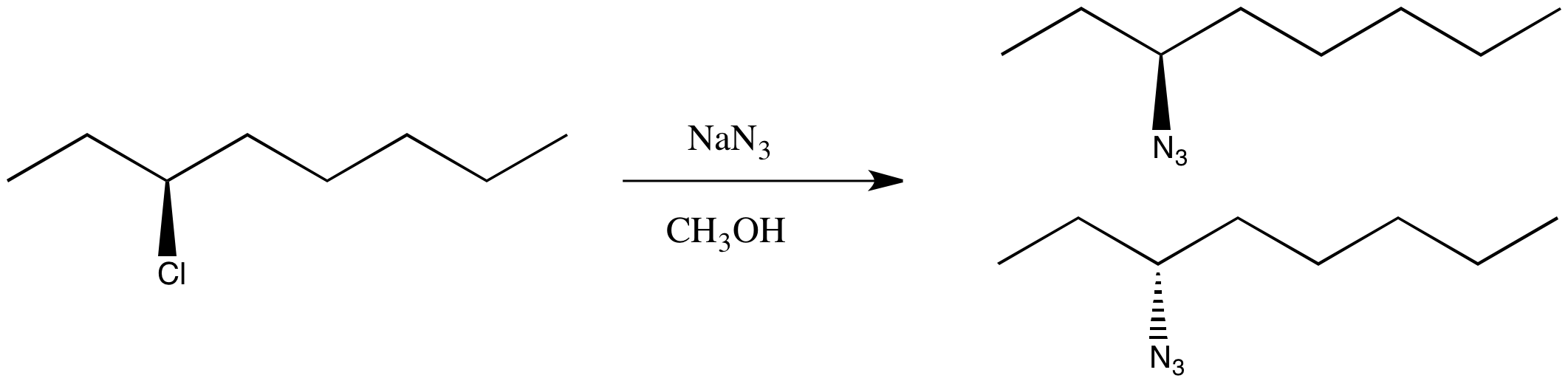
Esto es solo un experimento mental, pero ¿qué significaría todo esto? ¿Por qué el cambio de mecanismo podría influir en la estereoquímica?
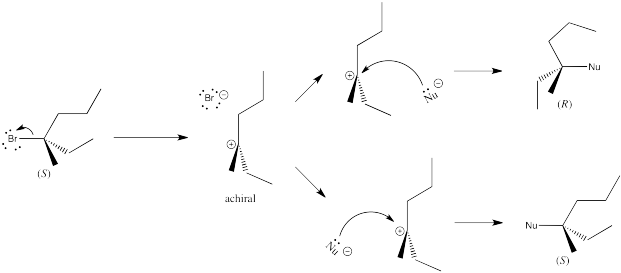
Esto es solo un experimento mental, pero los resultados son generalmente ciertos: en una reacción de S N 2, el centro quiral sufre una inversión. La disposición tridimensional de los grupos alrededor del centro quiral es lo opuesto a cómo comenzó. En una reacción de S N 1, el centro quiral se somete a racemización. Hay una mezcla 50:50 de enantiómeros.
- Proponer razones por las que la estereoquímica voltearía en una reacción de S N 2. Un dibujo ayudará.
- Proponer razones por las que una mezcla igual de estereoisómeros resultaría de una reacción de S N 1. Un dibujo ayudará.
- Contestar
-

Es posible que hayas notado que se utilizaron dos disolventes diferentes en las dos reacciones anteriores. Proponer una razón por la cual este cambio en el solvente puede llevar a un cambio en el mecanismo.
- Contestar
-
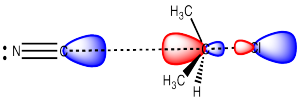
En una reacción de S N 2, el nucleófilo dona electrones al carbono electrófilo, desplazando al grupo de salida del otro lado. El nucleófilo dona sus electrones al orbital molecular desocupado más bajo, el cual muestra un lóbulo lage en el lado del carbono opuesto al grupo de salida.
Como resultado, el nucleófilo siempre se acerca desde el lado opuesto del carbono electrófilo como la ubicación del grupo de salida, y termina en el lado opuesto de donde estaba el grupo del grupo de salida.
- Las reacciones de S N 2 en los centros quirales conducen a la inversión o “inversión” del centro quiral.
Por otro lado, en una reacción de SN1, el nucleófilo ingresa sólo después de que el grupo de salida se haya ido. En ese punto, el carbono electrófilo es un catión, por lo que es plano trigonal porque solo tiene tres grupos unidos a él. El nucleófilo podría acercarse fácilmente desde cualquier lado.

Las reacciones de S N 1 en centros quirales conducen a mezclas racémicas.
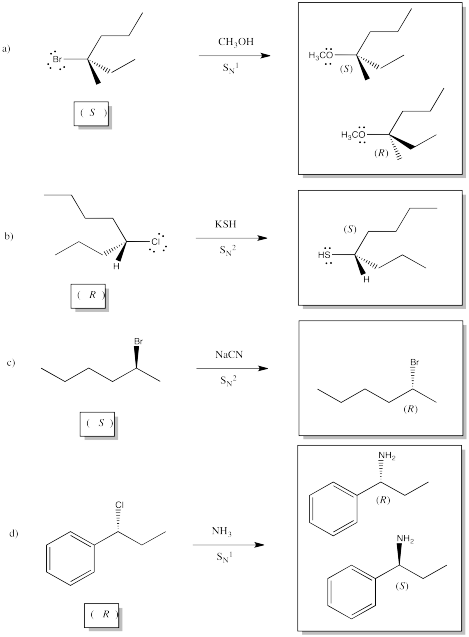
Mostrar los productos de las siguientes reacciones, e indicar la configuración estereoquímica del material de partida y el producto en cada caso.
Contestar-
La lección aquí se puede replantear de la siguiente manera: el mecanismo afecta el resultado estereoquímico de la reacción. Explicar por qué ese hecho es importante en el contexto de la elaboración de un medicamento quiral para el mercado farmacéutico.

