4.5: Regioquímica
- Page ID
- 78791
Regioquímica es el término para donde se producen cambios en una reacción. Puede ser otro indicio de cómo ocurrió la reacción.
En la sustitución nucleofílica alifática, la respuesta parece bastante obvia: la reacción tiene lugar en el carbono electrófilo, el unido al halógeno electronegativo. Ahí es donde está el grupo que se va. Cuando se reemplaza el grupo de salida, ahí es donde estará el nucleófilo. Pero esto no siempre es cierto.
- En una reacción de S N 2, el nucleófilo siempre se encuentra en el carbono donde solía estar el grupo lábil.
- En una reacción de S N 1, el nucleófilo generalmente se encuentra en el carbono donde solía estar el grupo lábil. A veces se mueve.
En algunas circunstancias, se producen cambios inesperados. Las siguientes dos reacciones son ejemplos de tales sorpresas. Estas reacciones ocurren a través de un mecanismo S N 1.

Entonces, la regioquímica de esta reacción puede ser más complicada de lo que pensábamos.
¿Qué está pasando en estas dos reacciones? En una de ellas, el bromo simplemente salta de un lugar a otro a lo largo de la molécula. Parte del compuesto original permanece, también, por lo que hay una mezcla. Sin embargo, si miras cuidadosamente, el bromo ha cambiado de lugar con un átomo de hidrógeno. No parece que ese átomo de hidrógeno pueda desprenderse muy fácilmente.
En la otra reacción, algo muy similar está sucediendo. Tanto el bromuro como el cloruro tienen pares solitarios, por lo que ambos pueden ser nucleófilos así como grupos salientes, y uno puede reemplazar al otro. Hay mucho cloruro alrededor, por lo que supera cualquier bromuro al carbono electrófilo. Una vez más, sin embargo, parte del cloruro parece terminar en el lugar equivocado.
Este tipo de comportamiento es característico de los carbocationes. Se llama un reordenamiento, en el que parte de la molécula cambia de lugar inesperadamente.
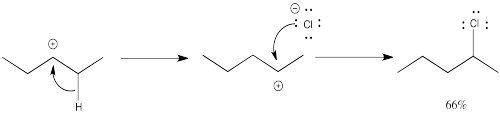
Nuevamente, uno de los productos se forma de una manera bastante sencilla.
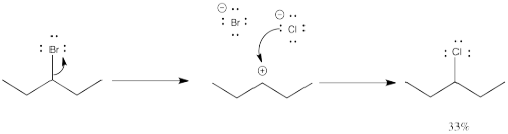
La formación del otro producto implica un “desplazamiento 1,2-hidruro”. En este evento, un anión hidrógeno salta de un carbono al siguiente, dejando un catión donde solía estar.
Dibujar la reacción anterior con todos los hidrógenos dibujados en las estructuras, para confirmar las cargas formales y las posiciones de los hidrógenos.
- Contestar
-

Explicar las proporciones de producto observadas en la reacción anterior.
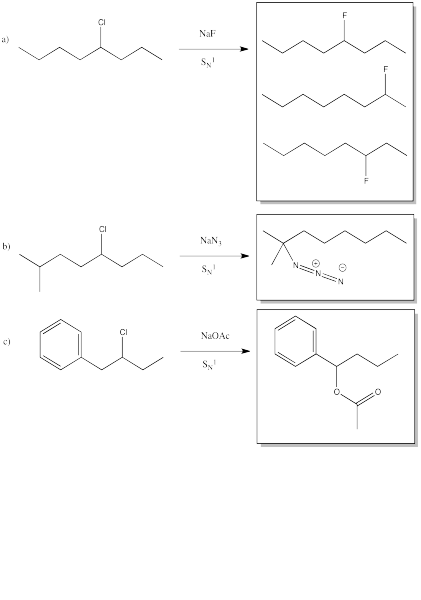
Predecir los productos de las siguientes reacciones.
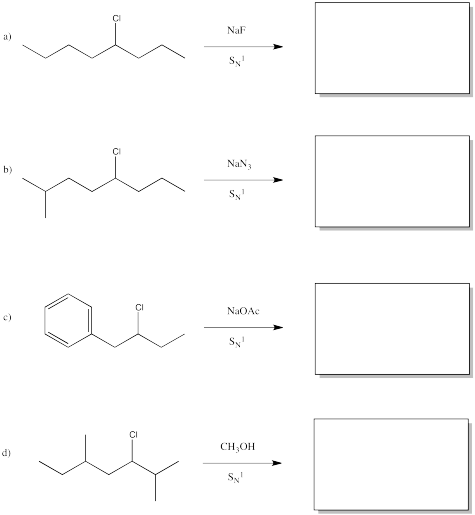
Contestar-
El hidruro puede saltar un carbono debido a la proximidad al orbital p vacío con el que puede solaparse y formar un nuevo enlace.

La barrera para un desplazamiento de hidruro no es muy alta, siempre que esté disponible un carbocatión en el siguiente carbono. Como resultado, se establece un equilibrio entre cationes con bastante rapidez. A continuación, hay un equilibrio entre dos cationes secundarios en el esqueleto de 2-metilpentil.

Sin embargo, esa estructura particular tiene otro posible catión que es más estable. Una vez que se forma un catión terciario, no es probable que el hidruro retroceda.
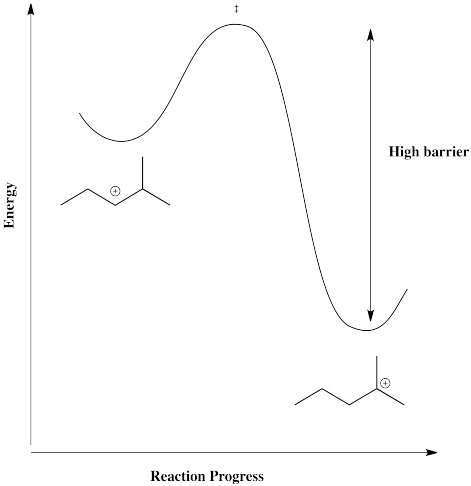
Por otro lado, también hay una posición primaria. Un desplazamiento de hidruro podría dar un catión primario, pero eso no es probable que suceda, porque sería demasiado cuesta arriba.

En conjunto, hay una superficie de energía que une varios cationes diferentes posibles. En este caso, sin embargo, un catión terciario dominaría rápidamente.

No son solo los iones hidruro los que pueden sufrir migraciones 1,2-. Los aniones alquilo (como metilo, CH 3 -) y aniones arilo (como fenilo, C 6 H 5 -) también pueden sufrir 1,2 desplazamientos, reordenándose para dar cationes estables.
Por ejemplo, la siguiente reacción es aparentemente solo una sustitución de un grupo bromo por un grupo hidroxi. La regioquímica indica que se formó un catión, sin embargo, debido a que el nuevo grupo se encuentra en el sitio del carbocatión más estable.

El mecanismo aquí implica la protonación del grupo hidroxi; la reacción se lleva a cabo en ácido fuerte y concentrado. El catión resultante es capaz de sufrir un desplazamiento 1,2-metilo que conduce a un nuevo carbocatión. El ion bromuro se conecta en esa nueva posición.


