4.6: Factores estructurales que influyen en el mecanismo
- Page ID
- 78779
Si pueden ocurrir dos posibles mecanismos, puede haber algunos factores que influyen en el curso de la reacción, volcándola de una manera u otra. Uno de los factores más importantes que determinan el mecanismo de sustitución nucleofílica alifática es la estructura del haluro de alquilo.
El mecanismo S N 1 implica la formación de un carbocatión. La estabilidad iónica suele ser un factor muy importante que influye en la facilidad con la que se produce una reacción. Es lógico pensar que, cuanto más estable sea el catión que se forma, más fácilmente puede ocurrir un mecanismo S N 1.
Existe una tendencia simple de que los carbocationes más sustituidos son más estables que los menos sustituidos. Por más sustituidos, nos referimos a carbocationes en los que el carbono que porta la carga positiva se une a más carbonos y menos hidrógenos. Un carbocatión terciario es más estable que un secundario, un secundario es más estable que un carbocatión primario y un primario es más estable que un catión metilo.
Esta tendencia suele explicarse por la hiperconjugación en el catión más sustituido. En la hiperconjugación, los orbitales de enlace σvecinos se superponen con el orbital π-orbital vacío que es el centro del carbocatión.

Esa donación electrónica de los orbitales de unión σocupados ayuda a deslocalizar la carga positiva, bajando la carga positiva sobre el carbono central y colocando un poco de ella sobre los circundantes. Energéticamente, la interacción es favorable porque los electrones en los orbitales de enlace σse reducen estabilizados por deslocalización.

En general, las reacciones de S N 1 ocurren mucho más fácilmente cuando el haluro se une a un carbono más sustituido. El carbocatión resultante se forma más fácilmente en lo que de otro modo es el paso más difícil en la reacción. Las reacciones de S N 1 ocurren más fácilmente en los carbonos terciarios, moderadamente bien en los secundarios y muy lentas en los primarios, si acaso.
Aunque pueden considerarse haluros de alquilo primarios, compuestos como el cloruro de bencilo y el bromuro de alilo son capaces de reacciones sin efecto de S N 1. Mostrar por qué.
- Responder
-
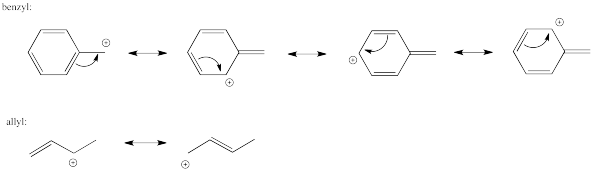
Las reacciones de S N 2 no experimentan intermedios altamente cargados, por lo que la estabilidad iónica es menos importante en esa vía. Por otro lado, existe un marcado contraste entre las reacciones de S N 1 y las reacciones de S N 2 en términos de efectos estéricos. Las reacciones de S N 1 ocurren a través de un intermedio plano trigonal, el cual está menos abarrotado estéricamente que el material de partida. Las reacciones de S N 2 no ocurren a través de un intermedio, pero el estado de transición a través del cual proceden es en realidad cinco coordenadas; el carbono electrófilo se llena más a medida que avanza la reacción. Los efectos estéricos son mucho más importantes en esta vía concertada.

Comparando el enfoque al estado de transición en una serie de haluros de alquilo de diferente sustitución, podemos ver algunas diferencias estéricas. Las imágenes muestran una instantánea muy temprano en la reacción, cuando el nucleófilo apenas se acerca al electrófilo pero la reacción aún no está realmente comprometida. Comparando estas imágenes, parece muy probable que el nucleófilo siga avanzando en el caso superior, con el metilo. En el caso inferior, con el haluro terciario, lo más probable es que el nucleófilo simplemente rebote en los grupos metilo antes de que pueda conectarse con el carbono electrófilo.

Como resultado, es más probable que las reacciones de S N 2 ocurran con haluros de alquilo menos sustituidos. Se presentan muy fácilmente con haluros de metilo y haluros de alquilo primario. Se presentan moderadamente bien en haluros de alquilo secundario, pero solo con dificultad en haluros de alquilo terciario.
En cada uno de los siguientes casos, ¿es probable que la sustitución nucleofílica proceda a través de una reacción de S N 1 o S N 2?

Contestar a-
Tenga en cuenta que hay otros factores que pueden influir en la vía de reacción; lo que tenemos aquí son solo los mecanismos más probables.
S N 2
- Respuesta b
-
Ambas vías son muy posibles
- Respuesta c
-
Ambas vías son muy posibles
- Respuesta d
-
S N 2
- Respuesta e
-
S N 2
- Respuesta f
-
S N 2
- Respuesta g
-
S N 1
- Respuesta h
-
S N 1
- Respuesta i
-
S N 1
- Responder j
-
S N 1

