4.7: Efectos Solventes
- Page ID
- 78875
A menudo hay varios factores que pueden influir en el curso de una reacción. Probablemente lo más importante es la estructura del haluro de alquilo, pero el disolvente también puede jugar un papel.
La diferencia crucial entre las reacciones de S N 1 y S N 2 es la etapa de ionización en la vía de S N 1. Los factores que estabilizan los iones, y ayudan en la ionización, promueven esta vía.
En general, los disolventes más polares suelen ser útiles en las sustituciones nucleofílicas; el nucleófilo puede ser un compuesto iónico en sí mismo, y un disolvente más polar lo ayudará a disolverse. Sin embargo, los disolventes especialmente polares pueden proporcionar estabilidad adicional a los iones.
Los disolventes más polares tienden a ser aquellos que son capaces de formar enlaces de hidrógeno, como el agua y los alcoholes. A estos a veces se les llama “solventes polares, próticos”. La parte “prótica” se refiere a los enlaces de hidrógeno; en los enlaces de hidrógeno, el átomo de hidrógeno unido a un oxígeno o nitrógeno muy electronegativo desarrolla una carga positiva significativa, como un protón.
Los solventes polares próticos pueden estabilizar iones a través de atracciones intermoleculares muy fuertes. El hidrógeno prótico puede interactuar fuertemente con los aniones, mientras que el par solitario en el átomo de oxígeno puede estabilizar cationes.
Estas interacciones estabilizantes pueden estabilizar fuertemente los intermedios en reacciones de S N 1. De la misma manera, el estado de transición que conduce al intermedio también se estabiliza significativamente. La barrera para esta reacción se baja y la reacción puede ocurrir más rápidamente.
Además, los solventes polares próticos pueden desempeñar un papel adicional en la estabilización del nucleófilo. Si el nucleófilo se estabiliza, es menos probable que reaccione hasta que esté disponible un electrófilo suficientemente fuerte. Como resultado, los solventes polares próticos también pueden disminuir la velocidad de reacciones de S N 2. Una vez que el haluro de alquilo se ioniza y se vuelve disponible un electrófilo más atractivo, el nucleófilo puede entrar en acción.
Los siguientes son una docena de solventes potenciales de panadero.
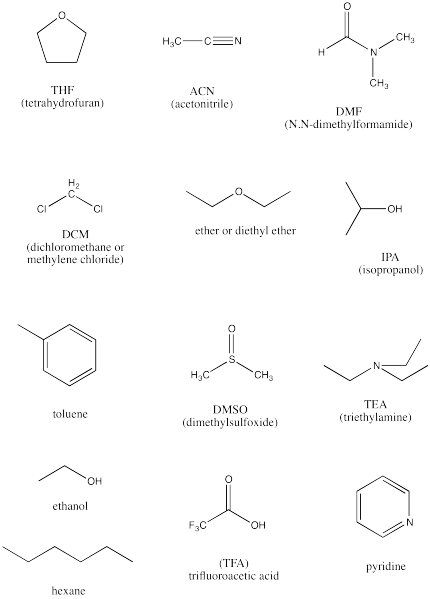
- Identificar los solventes próticos en este grupo.
- Identificar los solventes completamente no polares en este grupo.
- Identificar los solventes polares apróticos.
- Clasificar los disolventes polares de los más polares a los menos polares.
- Identificar dos compuestos básicos, frecuentemente utilizados para facilitar las transferencias de protones en las reacciones.
- Contestar a
-
etanol, isopropanol, ácido trifluoroacético
- Respuesta b
-
hexano, tolueno
- Respuesta c
-
THF, acetonitrilo, DMF, diclorometano, éter, DMSO, trietilamina, piridina
- Respuesta d
-
DMSO > DMF > ACN > piridina > DCM > THF > éter > TEA, basado en constantes dieléctricas. En general, los que tienen múltiples enlaces entre dos átomos diferentes son los más polares.
- Respuesta e
-
piridina y trietilamina. El par solitario en el átomo de nitrógeno es básico hacia los protones. La tendencia en basicidad es trietilamina > piridina >> acetonitrilo; a medida que aumenta el carácter porcentual s en el par solitario, los electrones son menores en energía y menos disponibles para la donación.
Describir la reacción de S N 1 como lenta, media o rápida en los siguientes casos.
- NaCN y PhCH 2 Cl en acetonitrilo, CH 3 CN.
- NaSH y 2-bromo-2-metilheptano en metanol.
- KI y 1-cloropentano en 2-propanol.
Describir la reacción de S N 2 como lenta, media o rápida en los siguientes casos.
- LiCCch 3 y 2-bromopentano en THF.
- NaN3 y 3-cloro-3-metiloctano en DMF.
- LiOPh y 1-bromohexano en metanol.

