4.9: Nucleófilos enolados
- Page ID
- 78804
Los enolatos y nucleófilos relacionados merecen una mirada más cercana porque son muy comunes y porque tienen sus propios problemas de regioquímica.
Recuerda, un enolato es solo la base conjugada de un enol. Un enolato también se puede considerar como la base conjugada de un carbonilo relacionado. Debido a que el enolato es un anión deslocalizado, puede protonarse en dos lugares diferentes para obtener dos conjugados diferentes.
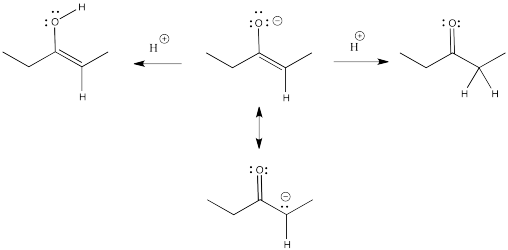
Los enoles normalmente no se ven debido a un rápido equilibrio con ese compuesto carbonilo relacionado. Tan pronto como se forme un enol, si hay alguna forma de que transfiera un protón para llegar al carbonilo, lo hará. Este tipo de equilibrio se llama “tautomerismo”, que implica la transferencia de un protón de un lugar a otro dentro de la molécula. El enol y su carbonilo relacionado se denominan “tautomeros”. “Tautomeros” describe la relación entre estas dos moléculas.

Las enaminas son muy similares a los enolatos, pero con un átomo de nitrógeno en lugar del oxígeno. De ahí que sean aminas en lugar de alcoholes.

Enamina, enolatos y enoles son todos nucleófilos turbocargados. El átomo nucleofílico es el carbono alfa. Si bien ese carbono puede pensarse como un carbono de doble enlace, sin par solitario, esa posición está motivada para donar electrones debido a la donación de pi del oxígeno (o nitrógeno).
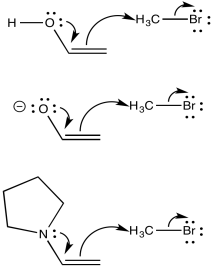
Uno de los problemas con estos nucleófilos tiene que ver con la asimetría sobre el carbonilo (o el aspirante a carbonilo). Si una posición alfa junto al carbonilo no es la misma que la otra, dos posibles enolatos podrían resultar de la eliminación de un protón.
Eso significa que potencialmente tenemos dos nucleófilos diferentes del mismo compuesto de partida. En ocasiones, mezclas de productos resultan de reacciones enoladas.
Sin embargo, los enolatos y enaminas son ampliamente utilizados en la síntesis de cosas importantes como los farmacéuticos, precisamente porque pueden controlarse muy bien. Si quieres el enolato en un lado del carbonilo —lo llamaremos el lado más sustituido— entonces puedes tenerlo. Si quieres el enolato del otro lado del carbonilo —el lado menos sustituido— puedes tenerlo, en cambio.
Para obtener el protón apagado y convertir un compuesto carbonilo en un enolato se requiere una base. Algún control sobre qué protón se elimina podría provenir de la elección de la base. Pensemos en lo que es diferente de esos dos lados del carbonilo. Un lado está más sustituido. Tiene más cosas en él. Está más concurrido. A lo mejor para sacar el protón de la posición más concurrida, necesitas una base más pequeña.
Por el contrario, para obtener el protón exclusivamente de la posición menos concurrida, y tener muy pocas posibilidades de obtenerlo del lugar más concurrido, podrías usar una base realmente grande.

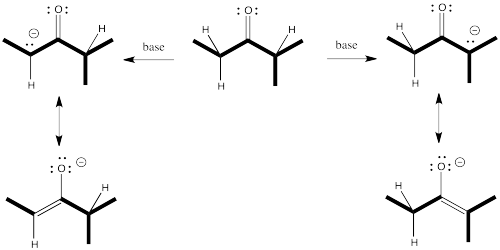
Así que vamos a recorrer todo el camino a través de una reacción, mirando dos posibles productos de sustitución nucleofílica. Supongamos que tomamos 2-metilpentan-3-ona, la desprotonamos para hacer un anión enolato y agregamos cloroetano para completar la reacción. La reacción global se llama α-alquilación, debido a que el electrófilo de alquilo que se agrega va a la posición alfa, junto al carbonilo.
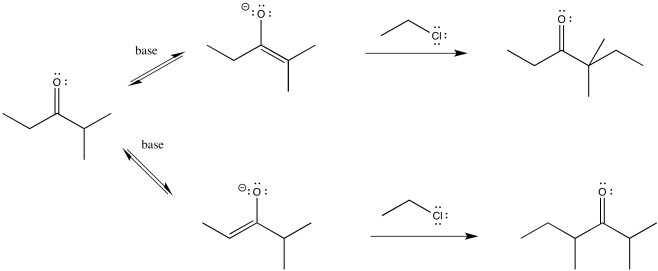
Se pueden ver los dos productos diferentes de las reacciones: uno de ellos es 4,4-dimetilhexan-3-ona. El otro es 2,4-dimetilhexan-3-ona. Por lo que hemos dicho hasta ahora, si usamos una base grande, tal vez no encaje tan bien en el lado más obstaculizado (el camino superior arriba), por lo que irá al lado menos obstaculizado (el camino inferior).
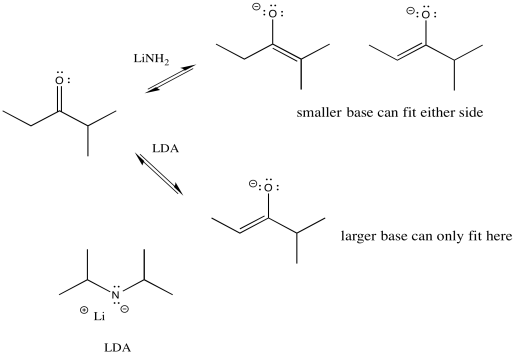
Podemos hacer que la base sea más voluminosa añadiendo sustituyentes alquilo. Si solo tiene pocos hidrógenos adheridos al átomo básico, no va a estar muy abarrotado. También, en este caso utilizamos bases amida porque son bases muy fuertes. (Amida es el término químico inorgánico para la base conjugada del amoníaco, o NH 2 -.) Existe un equilibrio entre una cetona y un enolato. Una base más fuerte empuja el equilibrio hasta el lado del enolato, sin restos de cetona.
- Las bases voluminosas pueden promover la desprotonación en el lado menos sustituido (el lado menos abarrotado) del carbonilo.
Entonces, si necesitamos tomar el camino inferior, hemos encontrado la manera de hacerlo. LDA (diisopropilamida de litio) tomará el protón menos impedido y la alquilación ocurrirá en ese lado. El problema es que la amida de litio mucho más pequeña puede caber en cada lado. No tiene preferencia, por lo que lleva a una mezcla de productos.
¿Cómo podemos forzar las cosas a través del camino superior?
Hay algo más sobre los enolatos que es evidente solo cuando miras los iones en una forma de resonancia. Los iones enolatos se pueden considerar como alquenos, por supuesto. Dependiendo de qué protón eliminemos, obtenemos dos alquenos diferentes. Puede haber factores que hagan que uno de estos dos alquenos sea más estable. Si es así, puede haber formas de formar esa una en lugar de la otra.
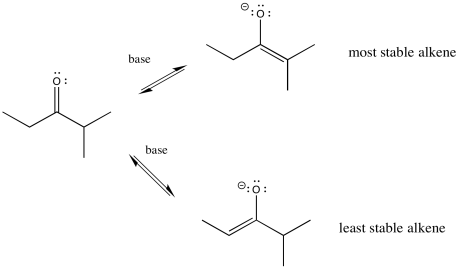
En general, los alquenos más sustituidos son más estables que los menos sustituidos. El alqueno más sustituido se forma a través de la pérdida del protón en la posición más concurrida. La estabilidad enolada debería influir en las cosas, y lo hace, pero hay algunas sutilezas involucradas. Para entender las sutilezas, vamos a necesitar mirar el diagrama de energía potencial para la formación enolada.
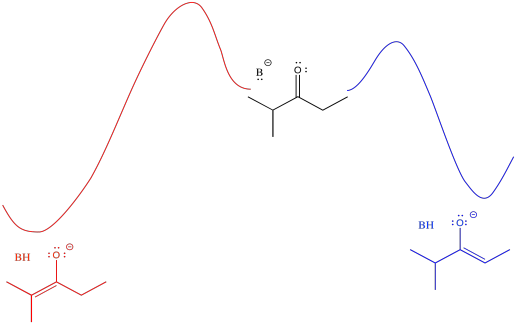
La barrera podría ser un poco más alta yendo de la mitad del cuadro a la izquierda que ir de media a derecha (está más abarrotada, después de todo). Sin embargo, una vez que la reacción supera esa barrera, se asienta en un lugar más estable (el enolado es más estable). Una inversión inicialmente mayor, en este caso, arroja un mayor rendimiento al final.
- El producto termodinámico se refiere al que es más estable. En este caso, también pasa a ser más difícil de llegar, debido a que es de una barrera más alta.
- El producto cinético se refiere al que se forma más fácilmente, debido a una barrera inferior. en este caso, también pasa a ser menos estable.
Una vista alternativa de esa superficie coloca el reactivo a la izquierda y ambos productos a la derecha. Las dos vías posibles se superponen entonces entre sí. La conclusión que sacamos es la misma: la barrera es mayor a lo largo del camino rojo que el camino azul debido al obstáculo estérico. Eventualmente, el camino rojo conduce al producto de menor energía.
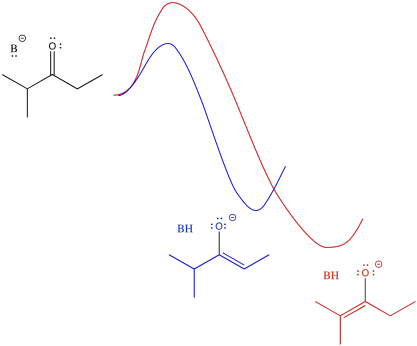
Con solo mirar el diagrama, podemos inferir que se necesita más energía para superar la barrera que conduce al enolado más estable. Si suministramos más energía para empezar, podríamos tener más posibilidades de alcanzar el enolado más estable. Por supuesto, la forma más fácil de hacerlo es calentando la reacción. Si no queremos formar el enolado más estable, podríamos enfriar la reacción. De esa manera, no habría suficiente energía para llegar al enolado más estable.
- Las temperaturas más cálidas pueden conducir a la formación del producto termodinámico.
- Las temperaturas más frías fomentarán la formación del producto cinético.
Formar un producto basado en su estabilidad relativa significa apoyarse en la termodinámica. Llegar al producto termodinámico significa que tienes que darle al sistema la oportunidad de encontrar su camino allí. Una forma de hacerlo es permitir que la desprotonación ocurra de manera reversible. Dadas múltiples posibilidades, el enolado más estable se formará eventualmente.
- El tiempo es un factor clave en la formación del producto termodinámico. Cuanto más largo sea el tiempo de reacción, más probable es que el sistema llegue finalmente a la posición más estable.
Una manera obvia de permitir la reversibilidad es llevar a cabo la reacción en un disolvente prótico, como el etanol. Si el enolato toma un protón del etanol, vuelve a convertirse en cetona. Tiene una segunda oportunidad para volver a desprotonarse. Eventualmente, debería formar el enolado más estable.

- Los solventes próticos permiten la reversibilidad en la formación de enolatos. Llevar a cabo la formación de enolato en un disolvente prótico debería permitir la formación eventual del enolato más estable.
Por otro lado, si pretendes quitar el protón de la posición menos sustituida, no quieres ninguna reversibilidad. Ante la oportunidad, eventualmente se formará el enolado equivocado. Solo quieres tomar lo que obtienes la primera vez, que es más probable que sea el camino azul debido a su barrera inferior. Anteriormente, utilizamos una base amida voluminosa para formar el enolato menos estable porque no queríamos permitir la posibilidad de segundas oportunidades.

Este es un caso en el que necesitamos un control cinético para obtener un producto: queremos el enolato menos sustituido, y dependemos de que se forme más rápidamente que el enolato ther. Después de todo, si el otro enolado se forma, es más estable; no es probable que vuelva.
- La resistencia de la base puede ser importante en la formación de un enolado termodinámico. Una base fuerte, como hidróxido o alcóxido, forma un ácido conjugado prótico que fácilmente podría reprotonar el enolato.
- Una base muy fuerte, como la amida, forma un ácido conjugado prótico que es mucho menos probable que reprotone el enolato.
Hay algunos factores aún más sutiles que se utilizan para ayudar a las cosas un poco más. Por ejemplo, los contraiones para las bases pueden tener un efecto modesto de una manera u otra. El efecto tiene que ver con el grado de covalencia entre el contraión y el enolato. Por ejemplo, el litio es un ion alcalino más pequeño y más duro que forma enlaces fuertes con el oxígeno. El potasio es un ion alcalino más grande y más blando que forma enlaces más débiles con el oxígeno. Solo estamos usando estos términos de manera relativa; los iones de litio y potasio son duros, pero el ion litio es aún más duro que el ion potasio.
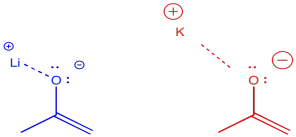
Si el enolato está unido a su contraión, es menos probable que sufra inversión a la cetona. A veces se utilizan contraiones de litio para promover la formación del enolato cinético. A veces se utilizan contraiones de potasio para promover la formación del enolato termodinámico.
- Los contraiones más pequeños como el litio promueven la formación del enolato cinético; los contraiones más grandes promueven la formación de enolatos termodinámicos.
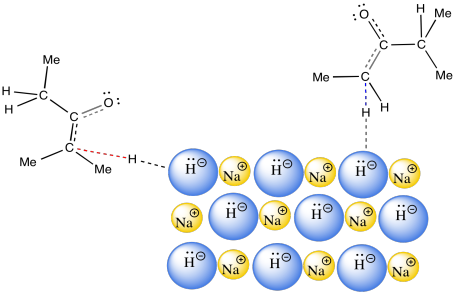
Hay un factor final del que hablar, que surge en el caso del hidruro de sodio. El uso de hidruro de sodio generalmente conduce al enolato termodinámico. Eso puede ser una sorpresa. Después de todo, el hidruro de sodio es una base muy fuerte. No esperaríamos que el contraión, H 2, fuera ácido. Eso significa que el uso de hidruro de sodio solo permite una oportunidad para llegar al producto termodinámico. Entonces, ¿cómo logra NaH hacer eso?
La respuesta parece estar relacionada con la fase. El NaH es un sólido insoluble. Como resultado, la reacción entre NaH en la fase sólida y la cetona en la fase de solución ocurre solo en la superficie del NaH. Esta reacción es muy lenta. Sucede a lo largo de un largo periodo de tiempo. Recuerde, el tiempo fue uno de los factores que favorecieron la formación del producto termodinámico.
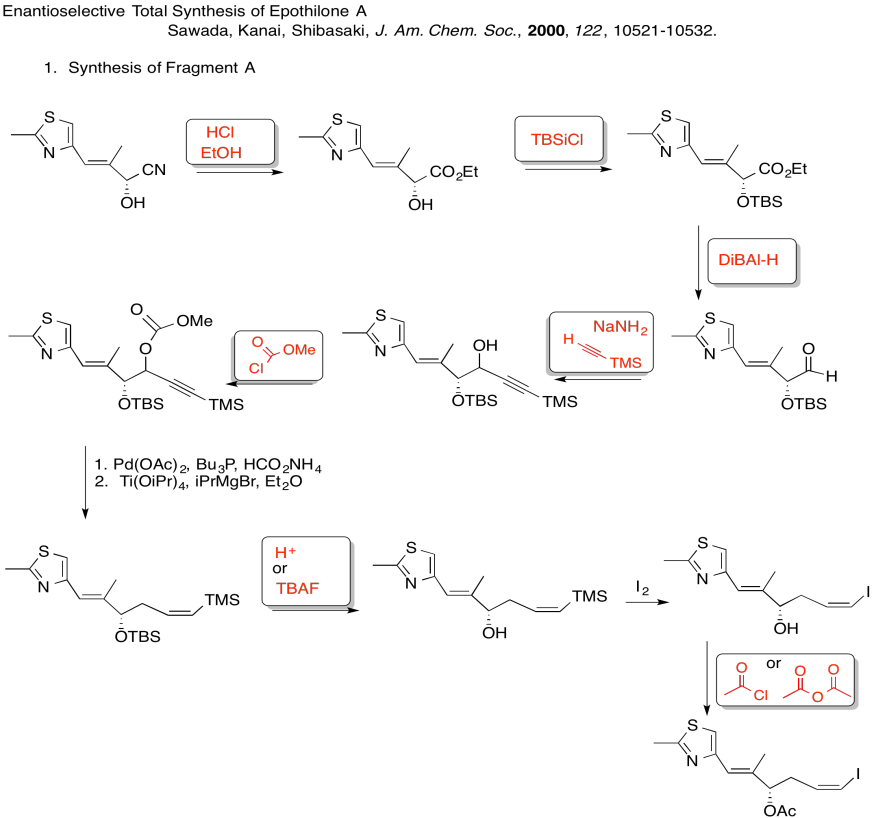
Rellene los espacios en blanco en la siguiente síntesis. Incluye: sustitución nucleofílica alifática, silil éteres, sustitución carboxílica, adición de carbonilo (nucleófilos aniónicos, nucleófilos neutros, enolatos)
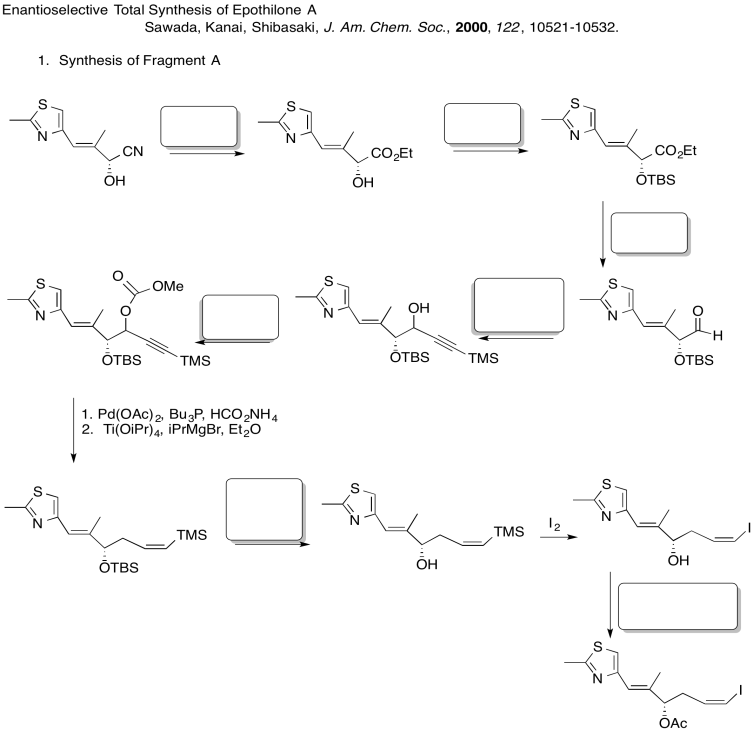
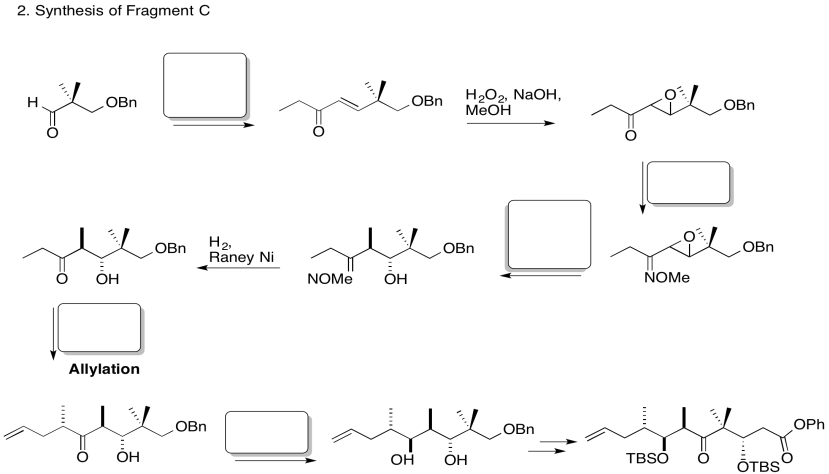
3. Estereocontrol de la etapa de alilación:
¿La base se utiliza una base cinética o termodinámica? ¿Por qué?
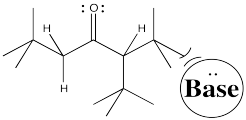
Explicar el estereocontrol de la etapa de alilación en la preparación del Fragmento C (mostrado aquí). Asegúrate de incluir fotos.
- Contestar
-
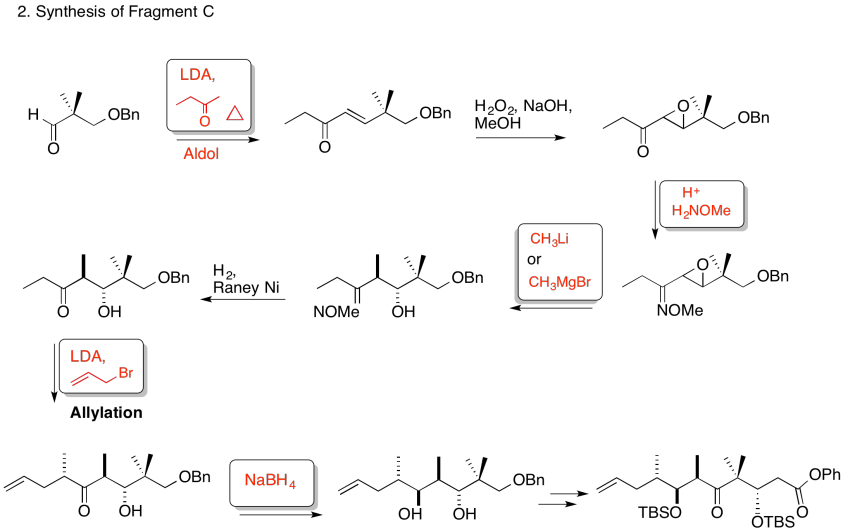
3. Cinético — para desprotonar completamente (no equilibrar o perder estereocontrol) y para el control de quelación.
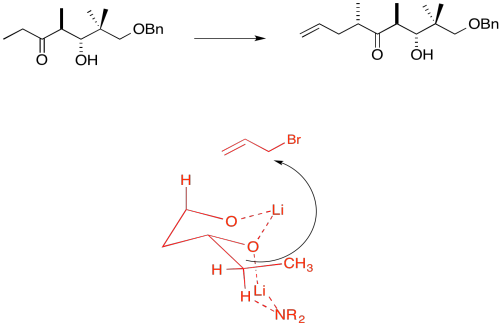
Debido a los efectos de quelación mostrados anteriormente, el LDA elimina preferentemente un hidrógeno para formar solo el Z-enolato que luego hará el SN2 al bromuro de alilo en una sola cara.


