4.10: Formación de Grupo Saliente
- Page ID
- 78877
Las sustituciones nucleofílicas alifáticas pueden ser reacciones útiles. Un inconveniente menor es la baja ocurrencia natural de haluros de alquilo. Los alcoholes son mucho más comunes.
Podríamos hacer sustituciones nucleofílicas en alcoholes. El problema es que los oxígenos son menos polarizables que los haluros. Un ion hidróxido es menos estable y más difícil de formar que un ion haluro. No hacen muy buenos grupos de salida, comparativamente.
Una forma de evitar ese problema sería protonar el oxígeno. Atado al carbono, es un catión. Una vez que se va, se vuelve neutral. Se elude el tema de la estabilidad iónica. El problema es que sumergir un compuesto en ácido concentrado no siempre es una forma confiable de hacer las cosas.
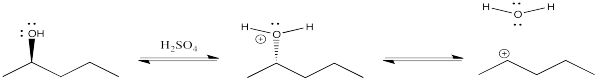
Por esa razón, es bastante útil poder convertir los alcoholes en haluros de alquilo, o de otra manera convertir los hidroxilos en grupos de salida aniónicos estables.
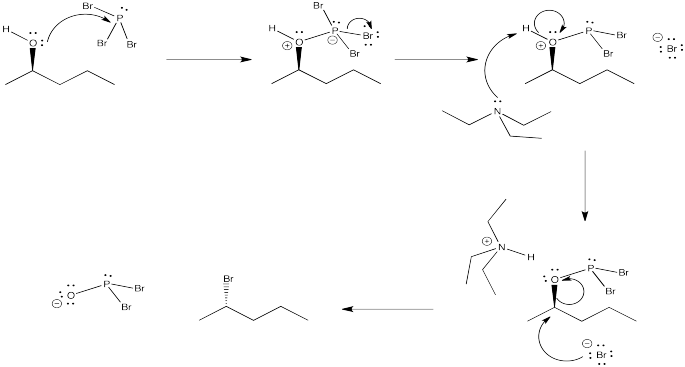
Uno de los métodos sintéticos más comunes para convertir alcoholes en buenos candidatos para la sustitución nucleofílica es convertir el hidroxilo en un haluro mediante el uso de un reactivo de fósforo. El tribromuro de fósforo se usa frecuentemente para elaborar bromuros de alquilo a partir de alcoholes.
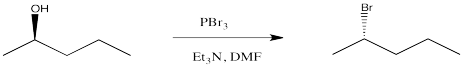
Esta reacción en sí implica una secuencia de reacciones de sustitución nucleofílica. En el primero, el átomo de oxígeno en un grupo hidroxilo actúa como nucleófilo y reemplaza a un bromuro sobre fósforo. En el segundo, el ion bromuro desplazado rebota para desplazar el átomo de oxígeno del carbono tetraédrico. Este mecanismo es ayudado por la fuerza del fuerte enlace fósforo-oxígeno que se forma. El fosfito que se forma es un grupo saliente muy bueno.
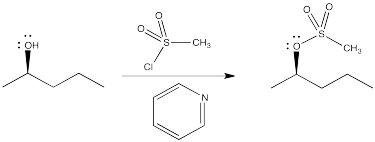
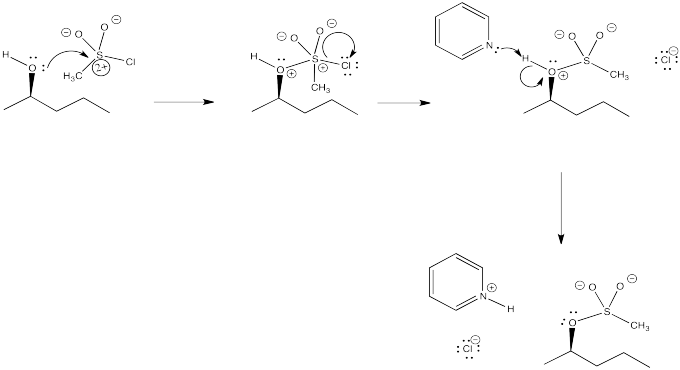
Otro método común es convertir el hidroxilo en un éster de sulfonato, tal como un mesilato o tosilato. Nuevamente, el átomo de oxígeno actúa como nucleófilo, desplazando un haluro del azufre en un cloruro de sulfonilo. Esto es muy similar a la bromación con tribromuro de fósforo, pero el éster de sulfonato espera, a punto de ser desplazado por un nucleófilo. De hecho, los tosilatos son generalmente incluso mejores grupos salientes que los haluros.
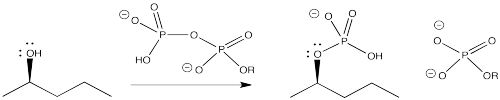
Biológicamente, a veces sucede algo muy similar a ambos procesos. La unidad de alcohol se convierte en un fosfato. El alcohol puede ser fosforilado por una molécula de ATP. Nuevamente, la porción fosfato de la molécula es un grupo saliente muy bueno.
Proporcionar un mecanismo para la reacción del tribromuro de fósforo con 2-pentanol, basado en la descripción proporcionada.
- Contestar
-
Proporcionar un mecanismo para la reacción del cloruro de mesil con 2-pentanol, basado en la descripción proporcionada.
- Contestar
-
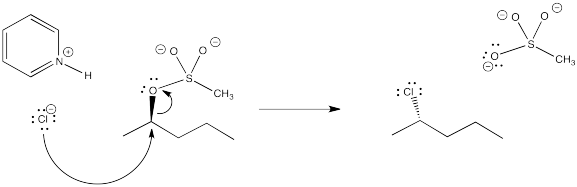
En ocasiones, en la formación de ésteres de sulfonato, la halogenación ocurre por accidente, formando un cloruro de alquilo. Mostrar cómo eso podría suceder al continuar con el mecanismo de formación de un éster de mesilato a partir de cloruro de mesil y 2-pentanol.
- Contestar
-
Una forma de prevenir reacciones secundarias durante la síntesis de ésteres de sulfonato, como la de la pregunta anterior, es realizar una reacción bifásica. Por ejemplo, la reacción podría realizarse en una mezcla de agua y diclorometano, con un poco de hidróxido de sodio añadido para actuar como base. Mostrar cómo este enfoque limitaría la reacción de cloración.
- Contestar
-

Proporcionar reactivos (o series de reactivos) para lograr las siguientes transformaciones.
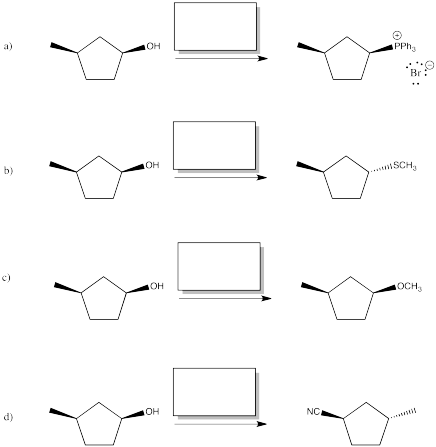
Contestar-
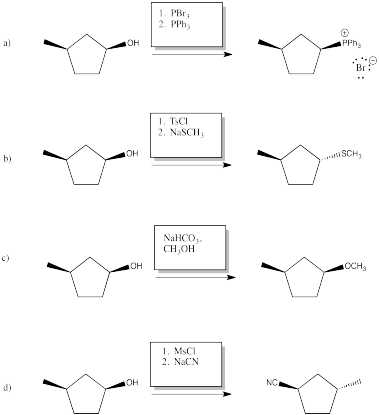
La adición de Mitsunobu es un método de un solo paso para reemplazar un grupo OH de alcohol con un nucleófilo. En el siguiente caso, el átomo de oxígeno original ha sido completamente reemplazado. Es posible que puedas adivinar a dónde va en base a otras reacciones que hayas visto aquí.
Proponer un mecanismo para esta reacción, pero no te preocupes por lo que hace DEAD (ese es un tema más avanzado).

- Contestar
-
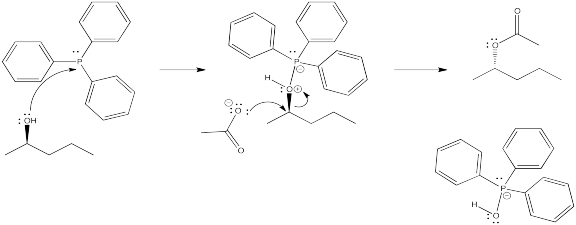 DEAD actúa como agente oxidante para convertir el producto de fósforo en un producto secundario estable, óxido de trifenilfosfina, Ph 3 P=O.
DEAD actúa como agente oxidante para convertir el producto de fósforo en un producto secundario estable, óxido de trifenilfosfina, Ph 3 P=O.

