4.12: Eliminación
- Page ID
- 78803
Algunas veces, ocurren reacciones de eliminación en lugar de sustituciones nucleofílicas alifáticas. En una reacción de eliminación, en lugar de conectarse al carbono electrófilo, el nucleófilo toma un protón del siguiente carbono lejos de él. El haluro u otro grupo de salida sigue siendo desplazado. Se forma un doble enlace entre los dos carbonos.

Así, en realidad hay más de dos mecanismos competidores ocurriendo a la vez aquí. Además de la sustitución unimolecular y bimolecular, también es posible una reacción que implique la desprotonación.
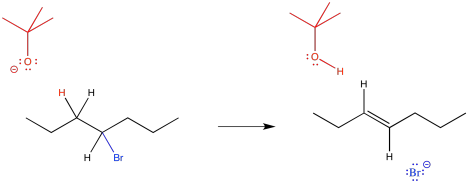
En lugar de actuar como nucleófilo, el anión terc-butóxido actúa como base. Forma un enlace a un protón, convirtiéndose en terc-butanol. Este protón siempre debe provenir del carbono al lado del grupo de salida. El bromuro aún sale, y los dos carbonos adyacentes forman un segundo enlace entre sí.
Dibujar un mecanismo para la reacción de eliminación anterior. Supongamos que la reacción es bimolecular y concertada, de manera que el enlace C-H y el enlace C-Br se rompen al mismo tiempo, formando el enlace C=C.
- Contestar
-
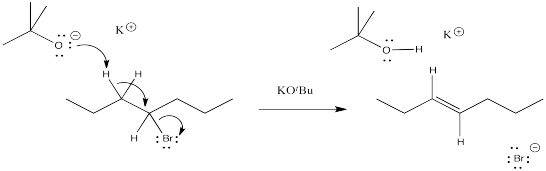
El mecanismo de una reacción de eliminación es casi exactamente el mismo que una sustitución nucleofílica alifática, excepto que el nucelófilo pierde su marca. Golpea un protón en lugar de un carbono y actúa como una base en lugar de un nucleófilo. Este proceso puede ocurrir al mismo tiempo que la salida del grupo que sale o puede ocurrir después. Estos mecanismos se denominan E1 y E2.
Dibujar otro mecanismo para la reacción de eliminación anterior, pero esta vez, supongamos que la reacción es unimolecular.
- Contestar
-

Dado el mecanismo en Ejercicio\(\PageIndex{2}\), también se esperarían otros productos.
- ¿Qué son? (Piensa en el intermedio reactivo y qué más le podría pasar).
- ¿Qué sugiere su ausencia en el esquema de reacción original anterior sobre el mecanismo más probable de la reacción?
- Contestar a
-
productos de reordenamiento de cationes mediante desplazamientos de hidruro: 2-hepteno en lugar de 3-hepteno.
- Respuesta b
-
La ausencia de reordenamiento sugiere la ausencia de cationes. El mecanismo para la reacción mostrada debe ser concertado en lugar de a través del intermedio iónico.
¿Por qué una reacción podría sufrir eliminación en lugar de sustitución? La razón más importante se refiere a la naturaleza del nucleófilo. Cuanto más básico sea el nucleófilo, más probable es que induzca la eliminación.
- Los nucleófilos básicos conducen a la eliminación.
¿Qué hace que algo sea básico, más que nucleofílico? Como regla general muy ruda, podemos comenzar pensando en las bases como versiones menos estables de nucleófilos. Los nucleófilos son muy a menudo aniones, y las bases son generalmente aniones menos estables. Entonces, ¿qué factores hacen que los aniones sean más estables? Esos factores harían que el anión se pareciera más a un nucleófilo y menos a una base.
Uno de los factores más importantes aquí es la polarizabilidad. Recuerde, los átomos polarizables son átomos grandes. En el grupo principal de la tabla periódica, incluyen azufre, fósforo, cloruro, bromuro, yoduro, etc. Estos aniones son estables debido a que la carga negativa se extiende sobre un átomo mayor. Cada vez que se extiende la carga, tiende a resultar en una mayor estabilidad. Por otro lado, los átomos más pequeños y menos polarizables incluyen oxígeno, nitrógeno y carbono. Los aniones de carbono, nitrógeno y oxígeno tienden a ser más básicos. Los aniones de bromo, yodo y azufre no son básicos. ¿Qué, nunca? No, nunca. Bueno, casi nunca.
- Los átomos grandes y polarizables como Br, I o S hacen aniones estables.
- Estos aniones estables tienen más probabilidades de ser nucleófilos que bases.
Tal vez recuerdes este factor de una discusión sobre la estabilidad aniónica en la química ácido-base. Otras consideraciones de acidez también serán útiles.
Un segundo factor importante que ayudó a estabilizar aniones fue la resonancia. Si una carga negativa puede ser deslocalizada vía resonancia, el anión se vuelve mucho más estable. Por ejemplo, un ion alcóxido, tal como metóxido, podría ser muy básico, porque la carga negativa está en un átomo de oxígeno. El oxígeno no es un átomo grande, polarizable. Sin embargo, un carbonilo adyacente en un anión acetato marca la diferencia. Este anión está estabilizado por resonancia.
- Los aniones estabilizados por resonancia son relativamente estables.
- Estos aniones estables tienen más probabilidades de ser nucleófilos que bases.
Otro factor a veces juega un papel en el caso del carbono o el nitrógeno. Es la idea de hibridación. Recuerde que la geometría de un átomo determina qué orbitales atómicos están involucrados en la unión. Los carbonos tetraédricos se consideran hibridados sp 3, lo que significa que el carbono utiliza un electrón s y tres electrones p en enlace sigma. Un carbono plano trigonal es sp 2 hibridado. Eso significa que utiliza solo dos orbitales p y un orbital s en la formación de enlaces sigma.
Diferentes hibridaciones conducen a algunas diferencias sutiles en las propiedades. Por ejemplo, los enlaces C-H de los carbonos sp 2 son un poco más fuertes que los de los carbonos sp 3 (tal vez 105 a 110 kcal/mol para los primeros y 95 a 100 kcal/mol para los segundos). Eso se debe a que los electrones en los enlaces sp 2 C-H están a una energía ligeramente menor. Eso, a su vez, se debe a que un orbital s es un poco menor en energía que un orbital p.
Por razones similares, un carbanión sp 2 es más estable que un carbanión sp 3. Los electrones en el carbono sp 2 son menores en energía que los electrones en el carbono sp 3. Un carbanión sp es más estable, aún. Como resultado, aunque un anión etílico (CH 3 CH 2 -) es extremadamente básico y un anión vinílico (H 2 C=CH -) sigue siendo altamente básico, un anión acetilido o alquinilo (HC = C -), aunque básico, es mucho más nucleófilo que los otros dos.
- Un anión de carbono hibridado sp es mucho más estable que un anión de carbono sp 2 o sp 3.
- Estos aniones relativamente estables (recuerden, todavía estamos hablando de un anión sobre el carbono), aunque bastante básicos, suelen ser nucleófilos.
Si se aplica alguno de estos tres factores (polarizabilidad, resonancia, hibridación sp en carbono), es más probable que el anión sea un nucleófilo que una base.
Hay un cuarto factor que es casi un no-sequitur. No hace falta decir que un compuesto neutro —en el sentido de que el compuesto que no tiene carga alguna— no requiere en absoluto de estabilización de carga. Por lo tanto, si un nucleófilo no tiene carga, es relativamente estable, y a menudo actuará como nucleófilo en lugar de como base.
- Los compuestos neutros (sin carga) son estables; no requieren estabilización de carga.
- Los compuestos neutros suelen ser nucelófilos en lugar de bases.
Un quinto factor —la electronegatividad relativa dentro de una fila— juega un papel menor aquí. Recuerde, dentro de una fila de la tabla periódica, los cambios de tamaño son menores. Todos los átomos son pequeños. Las diferencias en la polarizabilidad no son mucho factor. En cambio, las diferencias en la electronegatividad influyen en la estabilidad aniónica. Cuanto más electronegativo es el átomo, más estable es el anión. Como resultado, un anión de oxígeno es más estable que un anión de nitrógeno o anión de carbono. Como resultado, a veces hacemos una distinción aquí, refiriéndose al ion hidróxido y a los iones alcóxido como bases fuertes, pero a los aniones amida y a los aniones alquilo como bases muy fuertes.
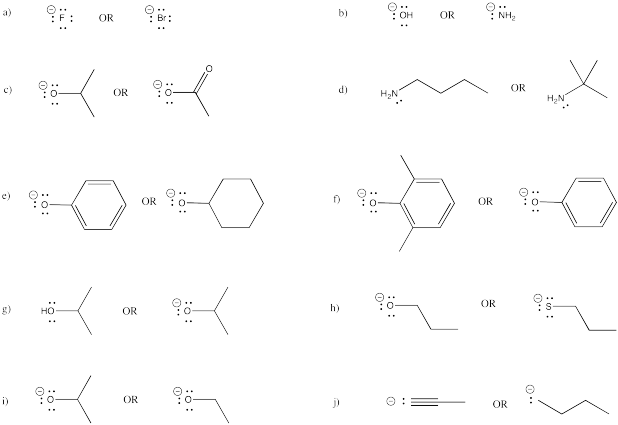
Clasifica los siguientes aniones como base muy fuerte, base fuerte o base débil.
a) NaNH 2 b) NaOH c) CH 3 CO 2 Na d) NaH e) CH 3 OH
f) NaBr g) CH 3 COCH 2 Li h) CH 3 CH 2 CH 2 CH 2 Li i) KI j) H 2 O
k) CH 3 CCNa l) (CH 3 CH 2) 3 N m) Na 2 CO 3 n) LiCl o) CH 3 OK
p) CH 3 C 6 H 4 ONa q) NaSH r) [(CH 3) 2 CH] 2 NLi s) (CH 3) 3 P t) (CH 3) 3 COK
- Contestar a
-
muy fuerte
- Respuesta b
-
fuerte
- Respuesta c
-
débil (resonancia)
- Respuesta d
-
muy fuerte
- Respuesta e
-
débil (neutro)
- Respuesta f
-
débil (polarizable)
- Respuesta g
-
débil (resonancia)
- Respuesta h
-
muy fuerte
- Contestar i
-
débil (polarizable)
- Responder j
-
débil (neutro)
- Responder k
-
medio-débil (anión C pero sp)
- Contesta l
-
débil (neutro)
- Contestar m
-
débil (resonancia)
- Responder n
-
débil (polarizable)
- Responder o
-
fuerte
- Responder p
-
débil (anión O pero deslocalizado)
- Contestar q
-
débil (polarizable)
- Responder r
-
muy fuerte
- Respuesta s
-
débil (polarizable)
- Responder t
-
fuerte
Las bases muy fuertes incluyen aniones y semianiones de carbono y nitrógeno. Los ejemplos incluyen butillitio y amida sódica. Es muy probable que bases muy fuertes se involucren en la eliminación, más que en la sustitución.
Las bases fuertes incluyen aniones de oxígeno no estabilizados. Los ejemplos incluyen hidróxido de sodio así como alcóxidos tales como terc-butóxido de potasio o etóxido de sodio. Bases fuertes favorecen también la eliminación. Sin embargo, a veces pueden sufrir ya sea eliminación o sustitución, dependiendo de otros factores (ver más abajo).
Las bases débiles incluyen cianuro, aniones de oxígeno estabilizado como carboxilatos y arilóxidos, aniones de azufre, ion fluoruro y aminas neutras. Las bases débiles tienen muchas más probabilidades de sufrir sustitución que eliminación.

Las bases muy débiles incluyen haluros pesados como cloruro, bromuro o yoduro, así como nucleófilos neutros de fósforo o azufre. Las bases muy débiles sufren eliminación solo en raras ocasiones.
Por lo general, las bases fuertes y las bases muy fuertes tienen más probabilidades de reaccionar a través del mecanismo E2; reaccionan tan rápido que la etapa de desprotonación desencadena la ionización de c-Lgp, en lugar de al revés. Sin embargo, los mecanismos E1 también ocurren con estas bases, especialmente a bajas concentraciones. Explique por qué.
¿Por qué es que un anión como el cianuro es una base débil, mientras que CH 3 Li es una base fuerte?
Otro factor son los esterinos. Cuanto más abarrotado esté el electrófilo, más probable es que el nucleófilo encuentre un protón en su camino hacia el carbono electrófilo.
A medida que un nucleófilo se acerca al bromuro de terc- butilo, proveniente del lado opuesto al bromo para someterse a sustitución nucleofílica, es muy probable que colisione con un protón en su camino hacia el carbono electrófilo. Lo mismo tiene una buena probabilidad de que ocurra con el bromuro de isopropilo. Sin embargo, es mucho menos probable que ocurra con bromoetano. Por último, el bromometano ni siquiera tiene un beta-hidrógeno, por lo que la posibilidad de eliminación en ese caso es cero.
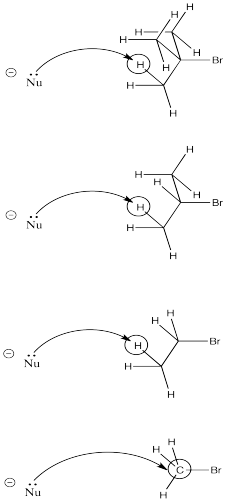
- El hacinamiento lleva a la eliminación.
Tenga en cuenta que el hacinamiento podría involucrar ya sea la estructura de la base o la estructura del electrófilo. Una base grande y voluminosa puede tener más probabilidades de desprotonar que encontrar su camino en el átomo de carbono electrófilo.
- Los nucleófilos más voluminosos pueden actuar como bases.
Dados los siguientes pares de nucleófilos, ¿cuál es más probable que se someta a eliminación?
Aunque los acetiluros (como el acetiluro de sodio, el CCH de Na) son en realidad más básicos que los alcóxidos (como el isopropóxido de sodio, Na OCH (CH 3) 2), los acetiluros suelen sufrir sustitución en lugar de eliminación. Proponer una razón para esta diferencia.
Un tercer factor es la temperatura. Una reacción de eliminación implica la escisión de dos enlaces, mientras que una reacción de sustitución requiere solo un enlace para romperse. Así, una reacción de eliminación es más intensiva en energía, y es más probable que ocurra a temperaturas más altas, cuando hay más energía disponible.
- Las temperaturas más altas conducen a la eliminación.
Un factor adicional en la dependencia energética de las eliminaciones y sustituciones es la entropía.
- Usa reglas simples a punto de determinar qué productos son favorecidos por la entropía: ¿Eliminación o sustitución?
- Dada la relación ΔG = ΔH - T ΔS, ¿qué factor termodinámico domina el cambio de energía libre a alta temperatura?
- Por lo tanto, ¿qué producto es favorecido a alta temperatura?

