4.14: Estereoquímica en la eliminación
- Page ID
- 78839
En ocasiones, las reacciones de eliminación pueden conducir a múltiples estereoisómeros; es decir, podrían conducir al isómero cis o trans, o en estructuras más complicadas, ya sea el isómero Z o el E.
Por supuesto, si hubiera alguna diferencia de estabilidad inherente entre estos isómeros, ese podría ser un factor que juega un papel en influir en el resultado. Las reacciones de eliminación generalmente no son reversibles, por lo que los productos no están directamente determinados por las estabilidades del isómero alqu Sin embargo, a veces la barrera que conduce a un producto más estable es un poco menor que la barrera que conduce a un producto menos estable.
Sabemos que en casos simples cis vs. trans, el isómero trans es generalmente menor en energía debido a menos interacciones estéricas entre los sustituyentes en el doble enlace. A falta de otra información, podríamos tomar eso como punto de partida. Veamos si las reacciones de eliminación generalmente conducen a isómeros trans.
Resulta que a veces esto es cierto: las eliminaciones suelen llevar al producto más estable. Sin embargo, a veces no es cierto. La respuesta depende del mecanismo.
- Las eliminaciones E1 generalmente conducen a la estereoquímica más estable.
- Las eliminaciones de E2 pueden conducir o no a la estereoquímica más estable.
En cambio, en una reacción E2, la estereoquímica del doble enlace —es decir, si resulta el isómero E o Z — viene dictada por la estereoquímica del material de partida, si es diastereomérico. En otras palabras, si el carbono con el hidrógeno y el carbono con el halógeno son ambos quirales, entonces un diastereómero conducirá a un producto, y el otro diastereómero conducirá al otro producto.
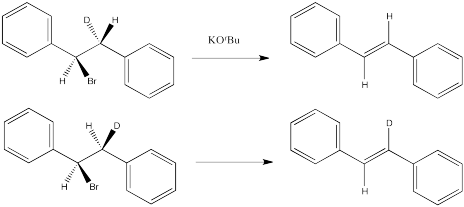
Las siguientes reacciones de etóxido de potasio con dibromoestilbeno (1,2-dibromo-1,2-difeniletano) ocurrieron a través de un mecanismo E2. Se utilizaron dos diastereómeros diferentes. Se obtuvieron dos estereoisómeros diferentes (E vs. Z).
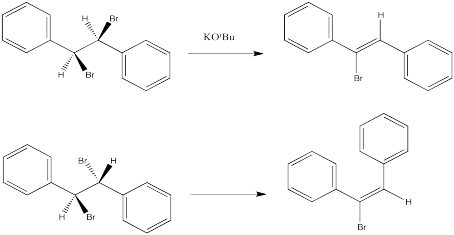
Proporcionar las configuraciones estereoquímicas de los siguientes compuestos a partir de las reacciones anteriores:
- 1,2-dibromo-1,2-difeniletano (ejemplo superior)
- 1-bromo-1,2-difenileteno (ejemplo superior)
- 1,2-dibromo-1,2-difeniletano (ejemplo inferior)
- 1-bromo-1,2-difenileteno (ejemplo inferior)
En las eliminaciones E2, la relación espacial entre el protón y el grupo lábil determina la estereoquímica del producto. Eso es porque la formación de enlaces pi ocurre al mismo tiempo que el haluro sale y al mismo tiempo que la base elimina el protón. Todos estos eventos tienen que ser coordinados juntos. El evento central y complicado es la formación de enlaces pi. El grupo de salida puede salir en cualquier dirección, y la base puede acercarse desde muchas direcciones, pero a menos que el enlace pi esté listo para formarse, no pasa nada más.
Disminuyamos la reacción e imaginemos que se lleva a cabo en etapas ligeramente diferentes.
A medida que el grupo de salida se va, lleva consigo sus electrones. Comienza a dejar atrás una carga positiva. Esa carga positiva se centrará en el carbono del que parte el haluro. Ese carbocatión, si se formara completamente, tendría sólo tres vecinos con los que vincularse. Sería plano trigonal. Tendría un orbital p desocupado y sin unión.
A medida que la base toma el protón, el hidrógeno deja atrás los electrones del enlace C-H que lo mantuvo en su lugar. Estos electrones se quedan atrás en el átomo de carbono. Se dejan en una órbita de valencia de carbono no enlazante, una orbital p o algo parecido.
Ahora tenemos un orbital p lleno junto a un orbital p vacío. Se superponen para formar un enlace pi.
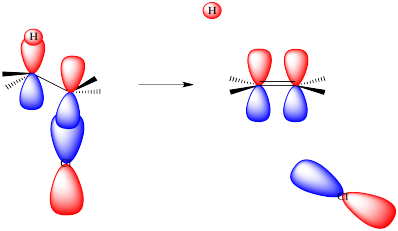
Por supuesto, en una reacción de E2, las cosas no pasan por etapas. Todo sucede a la vez. Eso significa que, a medida que la base elimina el protón, el enlace pi ya debe comenzar a formarse. Debido a que un enlace pi requiere alineación paralela de dos orbitales p, y los orbitales p se están formando a partir de los enlaces C-H y C-lgp, entonces esos enlaces deben alinearse para que se produzca la eliminación.
Entonces volvamos a ver ese ejemplo de dibromoestilbeno.
En el primer caso, necesitamos hacer girar la molécula para que podamos ver cómo el H en un carbono y el Br en el otro están alineados y listos para eliminar a través de una reacción E2. Los sustituyentes que vienen hacia nosotros en el reactivo seguirán viniendo hacia nosotros en el producto. Los sustituyentes que apuntan lejos de nosotros en el reactivo seguirán apuntando lejos de nosotros en el producto.

Entonces, las relaciones entre los sustituyentes en el doble enlace naciente están determinadas por su relación una vez que el reactivo está alineado para la reacción E2.
En el segundo caso, podemos hacer girar la molécula pero rápidamente nos damos cuenta de que los enlaces C-H y C-Br no están alineados en este conformador. Necesitamos una rotación de bonos. Una vez que hemos realizado un cambio conformacional, los enlaces C-H y C-Br se alinean. No importa si no se favorece a este conformador; si va a haber alguna reacción de E2, este es el conformador por el que tendrá que pasar.
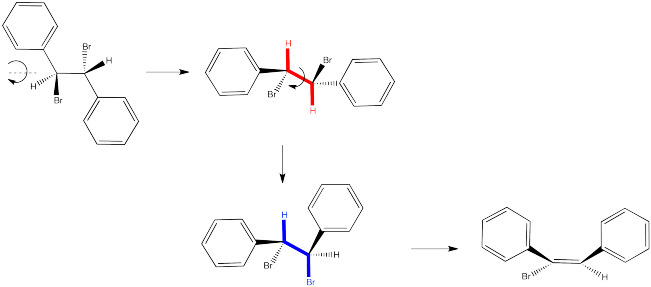
Nuevamente, las relaciones entre el nuevo doble enlace están determinadas por su relación una vez que el reactivo está alineado para la reacción E2.
A veces es más fácil ver las relaciones entre los sustituyentes mediante el uso de una proyección de Newman. Dibuje proyecciones de Newman que muestren cómo los dos isómeros anteriores proceden a diferentes productos en una reacción E2.
Predecir el producto de cada una de las siguientes reacciones E2. Nótese que los compuestos difieren en la incorporación de un isótopo 2 H (deuterio, o D) en lugar de un isótopo regular de 1 H (protio, o H).
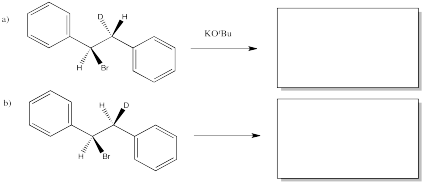
- Contestar
-
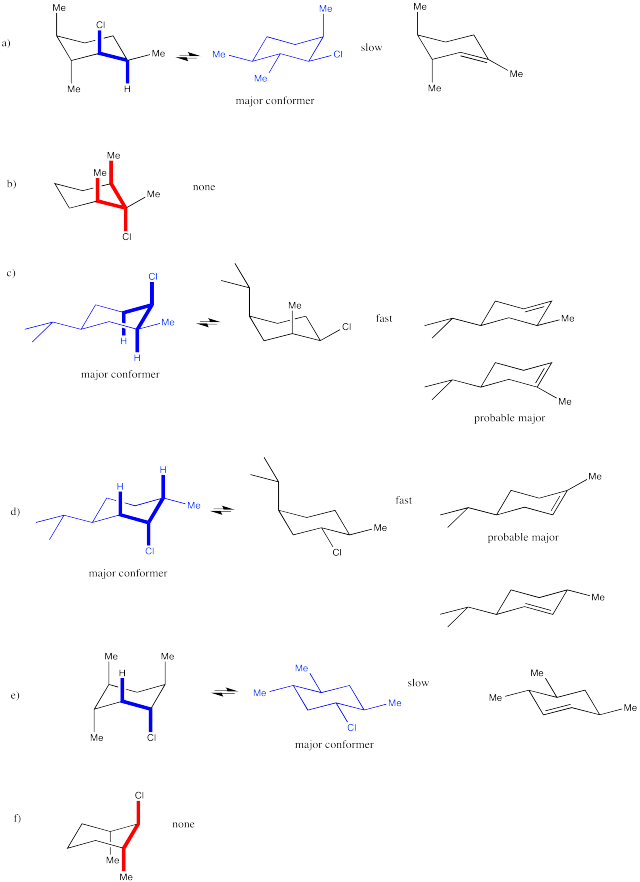
El análisis conformacional de ciclohexanos requiere el uso de proyecciones de celosía de diamante (“sillas”). En una silla, un requisito periplanar solo se cumpliría cuando dos grupos vecinos son ambos axiales. Uno sería “axial arriba” mientras que el otro sería “axial hacia abajo”. En contraste, si dos grupos vecinos son ecuatoriales, en realidad son gauches entre sí. El ángulo diedro entre ellos sería de 60 grados, por lo que no se formaría fácilmente un enlace π durante una eliminación de E2. Si un grupo fuera axial y el otro ecuatorial, los dos grupos seguirían siendo gauches el uno al otro.
- Una eliminación de E2 solo puede ocurrir si un hidrógeno y un grupo de salida vecino son anti entre sí en una silla.
- Estos dos grupos deben ser trans entre sí.
- Estos dos grupos deben estar ambos en posiciones axiales.
¿En cuál de estas dos conformaciones de silla está lista para ocurrir una reacción E2?
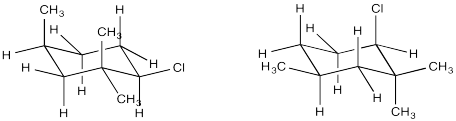
Contestar-

En los siguientes casos, la eliminación podría proceder muy rápido, muy lento o no en absoluto. Indicar la propensión a reaccionar a través de un mecanismo E2 en cada uno de los siguientes compuestos. Si pudiera reaccionar a través de este mecanismo, mostrar el producto.
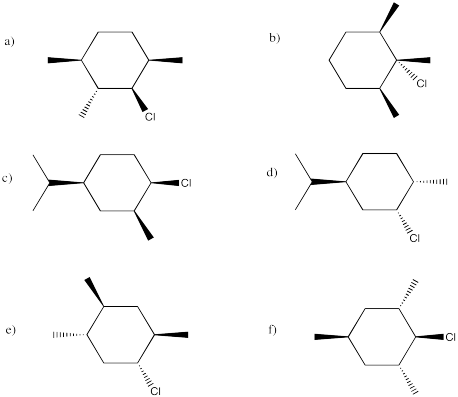
Contestar-
Predecir los productos de eliminación de E2 a partir de los siguientes compuestos.
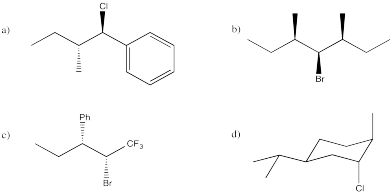
- Contestar
-
A diferencia de las reacciones E2, las reacciones E1 no ocurren en un solo paso. Eso significa que hay tiempo para la reorganización en el intermedio. Una vez que el grupo de salida se va, el catión puede clasificarse en el conformador más estable. Cuando se toma el protón, generalmente el estereoisómero más estable resulta porque proviene del conformador más estable del catión. Cualquier interacción estérica en el alqueno también se habría producido en el catión, por lo que esta interacción se habría resuelto en ese momento.
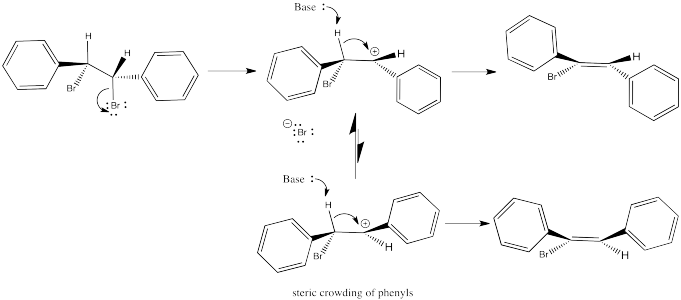
Así, en el caso de los dibromoestilbenos examinados anteriormente, la eliminación de E1 resultaría en el mismo producto en cualquier caso.
- Las reacciones E1 pueden, en principio, conducir a cualquiera de las dos estereoquímica del alqueno.
- La rotación libre alrededor de los enlaces en el carbocatión intermedio permite que el catión adopte cualquiera de los conformadores antes de la eliminación.
- Sin embargo, las interacciones estéricas conducirán a una preponderancia de un conformador.
- El conformador más estable conducirá al alqueno más estable.
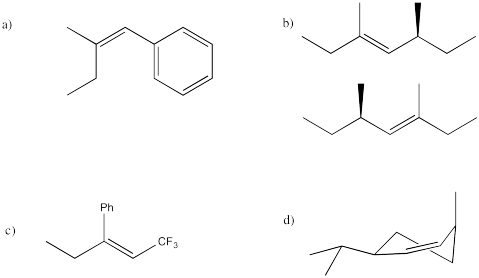
Predecir los productos de los siguientes compuestos bajo condiciones E1.

Contestar-