4.16: Sustitución Nucleofílica en Síntesis - Alcoholes y Éteres
- Page ID
- 78825
Las reacciones de sustitución nucleofílica pueden ser útiles en la síntesis orgánica. En su mayoría se utilizan para la interconversión de grupos funcionales. Por ejemplo, un haluro de alquilo podría transformarse en un alcohol o en un éter.
El problema es que estos pasos aparentemente simples pueden ser muy difíciles. Eso es porque el hidróxido necesario para hacer un alcohol a partir de un haluro de alquilo es realmente bastante básico. Así es el alcóxido que se necesitaría para convertir un haluro de alquilo en éter. En lugar de sustitución, es posible que obtenga una reacción de eliminación.

¿A quién le importa? Bueno, te importaría si estuvieras trabajando en la síntesis de un medicamento antipalúdico que pudiera ahorrar millones, o un medicamento contra el cáncer, o cualquier cosa de esa naturaleza. Tal vez ese éter forme la última parte crucial del farmacoforo que unirá el fármaco a su diana. Sin esta reacción, puede ser miles de veces menos efectiva. Entonces esta pequeña reacción podría ser muy importante.
Claramente, lo mejor que se puede hacer sería asegurarse de que ocurriera una reacción de sustitución, y no esa eliminación. Necesitamos que el reactivo sea un nucleófilo, no una base.
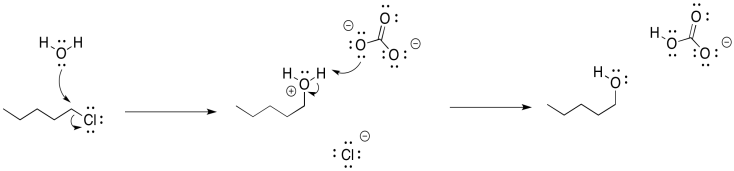
En el caso de la síntesis de alcohol, podríamos usar el agua como nucleófilo, en lugar de hidróxido. El agua es ciertamente menos básica que el ion hidróxido. Sigue siendo nucelofílica, sin embargo, porque todavía tiene una pareja solitaria. Si lo agregamos a un cloruro de alquilo, el agua desplazará al cloruro, y luego el protón extra será arrancado del átomo de oxígeno positivo por el cloruro, dejándonos con el alcohol.
Ese último paso formaría cloruro de hidrógeno, un ácido corrosivo, y eso podría causar problemas. Para contrarrestar esa posibilidad, vamos a querer agregar una base débil para que el HCl se neutralice. El carbonato de sodio (Na 2 CO 3) o el bicarbonato de sodio (NaHCO 3) pueden ser buenas opciones, porque son levemente básicos y se disuelven en agua.
Alternativamente, podríamos simplemente usar hidróxido de sodio como base. Eso nos devuelve al problema original. Sin embargo, para evitar la eliminación, utilizaríamos hidróxido de sodio muy diluido. Mantendríamos su concentración lo suficientemente baja como para que el haluro de alquilo tenga muchas más probabilidades de reaccionar con el agua que con el ión hidróxido, por la sencilla razón de que es mucho más probable que se encuentre con una molécula de agua que con un ion hidróxido. Sin embargo, una vez que ese átomo donante de oxígeno recogiera una carga positiva, sería más atractivo para el ion hidróxido, y entonces el hidróxido entraría para el protón.
De la misma manera, si quisiéramos hacer un éter, podríamos usar un alcohol como nucleófilo en lugar del ion alcóxido mucho más básico. Agregaríamos una base débil para esponjar el protón extra y evitar la formación de un ácido fuerte.

- Un nucleófilo neutro es menos básico que uno aniónico, y puede evitar reacciones de eliminación
- Se puede usar una base débil para eliminar protones de la reacción
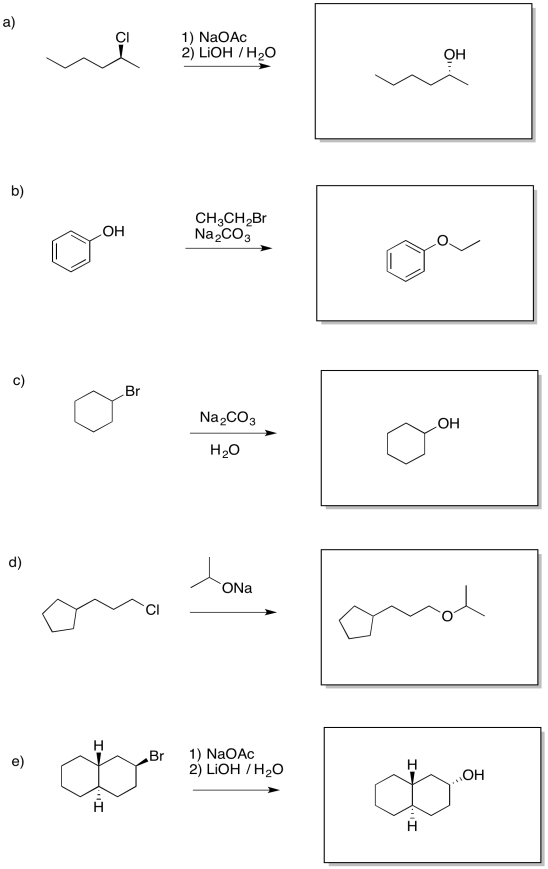
Proporcionar un mecanismo para la siguiente reacción.

Contestar-
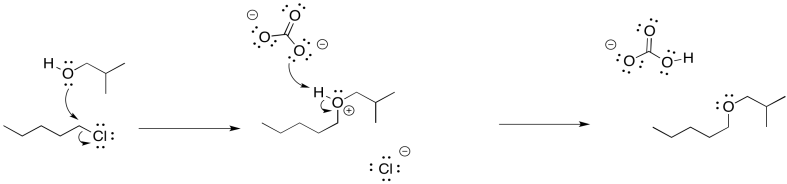
Existe otro enfoque para limitar la cantidad de eliminación durante una etapa de sustitución para formar un alcohol. También implica el uso de un nucleófilo más estable que un ion hidróxido. Sin embargo, emplea un nucleófilo aniónico más reactivo, en lugar del agua neutra. Si en su lugar se usa un ion acetato, generalmente ocurre muy poca eliminación. Se forma un éster como producto. No hay mucha eliminación porque el ion acetato está estabilizado por resonancia. Los nucleófilos más estables suelen sufrir sustitución en lugar de eliminación.
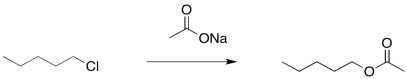
Por supuesto, no queríamos un éster; queríamos un alcohol. No hay problema. Los ésteres pueden saponificarse con relativa facilidad, es decir, descomponerse en un alcohol y un carboxilato. Simplemente agregue un hidróxido y agua. Ahora el electrófilo carbonílico más fuerte es un mejor objetivo para el hidróxido y la reacción está bastante bien asegurada para llegar al lugar correcto.
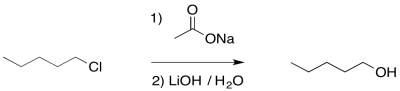
En general, la reacción es en realidad una secuencia de varios eventos.
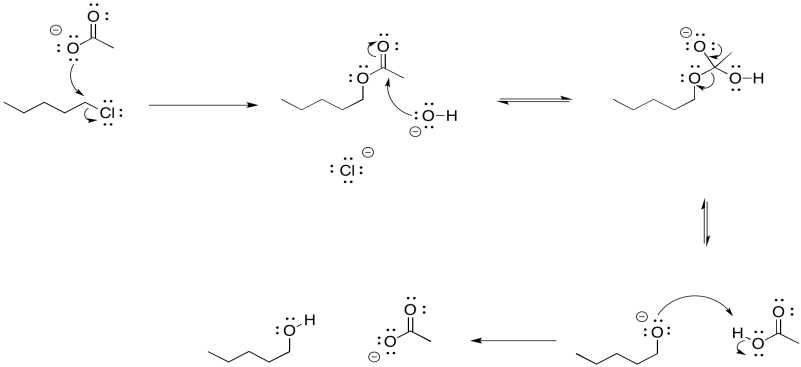
- Los ésteres de acetato se convierten fácilmente en alcoholes en condiciones básicas
- Al convertir un haluro de alquilo en un éster primero, y luego en un alcohol, podemos limitar la competencia con la eliminación
No podemos tomar el mismo enfoque en la síntesis de éter. Un éter es un puente de oxígeno entre dos carbonos tetraédricos o sp 3; no podemos tener estabilización de resonancia y todavía tenemos esos dos carbonos sp 3. En cambio, a veces se emplea otra estrategia durante la adición de un nucleófilo aniónico a un haluro de alquilo. Todavía se emplea un ion alcóxido, pero se tiene cuidado en cómo se eligen el alcóxido y el haluro de alquilo. Debido a que el éter es simétrico —son dos carbonos tetraédricos unidos a un oxígeno—, cada lado podría originarse como alcóxido y cualquier lado podría originarse como haluro de alquilo.
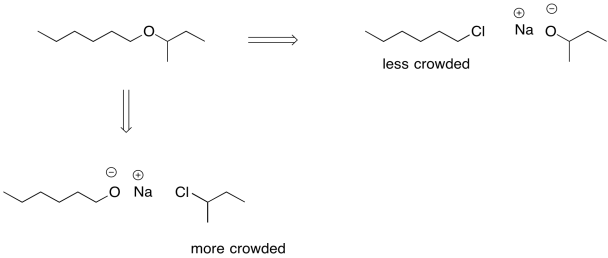
Si se elige el haluro de alquilo para minimizar el hacinamiento estérico, hay una menor probabilidad de una colisión accidental entre el alcóxido y un hidrógeno beta en ese haluro de alquilo. En algunos casos, incluso podríamos elegir el haluro de alquilo para que la eliminación no sea posible en absoluto. Si es posible, podemos usar un haluro de alquilo que no tenga ningún hidrógeno beta.

En general, el uso de iones alcóxido como nucleófilos puede ser bastante exitoso si se hace con cuidado, y este enfoque para hacer éteres incluso tiene su propio nombre. Se llama la síntesis de éter de Williamson.
- En la síntesis de éter de Williamson, la mitad menos concurrida del éter se forma a partir del haluro de alquilo
- En algunos casos, también se puede elegir un haluro de alquilo porque la eliminación no es físicamente posible con esa estructura.
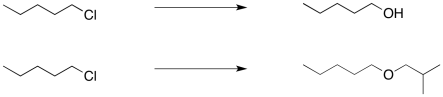
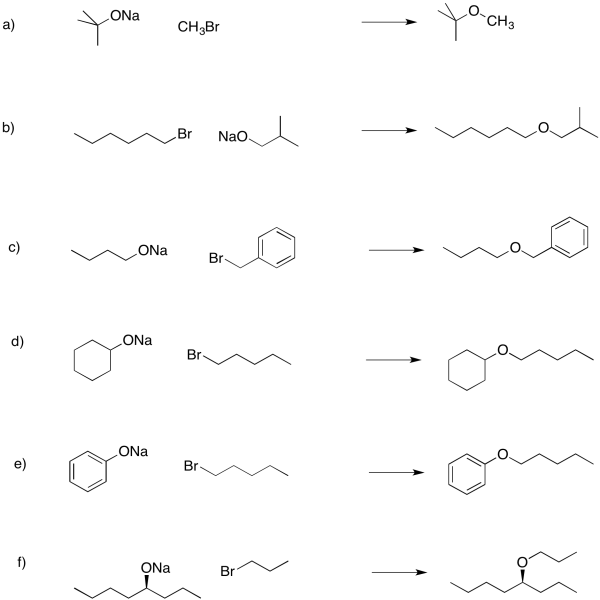
Proponer síntesis de éter de Williamson de los siguientes compuestos.

Contestar-
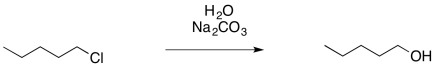
Proporcionar productos de las siguientes reacciones.
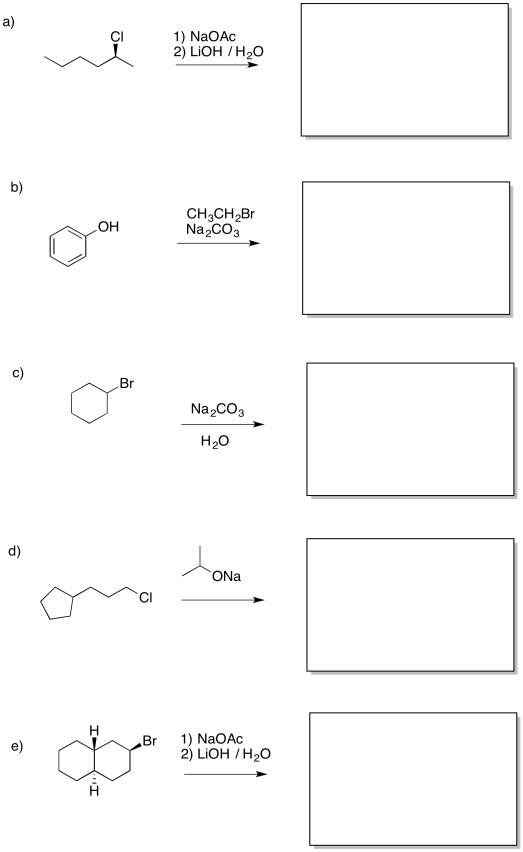
Contestar-