7.4: Líquidos y sus interfaces
- Page ID
- 70762
- Los líquidos son fluidos y fases condensadas. Explique qué nos dice esto sobre los líquidos, y qué otros estados de la materia encajan en cada una de estas categorías.
- Definir la viscosidad y comentar las propiedades moleculares que se correlacionan con la viscosidad.
- Definir la tensión superficial y explicar su causa.
- Indique los principales factores que determinan la medida en que un líquido mojará una superficie sólida.
- Explique qué es un surfactante, y cómo reduce la tensión superficial del agua y ayuda en la limpieza.
- Explicar los orígenes del aumento capilar e indicar los principales factores que la afectan.
- Describir la estructura de una burbuja de jabón y comentar el papel de las moléculas de “jabón” en su estabilización.
- Comentar sobre la aplicabilidad del término “estructura” al describir una fase líquida pura.
Las unidades moleculares de un líquido, como las de los sólidos, están en contacto directo, pero nunca por ningún período de tiempo y en las mismas ubicaciones. Mientras que las moléculas o iones de un sólido mantienen las mismas posiciones promedio, las de los líquidos están continuamente saltando y deslizándose hacia otras nuevas, dando a los líquidos algo de la movilidad de los gases. Desde el punto de vista de la química, esto representa lo mejor de dos mundos; el cambio químico rápido requiere un contacto íntimo entre los agentes sometidos a reacción, pero estos agentes, junto con los productos de reacción, deben ser libres de alejarse para permitir nuevos contactos y posteriores reacciones. Es por ello que gran parte de lo que hacemos con la química se lleva a cabo en fase líquida.
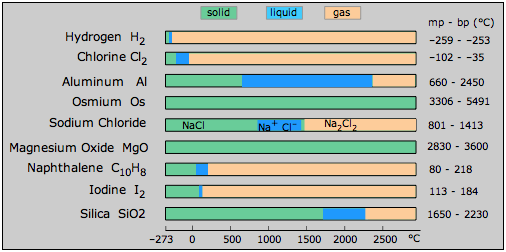
Los líquidos ocupan un lugar bastante peculiar en la trinidad de sólidos, líquidos y gases. Un líquido es el estado preferido de una sustancia a temperaturas intermedias entre los reinos del sólido y el gas. Sin embargo, si uno mira los puntos de fusión y ebullición de una variedad de sustancias Figura\(\PageIndex{1}\), notará que el rango de temperatura dentro del cual pueden existir muchos líquidos tiende a ser bastante pequeño. En esto, y de varias otras maneras, el estado líquido parece ser algo tenue e inseguro, como si no tuviera un derecho claro a existir en absoluto, y sólo lo hace como un descuido de la Naturaleza. Ciertamente el estado líquido es el más complicado de los tres estados de la materia de analizar y comprender. Pero así como las personas cuyas personalidades son más complicadas y enigmáticas suelen ser las más interesantes de conocer, son estas mismas características las que hacen que el estado líquido de la materia sea el más fascinante de estudiar.
Cualquiera suele saber si una sustancia es un líquido simplemente mirándola. ¿Qué propiedades físicas especiales poseen los líquidos que los hacen tan fáciles de reconocer? Una propiedad obvia es su movilidad, que se refiere a su capacidad de moverse, de cambiar su forma para conformarse a la de un contenedor, de fluir en respuesta a un gradiente de presión, y de ser desplazados por otros objetos. Pero estas propiedades son compartidas por los gases, el otro miembro de los dos estados fluidos de la materia. El verdadero regalo es que un líquido ocupa un volumen fijo, con la consecuencia de que un líquido posee una superficie definida. Los gases, por supuesto, no lo hacen; el volumen y la forma de un gas son simplemente los del contenedor en el que está confinado. La mayor densidad de un líquido también juega un papel aquí; es sólo por la gran diferencia de densidad entre un líquido y el espacio por encima de él que podemos ver la superficie en absoluto. (Lo que realmente estamos viendo son los efectos de reflexión y refracción que ocurren cuando la luz pasa a través del límite entre dos fases que difieren en densidad, o más precisamente, en sus índices de refracción).
Viscosidad: Resistencia al Flujo
El término viscosidad es una medida de la resistencia al flujo. Se puede medir observando el tiempo requerido para que un volumen dado de líquido fluya a través de la parte estrecha de un tubo viscosímetro. La viscosidad de una sustancia está relacionada con la fuerza de las fuerzas que actúan entre sus unidades moleculares. En el caso del agua, estas fuerzas se deben principalmente a los enlaces de hidrógeno. Los líquidos como los jarabes y la miel son mucho más viscosos porque los azúcares que contienen están tachonados de grupos hidroxilo (—OH) que pueden formar múltiples enlaces de hidrógeno con el agua y entre sí, produciendo una red pegajosa y desordenada.
|
|
|
|---|---|
| agua H (OH) | 1.00 |
| éter dietílico (CH 3 -CH 2) 2 O | 0.23 |
| benceno C 6 H 6 | 0.65 |
| glicerina C 3 H 2 (OH) 3 | 280 |
| mercurio | 1.5 |
| aceite de motor, SAE30 | 200 |
| miel | ~10,000 |
| melaza | ~5000 |
| sirope para panqueques | ~3000 |
Incluso en ausencia de enlaces de hidrógeno, las fuerzas de dispersión están presentes universalmente (como en el mercurio). Debido a que estas fuerzas son aditivas, pueden ser muy significativas en moléculas largas de cadena de carbono como las que se encuentran en los aceites utilizados en la cocción y para la lubricación. La mayoría de las moléculas de “cadena recta” están realmente dobladas en formas complejas, y las fuerzas de dispersión tienden a preservar sus enredos tipo espagueti con sus vecinos.

La dependencia de la temperatura de la viscosidad de los líquidos es bien conocida por cualquiera que haya intentado verter jarabe frío sobre un panqueque. Debido a que las fuerzas que dan lugar a la viscosidad son débiles, son fácilmente superadas por movimientos térmicos, por lo que no es de sorprender que la viscosidad disminuya a medida que aumenta la temperatura.
| T/°C | 0 | 10 | 20 | 40 | 60 | 80 | 100 |
|---|---|---|---|---|---|---|---|
| Viscosidad/CP | 1.8 | 1.3 | 1.0 | 0.65 | 0.47 | 0.36 | 0.28 |
Aceite de Motor
Los aceites lubricantes automotrices pueden ser demasiado viscosos a bajas temperaturas (lo que dificulta que su automóvil funcione en un día frío), al tiempo que pierden tanta viscosidad a las temperaturas de funcionamiento del motor que sus propiedades lubricantes se ven afectadas. Estos aceites de motor se venden en una amplia gama de viscosidades; los aceites de mayor viscosidad se utilizan en climas más cálidos y los aceites de menor viscosidad en climas más fríos. La idea es lograr una viscosidad bastante constante que sea ideal para la aplicación particular. Al mezclar ciertos ingredientes, los fabricantes de lubricantes son capaces de formular aceites “multigrado” cuyas viscosidades son menos sensibles a las temperaturas, lo que hace que un solo producto sea útil en un rango de temperatura mucho más amplio.
La próxima vez que vierta un líquido viscoso sobre una superficie, observe cómo diferentes partes del líquido se mueven a diferentes velocidades y a veces en diferentes direcciones. Para volar libremente, las partículas que componen un fluid deben poder moverse independientemente. Las fuerzas de atracción intermolecular trabajan en contra de esto, dificultando que una molécula se aleje de sus vecinos y se abra paso entre nuevos vecinos.
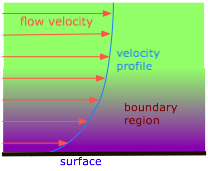
La caída de presión que se observa cuando un líquido fluye a través de una tubería es consecuencia directa de la viscosidad. Esas moléculas que se encuentran cerca de las paredes internas de un tubo tienden a pasar gran parte de su tiempo unidas a las paredes por fuerzas intermoleculares, y así avanzar muy lentamente. El movimiento de la siguiente capa de moléculas se ve impedido a medida que se deslizan y se deslizan sobre los motores lentos; este proceso continúa a través de capas sucesivas de moléculas a medida que avanzamos hacia el centro del tubo, donde la velocidad es mayor. Este efecto se llama arrastre viscoso, y es directamente responsable de la caída de presión que puede ser bastante notoria cuando estás tomando un baño de ducha y alguien más en la casa de repente enciende el agua de la cocina.
Los líquidos y gases son fluidos y exhiben resistencia al flujo a través de un espacio confinado. Sin embargo, es interesante (y no suele apreciarse) que sus viscosidades tengan orígenes completamente diferentes, y que varíen con la temperatura de maneras opuestas. ¿Por qué debería aumentar la viscosidad de un gas con la temperatura?
Tensión superficial
Una molécula dentro del grueso de un líquido experimenta atracciones a las moléculas vecinas en todas las direcciones, pero como estas promedian a cero, no hay fuerza neta sobre la molécula porque es, en promedio, tan energéticamente cómoda en una ubicación dentro del líquido como en otra. Los líquidos normalmente tienen superficies, sin embargo, y una molécula que se encuentra en tal ubicación es atraída hacia sus vecinos debajo y hacia ambos lados, pero no hay atracción operando en el ángulo sólido de 180° sobre la superficie. Como consecuencia, una molécula en la superficie tenderá a ser arrastrada hacia el grueso del líquido. Por el contrario, se debe trabajar para mover una molécula dentro de un líquido a su superficie.
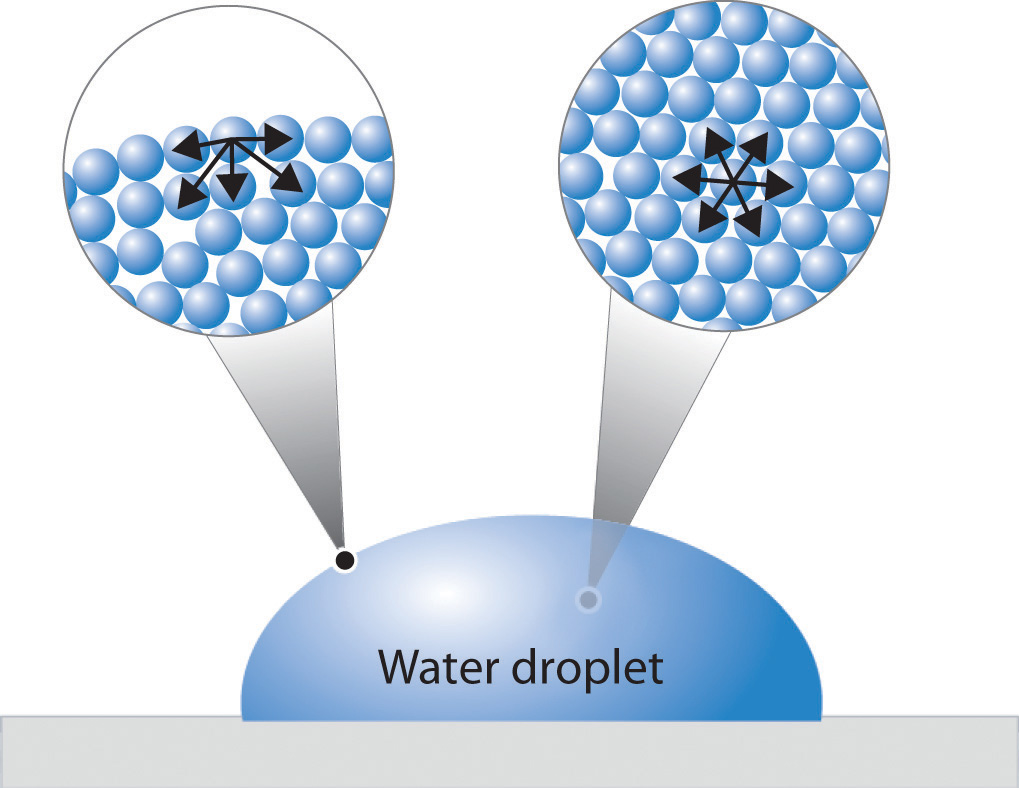
Claramente siempre debe haber algunas moléculas en la superficie, pero cuanto menor sea la superficie, menor será la energía potencial. Así, las fuerzas de atracción intermoleculares actúan para minimizar el área superficial de un líquido. La forma geométrica que tiene la menor relación entre área superficial y volumen es la esfera, por lo que cantidades muy pequeñas de líquidos tienden a formar gotas esféricas. A medida que las gotas se hacen más grandes, su peso las deforma en la típica forma de lágrima.
Piensa en una burbuja como una gota hueca. La tensión superficial actúa para minimizar la superficie, y por lo tanto el radio de la capa esférica de líquido, pero esto es opuesto por la presión de vapor atrapado dentro de la burbuja.
El desequilibrio de fuerzas cerca de la superficie superior de un líquido tiene el efecto de una película elástica estirada a través de la superficie. Probablemente hayas visto zancudas de agua y otros insectos aprovechan esto cuando cruzan un estanque. Del mismo modo, se puede “flotar” cuidadosamente un objeto ligero como un clip de acero en la superficie del agua en una taza.


La tensión superficial se define como la cantidad de trabajo que se debe realizar para crear una unidad de área de superficie. Las unidades SI son J m —2 (o N m —1), pero los valores se expresan más comúnmente en mN m —1 o en unidades cgs de dyn cm —1 o erg cm —2. Tabla\(\PageIndex{3}\) compara las tensiones superficiales de varios líquidos a temperatura ambiente. Tenga en cuenta especialmente que:
- hidrocarburos y líquidos no polares como el éter tienen valores bastante bajos
- una de las principales funciones de los jabones y otros surfactantes es reducir la tensión superficial del agua
- el mercurio tiene la tensión superficial más alta de cualquier líquido a temperatura ambiente. Es tan alto que el mercurio no fluye de la manera ordinaria, sino que se rompe en pequeñas gotas que ruedan de forma independiente.
|
|
|
|---|---|
| agua H (OH) | 72.7 |
| éter dietílico (CH 3 -CH 2) 2 O | 17.0 |
| benceno C 6 H 6 | 40.0 |
| glicerina C 3 H 2 (OH) 3 | 63 |
| mercurio (15°C) | 487 |
| n -octano | 21.8 |
| solución de cloruro de sodio (6 M en agua) | 82.5 |
| solución de sacarosa (85% en agua) | 76.4 |
| solución de oleato de sodio (jabón) en agua | 25 |
La tensión superficial y la viscosidad no están directamente relacionadas, ya que se puede verificar observando los valores dispares de estas dos cantidades para mercurio. La viscosidad depende de las fuerzas intermoleculares dentro del líquido, mientras que la tensión superficial surge de la diferencia en las magnitudes de estas fuerzas dentro del líquido y en la superficie. La tensión superficial también se ve afectada por la carga electrostática de un cuerpo. Esto se ilustra de manera más dramática con la famosa demostración de “corazón latiendo mercurio”..
La tensión superficial siempre disminuye con la temperatura ya que los movimientos térmicos reducen el efecto de las atracciones intermoleculares (Tabla\(\PageIndex{4}\)). Esta es una de las razones por las que lavar con agua tibia es más efectivo; la menor tensión superficial permite que el agua penetre más fácilmente en una tela.
| °C | dinas/cm |
|---|---|
| 0 | 75.9 |
| 20 | 72.7 |
| 50 | 67.9 |
| 100 | 58.9 |
“Lágrimas” en una copa de vino: efectos de un gradiente de tensión superficial
¿Por qué se forman “lágrimas” dentro de una copa de vino? Sin duda te has dado cuenta de esto; vierte un poco de vino en una copa, y después de unos minutos, se pueden ver gotitas de líquido transparente formándose en las paredes interiores de la copa aproximadamente un centímetro por encima del nivel del vino. Esto sucede incluso cuando el vino y la copa están a temperatura ambiente, por lo que no tiene nada que ver con la condensación.

La explicación involucra la ley de Raoult, los enlaces de hidrógeno, la adsorción y la tensión superficial, por lo que este fenómeno hace una buena revisión de mucho que ha aprendido sobre líquidos y soluciones. La tendencia de un gradiente de tensión superficial a atraer agua hacia la región de mayor tensión superficial se conoce como el efecto Maringoni
Primero, recuerde que tanto el agua como el alcohol son líquidos de enlace de hidrógeno; como tal, ambos son fuertemente atraídos por los átomos de oxígeno y los grupos -OH en la superficie del vidrio. Esto hace que la película líquida se deslice por las paredes del vidrio. El alcohol, el más volátil de los dos líquidos, se vaporiza más fácilmente, haciendo que la parte superior (y más delgada) de la película líquida se enriquezca en agua. Debido a su enlace de hidrógeno más fuerte, el agua tiene una tensión superficial mayor que el alcohol, por lo que a medida que el alcohol se evapora, la tensión superficial de la parte superior de la película líquida aumenta. Esta esa parte de la película dibuja más líquido y asume una forma esférica que se distorsiona por la gravedad en una “lágrima”, que eventualmente crece tan grande que la gravedad gana sobre la adsorción, y la gota vuelve a caer en el líquido, pronto para ser reemplazada por otra.
Efectos interfaciales en líquidos
La tensión superficial discutida inmediatamente antes es un atributo de un líquido en contacto con un gas (normalmente el aire o vapor) o un vacío. Pero si lo piensas, las moléculas en la parte de un líquido que está en contacto con cualquier otra fase (líquida o sólida) experimentarán un equilibrio de fuerzas diferente al de las moléculas dentro del grueso del líquido. Por lo tanto, la tensión superficial es un caso especial de la tensión interfacial más general que se define por el trabajo asociado con el movimiento de una molécula desde el interior del líquido a granel a la interfaz con cualquier otra fase.
Mojar
Toma un tazón de plástico para mezclar de tu cocina y chapotear un poco de agua en él. Probablemente observarás que el agua no cubre la superficie interior de manera uniforme, sino que permanece dispersa en gotas. El mismo efecto se ve en un parabrisas sucio; el funcionamiento de los limpiaparabrisas simplemente rompe cientos de gotas en miles. Por el contrario, el agua vertida sobre una superficie de vidrio limpia la mojará, dejando una película uniforme.

Cuando una molécula de un líquido está en contacto con otra fase, su comportamiento depende de las resistencias relativamente atractivas de sus vecinos en los dos lados del límite de fase. Si la molécula se siente más fuertemente atraída por su propio tipo, entonces la tensión interfacial actuará para minimizar el área de contacto al aumentar la curvatura de la superficie. Esto es lo que sucede en la interfaz entre el agua y una superficie hidrofóbica como un recipiente plástico para mezclar o un parabrisas recubierto de material aceitoso. Un líquido mojará una superficie si el ángulo en el que hace contacto con la superficie es inferior a 90°. El valor de este ángulo de contacto se puede predecir a partir de las propiedades del líquido y del sólido por separado.
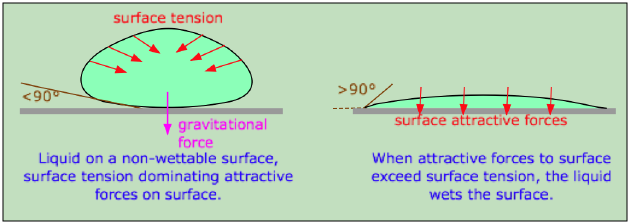
Una superficie de vidrio limpia, por el contrario, tiene grupos —OH que sobresalen de ella que se unen fácilmente a las moléculas de agua a través de enlaces de hidrógeno; la energía potencial más baja ocurre ahora cuando se maximiza el área de contacto entre el vidrio y el agua. Esto hace que el agua se extienda uniformemente sobre la superficie, o que la humedezca.
Tensioactivos
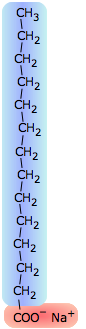 La tensión superficial del agua se puede reducir a aproximadamente un tercio de su valor normal mediante la adición de un poco de jabón o detergente sintético. Estas sustancias, conocidas colectivamente como surfactantes, son generalmente moléculas de hidrocarburos que tienen un grupo iónico en un extremo. El grupo iónico, al ser altamente polar, es fuertemente atraído por las moléculas de agua; decimos que es hidrofílico. La porción hidrocarbonada (hidrofóbica) es justo lo contrario; insertarla en el agua rompería las fuerzas locales de enlace de hidrógeno y, por lo tanto, es energéticamente desfavorable. Lo que sucede, entonces, es que las moléculas de surfactante migran a la superficie con sus extremos hidrófobos sobresaliendo, creando efectivamente una nueva superficie. Debido a que los hidrocarburos interactúan solo a través de fuerzas de dispersión muy débiles, esta nueva superficie tiene una tensión superficial muy reducida.
La tensión superficial del agua se puede reducir a aproximadamente un tercio de su valor normal mediante la adición de un poco de jabón o detergente sintético. Estas sustancias, conocidas colectivamente como surfactantes, son generalmente moléculas de hidrocarburos que tienen un grupo iónico en un extremo. El grupo iónico, al ser altamente polar, es fuertemente atraído por las moléculas de agua; decimos que es hidrofílico. La porción hidrocarbonada (hidrofóbica) es justo lo contrario; insertarla en el agua rompería las fuerzas locales de enlace de hidrógeno y, por lo tanto, es energéticamente desfavorable. Lo que sucede, entonces, es que las moléculas de surfactante migran a la superficie con sus extremos hidrófobos sobresaliendo, creando efectivamente una nueva superficie. Debido a que los hidrocarburos interactúan solo a través de fuerzas de dispersión muy débiles, esta nueva superficie tiene una tensión superficial muy reducida.
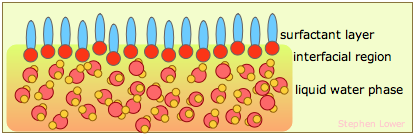
Lavado
¿Cómo ayudan los jabones y detergentes a limpiar las cosas? Hay dos mecanismos principales. Primero, al reducir la tensión superficial del agua, el agua puede penetrar más fácilmente en las telas (vea la ilustración debajo de “Repelencia al agua” a continuación). En segundo lugar, gran parte de lo que llamamos “suciedad” consiste en aceites no solubles en agua y materiales grasos que pueden penetrar los extremos hidrófobos de las moléculas tensioactivas. Cuando lo hacen en número suficiente y con sus extremos polares sobresaliendo, el agregado resultante puede unirse por hidrógeno al agua y se “solubiliza”.

El lavado suele ser más efectivo en agua tibia; las temperaturas más altas reducen la tensión superficial del agua y facilitan que las moléculas de surfactante penetren en el material a eliminar.
¿Pueden los imanes reducir la tensión superficial del agua?
La respuesta es no, pero afirma que pueden circular ampliamente en promociones de productos dudosos como los “discos magnéticos de lavandería” que se supone reducen la necesidad de detergentes.
Repelencia al agua
En Gore-Tex, una de las telas impermeables más exitosas, las fibras se hacen no humectables recubriéndolas con un fluoropolímero similar al teflón.
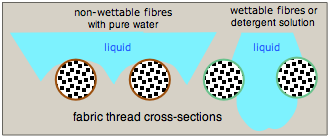
El agua es muy atraída por muchas fibras naturales como el algodón y el lino a través de enlaces de hidrógeno a sus grupos hidroxilo celulósicos. Una gotita que cae sobre tal material flotará y será arrastrada a través de la tela. Una forma de evitar esto es recubrir las fibras con un material polimérico que no se humedezca fácilmente. El agua tiende a curvarse alejándose de las fibras para minimizar el área de contacto, por lo que las gotitas se apoyan en la rejilla de la tela pero tienden a no caer a través.
Elevación capilar
Si las paredes de un tubo estrecho pueden ser humedecidas eficientemente por un líquido, entonces el líquido se extraerá en el tubo por acción capilar. Este efecto solo se nota en recipientes estrechos (como las buretas) y especialmente en tubos capilares de pequeño diámetro. Cuanto menor sea el diámetro del tubo, mayor será la subida capilar. Una superficie de vidrio limpia es muy atractiva para la mayoría de las moléculas, por lo que la mayoría de los líquidos muestran un menisco cóncavo en un tubo de vidrio
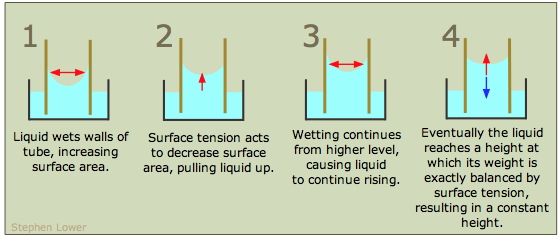
Para ayudarle a entender el ascenso capilar, el diagrama anterior muestra un tubo de vidrio de pequeña sección transversal insertado en un recipiente abierto de agua. La atracción del agua hacia la pared interna del tubo tira de los bordes del agua hacia arriba, creando un menisco curvo cuya superficie es menor que el área de sección transversal del tubo. La tensión superficial del agua actúa contra este agrandamiento de su superficie al intentar reducir la curvatura, estirando la superficie en forma de flata tirando del líquido más hacia arriba en el tubo. Este proceso continúa hasta que el peso de la columna de líquido se vuelve igual a la fuerza de tensión superficial, y el sistema alcanza el equilibrio mecánico.
El aumento capilar es el resultado de una combinación de dos efectos: la tendencia del líquido a humedecer (unirse a) la superficie del tubo (medida por el valor del ángulo de contacto) y la acción de la tensión superficial del líquido para minimizar su área superficial.
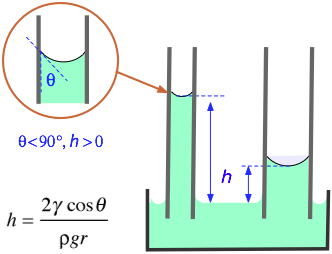
En la fórmula que se muestra a la izquierda (¡que no necesitas memorizar!)
h = elevación del líquido (m)
γ = tensión superficial (N/m)
θ = ángulo de contacto (radianes)
ρ = densidad del líquido (kg/m 3)
g = aceleración de la gravedad (m/s —2)
r = radio del tubo (m)
El ángulo de contacto entre el agua y el vidrio ordinario de cal sodada es esencialmente cero; dado que el coseno de 0 radianes es unidad, su ascenso capilar es especialmente notable. En general, el agua se puede aspirar de manera muy efectiva hacia aberturas estrechas como los canales entre las fibras en una tela y en materiales porosos como los suelos.
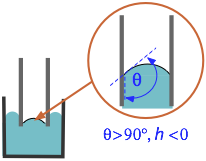
Tenga en cuenta que si θ es mayor que 90° (π/2 radianes), la “subida” capilar será negativa, lo que significa que las moléculas del líquido son más fuertemente atraídas entre sí que hacia la superficie. Esto se ve fácilmente con mercurio en un recipiente de vidrio, en el que el menisco es convexo hacia arriba en lugar de cóncavo.
Acción capilar y árboles
La elevación capilar es el principal mecanismo por el cual el agua es capaz de llegar a las partes más altas de los árboles. El agua se une fuertemente a los canales estrechos (25 μM) de celulosa en el xilema. (La presión osmótica y la “succión” producida por la pérdida de vapor de agua a través de las hojas también contribuyen a este efecto, y son los principales impulsores del flujo de agua en plantas más pequeñas).
Burbujas
Las burbujas pueden considerarse como “gotas negativas”, espacios esféricos dentro de un líquido que contiene un gas, a menudo solo el vapor del líquido. Las burbujas dentro de líquidos puros como el agua (que vemos cuando el agua hierve) son inherentemente inestables porque la tensión superficial del líquido hace que colapsen. Pero en presencia de un surfactante, las burbujas pueden estabilizarse y darse una existencia independiente si evanescente.
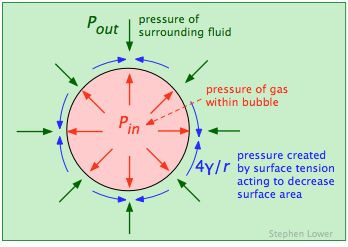
La presión del gas dentro de una burbuja P in debe ser suficiente para oponerse a la presión fuera de ella (P out, la presión atmosférica más la presión hidrostática de cualquier otro fluido en el que se sumerja la burbuja. Pero la fuerza causada por la tensión superficial γ del límite líquido también tiende a colapsar la burbuja, por lo que P in debe ser mayor que P out por la cantidad de esta fuerza, que viene dada por 4γ/ r:
\[ P_{in}=P_{out} + \dfrac{4\gamma}{r}\]
La característica más importante de esta relación (conocida como ley de LaPlace) es que la presión requerida para mantener la burbuja es inversamente proporcional a su radio. ¡Esto significa que las burbujas más pequeñas tienen las mayores presiones internas de gas! Esto puede parecer contradictorio, pero si eres un experimentado soplador de burbujas de jabón, o has volado un globo de goma (en el que el elástico de la goma tiene un efecto similar a la tensión superficial en un líquido), habrás notado que necesitas soplar más fuerte para comenzar la expansión.
Burbujas de jabón
Todos nosotros en un momento u otro hemos disfrutado de la fascinación de crear pompas de jabón y admirar sus colores intensos y variados mientras se desplazan en el aire, aparentemente distantes de las limitaciones que rigen el comportamiento de los objetos ordinarios, ¡pero solo por un tiempo! Su vida finalmente llega a un final abrupto cuando caen al suelo o estallan en pleno vuelo.
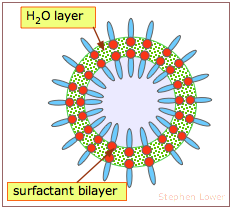
Las paredes de estas burbujas consisten en una fina capa de moléculas de agua intercaladas entre dos capas de moléculas de surfactantes. Su forma esférica es, por supuesto, el resultado de la tensión superficial del agua. Aunque el surfactante (jabón) inicialmente reduce la tensión superficial, la expansión de la burbuja extiende el agua en una capa más delgada y extiende las moléculas de surfactante sobre un área más amplia, disminuyendo su concentración. Esto, a su vez, permite que las moléculas de agua interactúen más fuertemente, aumentando su tensión superficial y estabilizando la burbuja a medida que se expande.
Los colores brillantes que vemos en las burbujas surgen de la interferencia entre las ondas de luz que se reflejan de nuevo desde las superficies interna y externa, lo que indica que el grosor de la capa de agua es comparable al rango de luz visible (alrededor de 400-600 nm).
Una vez liberada la burbuja, puede aguantar hasta que golpea una superficie sólida o colapsa debido a la pérdida de la capa de agua por evaporación. Este último proceso se puede ralentizar agregando un poco de glicerina al líquido. Una variedad de recetas y “soluciones para hacer burbujas” comerciales están disponibles; algunas de estas últimas emplean polímeros líquidos especiales que ralentizan la evaporación y prolongan enormemente la vida útil de las burbujas. Las burbujas sopladas a temperaturas muy bajas pueden congelarse, pero estas eventualmente colapsan a medida que el gas se difunde.
Burbujas, tensión superficial y respiración
Los sitios de intercambio de gases con la sangre en los pulmones de los mamíferos son pequeños sacos conocidos como alvéolos. En los humanos hay alrededor de 150 millones de estos, teniendo una superficie total aproximadamente del tamaño de una cancha de tenis. La superficie interna de cada alvéolo es de aproximadamente 0.25 mm de diámetro y está recubierta con una película de agua, cuya alta tensión superficial no solo resiste el inflado, sino que normalmente provocaría el colapso de los alvéolos de pared delgada. Para contrarrestar este efecto, células especiales en la pared alveolar secretan un surfactante pulmonar fosfolípido que reduce la tensión superficial de la película de agua a aproximadamente 35% de su valor normal. Pero hay otro problema: los alvéolos pueden considerarse físicamente como una enorme colección de burbujas interconectadas de diferentes tamaños. Como se señaló anteriormente, la tensión superficial de una burbuja estabilizada con surfactante aumenta con su tamaño. Entonces, al facilitar que los alvéolos más pequeños se expandan al tiempo que inhibe la expansión de los más grandes, el surfactante ayuda a igualar los cambios de volumen de todos los alvéolos a medida que uno inhala y exhala.

El surfactante pulmonar se produce solo en las últimas etapas del desarrollo fetal, por lo que los bebés prematuros a menudo no tienen suficiente y están sujetos al síndrome de dificultad respiratoria que puede ser fatal.
Estructura de los líquidos
Se puede pensar en un líquido simple como el argón o el metano como una colección de mármoles poco empaquetados que pueden asumir varias formas.Aunque la disposición general de las unidades moleculares individuales es completamente aleatoria, hay una cierta cantidad de orden de corto alcance: la presencia de una molécula en un punto dado significa que las moléculas vecinas deben estar al menos tan lejos como la suma de los dos radios, y esto a su vez afecta las posibles ubicaciones de conchas concéntricas más distantes de moléculas.
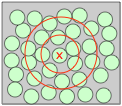
Una consecuencia importante de la disposición desordenada de las moléculas en un líquido es la presencia de espacios vacíos. Estos, junto con el aumento de la energía cinética de las moléculas en colisión que ayuda a separarlas, son responsables de la disminución de aproximadamente 15 por ciento en la densidad que se observa cuando los sólidos basados en moléculas esféricas simples como Ne y Hg se funden en líquidos. Se cree que estos espacios vacíos son la clave de las propiedades de flujo de los líquidos; cuantos más “agujeros” haya en el líquido, más fácilmente las moléculas pueden deslizarse y deslizarse unas sobre otras.
A medida que aumenta la temperatura, los movimientos térmicos de las moléculas aumentan y la estructura local comienza a deteriorarse, como se muestra en las parcelas a continuación.
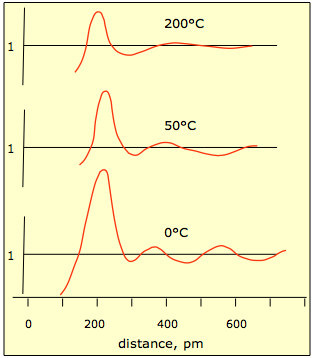
Esta gráfica muestra la probabilidad relativa de encontrar un átomo de mercurio a una distancia dada de otro átomo ubicado a la distancia 0. Se puede ver que a medida que aumentan los movimientos térmicos, las probabilidades se igualan a mayores distancias. Es muy difícil diseñar experimentos que produzcan el tipo de información requerida para definir la disposición microscópica de las moléculas en estado líquido.
Muchas de nuestras ideas actuales sobre el tema provienen de simulaciones por computadora basadas en modelos hipotéticos. En un experimento típico, se calculan las trayectorias de alrededor de 1000 moléculas en un volumen de espacio. Las moléculas reciben inicialmente energías cinéticas aleatorias cuya distribución es consistente con la distribución de Boltzmann para una temperatura dada. Se siguen las trayectorias de todas las moléculas a medida que cambian con el tiempo debido a colisiones y otras interacciones; estas interacciones deben calcularse de acuerdo con una supuesta energía potencial vs. -función de distancia que forma parte del modelo particular que se está investigando.
Estos experimentos por computadora sugieren que cualquier estructura que posean los líquidos simples está determinada principalmente por las fuerzas repulsivas entre las moléculas; las fuerzas atractivas actúan de una manera bastante no direccional y general para mantener el líquido unido. También se encuentra que si las moléculas esféricas se empaquetan tan estrechamente como la geometría lo permita (en el que cada molécula estaría en contacto con doce vecinos más cercanos), la colección tendrá un orden de largo alcance característico de un sólido hasta que la densidad se disminuya en aproximadamente un diez por ciento, momento en el que el las moléculas pueden deslizarse y pasar unas tras otras, preservando así solo el orden de corto alcance. En los últimos años, estudios experimentales basados en destellos láser ultracortos han revelado que las estructuras locales en líquidos tienen vidas extremadamente cortas, del orden de picosegundos a nanosegundos.

Desde hace tiempo se sospecha que la región de un líquido que limita una superficie sólida está más ordenada que dentro del líquido a granel. Esto se ha confirmado para el caso del agua en contacto con silicio, en la que las capas del líquido forman capas, similares a lo que se encuentra en los cristales líquidos.


