7.5: Cambios de Estado
- Page ID
- 70739
Asegúrese de comprender a fondo las siguientes ideas esenciales que se han presentado anteriormente. Es especialmente importante que conozcas los significados precisos de todos los términos en el contexto de este tema.
- Describir lo que se entiende por la tendencia a escapar de las moléculas de un sólido, líquido o gas. ¿Cuál es la cantidad experimentalmente observable que sirve como medida?
- Los términos "presión de vapor" y "presión del vapor por encima de un sólido o líquido” se confunden fácilmente. Explique la diferencia entre ellos, e indique bajo qué condiciones tendrán valores idénticos.
- Definir la humedad relativa y calcular su valor, dada la presión parcial del vapor de agua y una tabla o parcela de presión de vapor adecuada para el agua.
- Explique la diferencia entre evaporación y ebullición, y por qué es posible que los líquidos no comiencen a hervir hasta que la temperatura exceda el punto de ebullición.
- Dado un diagrama de fases de una sustancia pura, etiquetar todas las líneas y regiones que encierran, identificar los puntos normales de fusión y ebullición, el punto triple y el punto crítico, y establecer la significación física de estos dos últimos.
- Por el contrario, esbozar un diagrama de fases debidamente etiquetado para una sustancia pura, dados los parámetros mencionados anteriormente, junto con información sobre las densidades relativas de las fases sólida y líquida.
Una sustancia dada existirá en forma de sólido, líquido o gas, dependiendo de la temperatura y presión. En esta dependencia, aprenderemos qué factores comunes gobiernan el estado preferido de la materia bajo un conjunto particular de condiciones, y examinaremos la manera en que una fase da paso a otra cuando cambien estas condiciones.
Estabilidad de fase
Temprano en la mañana, las gotas de agua en Figura\(\PageIndex{1}\) eran diminutos cristales de hielo, pero a pesar de que la temperatura del aire todavía está alrededor de 0°C y permanecerá así todo el día, el calor del sol los ha convertido en forma líquida, ligados por la tensión superficial en esferas reflectantes. Al final de la tarde, la mayoría de las gotas se habrán ido, sus moléculas H 2 O ahora se dispersaron como un tenue gas atmosférico.

Sólido, líquido y gas, estos son los tres estados básicos, o fases, en los que puede existir la mayoría de las sustancias de moléculas pequeñas. En la mayoría de las combinaciones de presión y temperatura, solo se favorecerá una de estas fases; esta es la fase que es más estable termodinámicamente bajo estas condiciones. Una explicación adecuada de por qué la mayoría de las sustancias tienen puntos de fusión y ebullición bien definidos necesita invocar algunos principios de termodinámica y mecánica cuántica. Una explicación completa de esto iría más allá del alcance de lo que la mayoría de los estudiantes que ven esta lección están familiarizados, pero la siguiente explicación muy sobresimplificada debería convencerte de que es algo más que magia negra.
Todos los átomos y moléculas a temperaturas superiores al cero absoluto poseen energía térmica que los mantiene en constantes estados de movimiento. Una ley fundamental de la naturaleza exige que esta energía tienda a extenderse y compartirse lo más ampliamente posible. Dentro de una sola unidad molecular, esta dispersión y compartición puede ocurrir dispersando la energía en los muchos estados permitidos de movimiento (traslación, vibración, rotación) de las moléculas de la propia sustancia. Hay una gran cantidad de tales estados, y se cuantifican, es decir, que todos requieren diferentes cantidades de energía térmica para entrar en acción. La temperatura es una medida de la intensidad de la energía térmica, por lo que cuanto mayor sea la temperatura, mayor será el número de estados que pueden estar activos, y más extensamente se dispersará la energía entre estos estados permitidos.
En los sólidos, las unidades moleculares están unidas en ubicaciones fijas, por lo que los tipos de movimiento (y por lo tanto el número de estados) que pueden activarse térmicamente son relativamente pequeños. Debido a que las moléculas de sólidos poseen las energías potenciales más bajas, los sólidos son los estados más estables a bajas temperaturas. En el otro extremo están las moléculas de gas que no solo son libres de vibrar y rotar, sino que están en constante movimiento de traslación. El número correspondiente de estados cuánticos es enormemente mayor para los gases, lo que brinda una oportunidad casi infinita de propagar energía. Pero esto sólo puede suceder si la temperatura es lo suficientemente alta como para poblar esta nueva multitud de estados. Una vez que lo hace, el estado gaseoso gana por un deslizamiento de tierra.
Tendencia de escape y presión de vapor
La tendencia a escapar se conoce más formalmente como energía libre. Tenga en cuenta también que los cambios de estado siempre implican cambios en la entalpía y en la energía interna. De la misma manera que el té se extiende desde una bolsa de té hacia el espacio más grande del agua en la que se sumerge, las moléculas que están confinadas dentro de una fase (líquida, sólida o gaseosa) tenderán a propagarse (y la energía térmica que llevan consigo) lo más ampliamente posible. Esta ley fundamental de la naturaleza se manifiesta en lo que llamaremos la tendencia de escape de las moléculas de la fase. La tendencia al escape es una cantidad de importancia fundamental para comprender todos los equilibrios y transformaciones químicas. No es necesario definir el término de manera formal en este punto. Lo importante por ahora es cómo podemos observar y comparar las tendencias escapantes.
Piensa primero en un gas: ¿qué propiedad del gas constituye la mejor medida de su tendencia a escapar de un contenedor? No requiere mucha reflección para concluir que cuanto mayor sea la presión del gas, más frecuentemente sus moléculas chocarán con las paredes del contenedor y posiblemente encuentren su camino a través de una abertura hacia el exterior. Así, la presión que encierra un gas es una medida directa de la tendencia de las moléculas a escapar de una fase gaseosa.
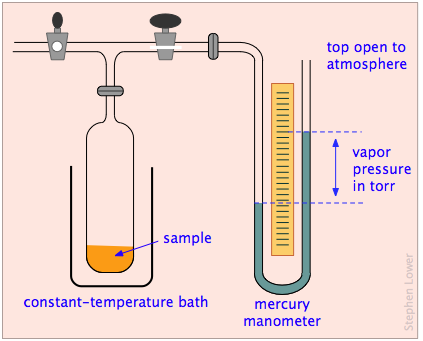
¿Qué pasa con los líquidos y los sólidos? Aunque pensamos en las moléculas de las fases condensadas como permanentemente confinadas dentro de ellas, estas moléculas aún poseen algo de energía térmica, y siempre existe la posibilidad de que una que esté cerca de la superficie ocasionalmente se suelte y escape al espacio fuera del sólido o líquido. Podemos observar la tendencia de las moléculas a escapar a la fase gaseosa de un sólido o líquido colocando la sustancia en un recipiente cerrado y evacuado conectado a un manómetro para medir la presión del gas (Figura\(\PageIndex{2}\)).
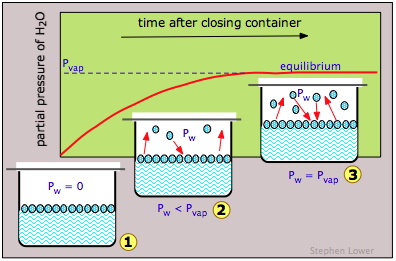
Si hacemos esto para el agua (Figura\(\PageIndex{3}\)), la presión parcial del agua P w en el espacio de vapor será inicialmente cero (1). Poco a poco, P w se elevará a medida que las moléculas escapen de la sustancia y entren en la fase vapor. Pero al mismo tiempo, algunas de las moléculas de vapor “escaparán” de nuevo a la fase líquida (2). Pero debido a que este último proceso es menos favorable (a la temperatura particular aquí representada), P w sigue subiendo. Finalmente se alcanza un equilibrio entre los dos procesos (3), y P w finalmente se estabiliza a un valor fijo P vap que depende de la sustancia y de la temperatura y se conoce como la presión de vapor de equilibrio, o simplemente como la “presión de vapor” del líquido o sólido. La presión de vapor es una medida directa de la tendencia a escapar de las moléculas de un estado condensado de materia.
Tenga en cuenta cuidadosamente que si el recipiente se deja abierto al aire, es poco probable que muchas de las moléculas en la fase de vapor regresen a la fase líquida. Simplemente escaparán de todo el sistema y la presión parcial del vapor de agua P w nunca alcanzará P vap; el líquido simplemente se evaporará sin que se logre ningún tipo de equilibrio.
La tendencia a escapar de las moléculas de una fase siempre aumenta con la temperatura; por lo tanto, la presión de vapor de un líquido o sólido será mayor a temperaturas más altas. Como\(\PageIndex{4}\) muestra la Figura, la variación de la presión de vapor con la temperatura no es lineal.
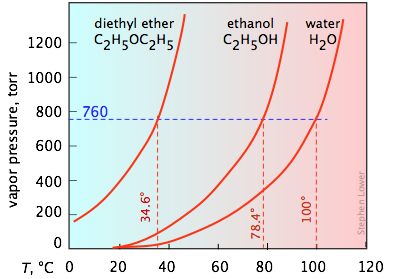
Es importante que seas capaz de interpretar gráficas de presión de vapor como las tres que se muestran aquí. Toma nota especial de cómo se pueden encontrar los puntos de ebullición en estas parcelas. Recordará que el punto de ebullición normal es la temperatura a la que el líquido está en equilibrio con su vapor a una presión parcial de 1 atm (760 torr). Así, las intercepciones de cada curva con la línea azul discontinua de 760 torr indican los puntos de ebullición normales de cada líquido. De igual manera, se pueden estimar fácilmente los puntos de ebullición que estos líquidos tendrían en Denver, Colorado donde la presión atmosférica es de 630 torr simplemente construyendo una línea horizontal correspondiente a esta presión.
El punto de ebullición normal es la temperatura a la que el líquido está en equilibrio con su vapor a una presión parcial de 1 atm. Esto es cuando la presión de vapor está a presión atmosférica.
Presión de vapor del agua
La gran importancia del H 2 O en nuestro mundo merece una mirada más detallada a sus propiedades de presión de vapor. Debido a que la presión de vapor del agua varía mucho en el rango de temperaturas en las que puede existir el líquido (Figura\(\PageIndex{5}\)).
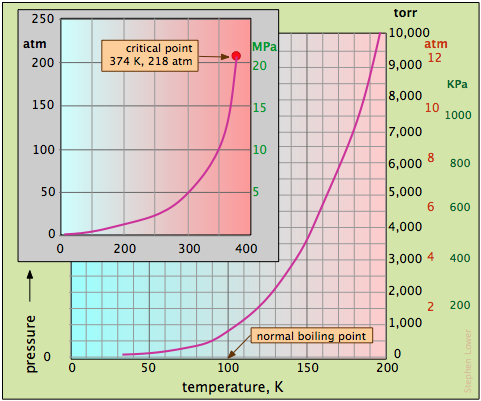
La gráfica más grande en la Figura\(\PageIndex{5}\) cubre las temperaturas más bajas, mientras que el recuadro muestra el rango completo de valores de presión. Tenga en cuenta en particular que
- El punto de ebullición normal es la temperatura a la que la presión de vapor es la misma que la de la atmósfera estándar, 760 torr.
- El punto de ebullición a cualquier otra presión se puede encontrar dejando caer una línea vertical desde la curva hasta el eje de temperatura.
- Como se ve en la gráfica de inserción, la curva de presión de vapor del agua termina en el punto crítico.
Humedad relativa
La presión de vapor del agua a 22°C es de aproximadamente 20 torr, o alrededor de 0.026 atm (2.7 kPa). Esta es la presión parcial de H 2 O que se encontrará en el espacio de vapor dentro de un recipiente cerrado de agua a esta temperatura; se dice que el aire en este espacio está saturado de vapor de agua. El aire húmedo a veces se describe como “pesado”, pero esto es engañoso; la masa molar promedio del aire seco es 29, pero la del agua es de solo 18, por lo que el aire húmedo es en realidad menos denso. La sensación de “pesadez” probablemente se relaciona con la capacidad reducida de la transpiración para evaporarse en el aire húmedo. En el aire ordinario, la presión parcial del vapor de agua es normalmente menor que su valor de saturación o equilibrio. La relación de la presión parcial de H 2 O en el aire a su presión de vapor (equilibrio) a cualquier temperatura dada se conoce como humedad relativa. El agua ingresa a la atmósfera a través de la evaporación del océano y otros cuerpos de agua, y de suelos saturados de agua. El vapor resultante tiende a disiparse y diluirse por la circulación atmosférica, por lo que la humedad relativa rara vez alcanza el 100 por ciento. Cuando lo hace y el clima es cálido, nos sentimos muy incómodos porque se inhibe la vaporización del agua de la piel; si el aire ya está saturado de agua, entonces no hay lugar para que nuestra transpiración vaya, aparte de gotear por nuestro rostro.
Debido a que la presión de vapor aumenta con la temperatura, un paquete de aire que contiene una presión parcial fija de vapor de agua tendrá una humedad relativa mayor a bajas temperaturas que a altas temperaturas. Así, cuando el aire frío ingresa a una casa calentada, su contenido de agua permanece sin cambios pero la humedad relativa baja. En climas con inviernos fríos, esto promueve una mayor pérdida de humedad de las plantas de interior y de las membranas mucosas, lo que lleva al marchitamiento de las primeras e irritación de las segundas.
La presión de vapor del agua es 3.9 torr a —2°C y 20 torr a 22°C. ¿Cuál será la humedad relativa dentro de una casa mantenida a 22°C cuando la temperatura del aire exterior sea —2°C y la humedad relativa sea 70%?
Solución
A 70 por ciento de humedad relativa, la presión parcial del aire —2° es (0.7 × 3.9 torr) = 2.7 torr. Cuando este aire entra a la casa, su humedad relativa será (2.7 torr)/(20 torr) = 0.14 o 14%.
Por la noche, especialmente en noches claras, objetos sólidos (¡incluso telarañas!) perder calor al cielo más rápidamente que el aire. A menudo es importante saber a qué temperatura deben caer tales objetos para que la humedad atmosférica se condense sobre ellos (Figura\(\PageIndex{1}\)). El punto de rocío es la temperatura a la que la humedad relativa es del 100 por ciento, es decir, la temperatura a la que la presión de vapor del agua se vuelve igual a su presión parcial a una temperatura [mayor] y humedad relativa dadas. Para que el agua se condense directamente fuera de la atmósfera como lluvia, el aire debe estar en o por debajo del punto de rocío, pero este no es por sí mismo el único requisito para la formación de lluvia, como veremos en breve.
Presiones de vapor de Hidratos Sólidos
Muchas sales sólidas incorporan moléculas de agua en sus redes cristalinas; los compuestos resultantes se conocen como hidratos. Estos hidratos sólidos poseen presiones de vapor definidas que corresponden a un equilibrio entre los compuestos hidratados y anhidros y el vapor de agua. Por ejemplo, cloruro de estroncio hexahidratado:
\[ \ce{SrCl2 \cdot 6H2O(s) \rightarrow SrCl2(s) + 6H2O(g)} \label{\(\PageIndex{1}\)}\]
La presión de vapor de este hidrato es 8.4 torr a 25°C. Solo a esta presión parcial única de vapor de agua pueden coexistir los dos sólidos a 25°C. Si la presión parcial del agua en el aire es mayor de 8.4 torr, una muestra de SrCl 2 anhidro absorberá la humedad del aire y cambiará a la hidratarse. De hecho, cuando se hidrata completamente, el agua es responsable del 40% de la masa del hidrato.

¿Cuál será la humedad relativa del aire en un recipiente cerrado que contiene SrCl 2 ·6H 2 O sólido a 25°C?
Solución
¿Qué fracción de la presión de vapor del agua a esta temperatura (23.8 torr) es la presión de vapor del hidrato (8.4 torr)? Expresado en porcentaje, esta es la humedad relativa.
Si la presión parcial de H 2 O en el aire es menor que la presión de vapor del hidrato, este último tenderá a perder humedad y volver a su forma anhidra. Este proceso a veces va acompañado de una ruptura del cristal en forma de polvo, un efecto conocido como eflorescencia.
Condensación y ebullición: Nucleación
La evaporación y ebullición de un líquido, y la condensación de un gas (vapor) son partes tan ordinarias de nuestra vida diaria que difícilmente les damos un pensamiento. Cada vez que hervimos agua para hacer una olla de té y ver la nube de vapor sobre la tetera, estamos observando este cambio de fase más común de todos. ¿Cómo podemos entender estos cambios en términos de presión de vapor?
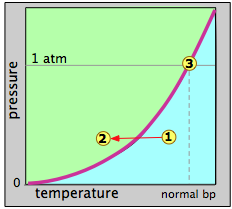
La\(\PageIndex{6}\) figura representa la presión de vapor en función de la temperatura puede representar agua o cualquier otro líquido. Cuando decimos que se trata de una gráfica de vapor-presión, queremos decir que cada punto de la curva representa una combinación de temperatura y presión de vapor a la que pueden coexistir el líquido (verde) y el vapor (azul). Así, en el punto de ebullición normal, definido como la temperatura a la que la presión de vapor es de 1 atm, el estado del sistema corresponde al punto etiquetado 3.
Supongamos que seleccionamos un punto arbitrario 1 a una temperatura y presión a la que sólo el estado gaseoso es estable. Luego disminuimos la temperatura para mover el punto de estado hacia el punto 2 en la región líquida. Cuando el punto de estado cae en la línea de presión de vapor, las dos fases pueden coexistir y esperaríamos que algo de líquido se condense. Una vez que el punto de estado se mueve hacia la izquierda de la línea de presión de vapor, la sustancia estará completamente en fase líquida. Esto es supuestamente lo que sucede cuando se forma “vapor” (en realidad pequeñas gotas de agua) sobre una olla de agua hirviendo.
El proceso inverso debería funcionar de la misma manera: comenzando con una temperatura en la región líquida, no pasa nada hasta llegar a la línea de presión de vapor, momento en el que el líquido comienza a cambiar a vapor. A temperaturas más altas, solo queda el vapor. Esta es la teoría, pero no es completa. El hecho es que un vapor generalmente no se condensa a un líquido en el punto de ebullición (también llamado punto de condensación o punto de rocío), y un líquido generalmente no hervirá en su punto de ebullición.
Burbujas y Gotas
La razón de la discrepancia es que la presión de vapor, como normalmente usamos el término y como lo representa la línea líquido-vapor en el diagrama de fases, se refiere a la presión parcial de vapor en equilibrio con un líquido cuya superficie es razonablemente flat, ya que estaría en un recipiente parcialmente lleno. En una gota de líquido o en una burbuja de vapor dentro de un líquido, la superficie del líquido no es flata, sino curvada. Para gotas o burbujas que son de tamaño razonable, esto no hace mucha diferencia, pero estas gotas y burbujas deben crecer a partir de las más pequeñas, y estas de las más pequeñas aún. Finalmente, uno llega a las gotas y burbujas primordiales que tienen sólo unas pocas dimensiones moleculares, y es aquí donde nos encontramos con un problema: este es el problema de la nucleación —la formación y crecimiento de la primera pequeña gota (en el vapor) o de una burbuja (en un líquido).
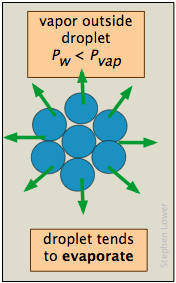
La presión de vapor de un líquido está determinada por las fuerzas de atracción que actúan sobre un ángulo sólido de 180° en la superficie de un líquido. En una gota muy pequeña, la superficie del líquido se curva de tal manera que cada molécula experimenta menos atracciones vecinas más cercanas que en el caso del líquido a granel. Las moléculas más externas del líquido están unidas a la gotita con menos fuerza, y la gota tiene una presión de vapor mayor que la del líquido a granel. Si la presión de vapor de la caída es mayor que la presión parcial de vapor en la fase gaseosa, la caída se evaporará. Por lo tanto, es muy poco probable que alguna vez se forme una gotita dentro de un vapor a medida que se enfría.
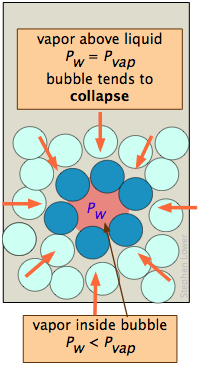
Una burbuja, como una gota, debe comenzar pequeña y crecer más grande, pero aquí hay una difculty que es similar a la que tiene burbujas. Una burbuja es un agujero en un líquido; las moléculas en el límite del líquido están curvadas hacia adentro, de modo que experimentan atracciones vecinas más cercanas sobre un ángulo sólido mayor de 180°. Como consecuencia, la presión de vapor del líquido que mira hacia una burbuja P w es siempre menor que la del líquido a granel P w a la misma temperatura. Cuando el líquido a granel está en su punto de ebullición (es decir, cuando su presión de vapor es de 1 atm), la presión del vapor dentro de la burbuja será inferior a 1 atm, por lo que la burbuja tenderá a colapsar. Además, dado que la burbuja se forma dentro del líquido, la presión hidrostática del líquido superpuesto se sumará a este efecto. Por ambas razones, un líquido no hervirá hasta que la temperatura se eleve ligeramente por encima del punto de ebullición, fenómeno conocido como sobrecalentamiento. Una vez que comience la ebullición, continuará haciéndolo en el punto de ebullición adecuado del líquido.
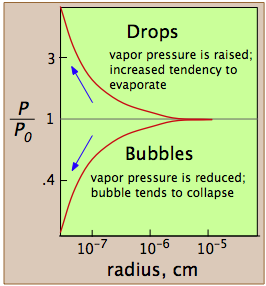
Estas gráficas muestran cómo, en el caso del agua, la presión de vapor de una burbuja o caída muy pequeña varía con su radio de curvatura; la cantidad que se traza es la relación de la presión de vapor real P a P o, la presión de vapor de una superficie plana.
Condensación de líquidos
Si las gotas más pequeñas están destinadas a autodestruirse, ¿por qué los vapores se condensan alguna vez (por ejemplo, por qué llueve)?
- Si enfrías un vapor en un recipiente, la condensación se produce no dentro del vapor en sí, sino en la superficie interna del recipiente. Lo que sucede aquí es que las atracciones intermoleculares entre la superficie sólida harán que las moléculas de vapor se adsorban a la superficie y estabilicen la caída incipiente hasta que crezca a un tamaño en el que pueda ser autosustentable. Este es el origen de la condensación en el exterior de una bebida fría, o del rocío que aparece en la hierba.
- En el caso de la nube de vapor que se ve sobre el agua hirviendo, las primeras gotas se forman en diminutas partículas de polvo en el aire, las que se pueden ver por la luz dispersa cuando un rayo de sol brilla a través de una habitación oscura.
Nubes y precipitaciones En la región de la atmósfera donde se forma la lluvia hay un gran número de partículas sólidas, en su mayoría de tamaño microscópico. Algunas de estas son partículas de sal producidas por evaporación de aspersión de la superficie oceánica. Muchos núcleos de condensación son de origen biológico; estos incluyen bacterias, esporas y partículas de sulfato de amonio. Hay polvo volcánico y de meteoritos, y por supuesto que hay polvo y humo debido a las actividades de los humanos. Estas partículas tienden a adsorber vapor de agua, y algunas incluso pueden disolverse para formar una gotita de solución concentrada. En cualquier caso, la presión de vapor del agua se reduce por debajo de su valor de equilibrio, estabilizando así el agregado hasta que pueda crecer a un tamaño autosostenido y convertirse en niebla, lluvia o nieve.
Esto, por cierto, es por lo que la niebla es un irritante para la nariz y la garganta; cada gotita de niebla lleva dentro de ella una partícula de polvo o (en el aire contaminado por la quema de combustibles fósiles que contienen azufre) una gotita de ácido sulfúrico, que deposita efcientemente en tus sensibles membranas mucosas. Si tienes un auto que se deja afuera en una noche de niebla, es posible que hayas notado lo sucio que está el parabrisas por la mañana.
Supercalentamiento y ebullición de líquidos
¿Cuál es la diferencia entre la evaporación y la ebullición de un líquido? Cuando un líquido se evapora a una temperatura por debajo de su punto de ebullición, las moléculas que entran en la fase de vapor lo hacen directamente desde la superficie. Cuando un líquido hierve, se forman burbujas de vapor en el interior del líquido, y son impulsadas a la superficie por su menor densidad (flotabilidad). A medida que suben, la disminución de la presión hidrostática hace que las burbujas se expandan, reduciendo aún más su densidad (y aumentando su flotabilidad).
Pero como explicamos anteriormente, conseguir que esa primera burbuja se forme y sobreviva suele ser lo suficientemente difícil que los líquidos comúnmente se sobrecalienten antes de que comiencen a hervir. Si has tenido experiencia en un laboratorio de química orgánica, probablemente lo conozcas como “chocar”, y te han enseñado a tomar precauciones contra ello. En grandes cantidades, los líquidos sobrecalentados pueden ser muy peligrosos, ya que la introducción de una impureza (como la liberación de una burbuja de aire de la superficie del contenedor) o incluso una perturbación mecánica puede desencadenar la nucleación y provocar que la ebullición ocurra repentinamente y casi explosivamente (Video\(\PageIndex{1}\)).
Muchas personas se han quemado seriamente después de intentar hervir agua en un horno microondas, o después de haber agregado material en polvo como el café instantáneo a dicha agua. Cuando el agua se calienta en una estufa, el fondo del recipiente sobrecalienta solo la fina capa de agua inmediatamente en contacto con ella, produciendo “microexplosiones” localizadas que se pueden escuchar justo antes de que comience la ebullición suave regular; estas burbujas se dispersan rápidamente y sirven como centros de nucleación para hervir regularmente . En un horno microondas, sin embargo, la energía es absorbida por el agua misma, de manera que toda la mayor parte del agua puede llegar a sobrecalentar. Si esto sucede, la más mínima perturbación puede producir un destello explosivo en vapor.
Sublimación
Algunos sólidos tienen presiones de vapor tan altas que el calentamiento conduce a una cantidad sustancial de vaporización directa incluso antes de que se alcance el punto de fusión. Este es el caso del yodo sólido, por ejemplo. I 2 se funde a 115°C y hierve a 183°C, se sublima fácilmente a temperaturas alrededor de 100°C.Incluso el hielo tiene una presión de vapor medible cerca de su punto de congelación, como lo demuestra la tendencia de la nieve a evaporarse en clima frío y seco. Existen otros sólidos cuya presión de vapor supera a la del líquido antes de que pueda ocurrir la fusión. Tales sustancias subliman sin fundirse; un ejemplo común es el dióxido de carbono sólido (“Hielo Seco”) a 1 atm (ver el diagrama de fases de CO 2 a continuación).
Diagramas de Fase
Las temperaturas y presiones a las que una fase dada de una sustancia es estable (es decir, de donde las moléculas tienen la menor tendencia a escapar) es una propiedad importante de cualquier sustancia. Debido a que tanto la temperatura como la presión son factores, se acostumbra graficar las regiones de estabilidad de las diversas fases en las coordenadas P - T, como en este diagrama de fases genérico para una sustancia hipotética.
Debido a que las presiones y temperaturas pueden variar en rangos muy amplios, es una práctica común dibujar diagramas de fase con coordenadas no lineales o distorsionadas. Esto nos permite expresar mucha información de manera compacta y visualizar cambios que no se pudieron representar en una trama a escala lineal. Es importante que sea capaz de interpretar un diagrama de fases, o alternativamente, construir uno aproximado cuando se le den los datos apropiados. Toma nota especial de los siguientes puntos:
- Las tres regiones coloreadas del diagrama son los rangos de presión y temperatura en los que la fase correspondiente es la única estable.
- Las tres líneas que unían estas regiones definen todos los valores de (P, T) en los que pueden coexistir dos fases (es decir, estar en equilibrio). Observe que una de estas líneas es la curva de presión de vapor del líquido como se describió anteriormente. La "curva de sublimación" es solo una curva de presión de vapor del sólido. La pendiente de la línea depende de la diferencia de densidad de las dos fases.
- Con el fin de representar las características importantes de un diagrama de fases en el amplio rango de presiones y temperaturas que abarca, los ejes no suelen estar dibujados a escala, y generalmente están altamente distorsionados. Esta es la razón por la que la “curva de fusión” parece una línea recta en la mayoría de estos diagramas.
- Donde las tres curvas nombradas se cruzan, las tres fases pueden coexistir. Esta condición sólo puede ocurrir a un valor único de (P, T) conocido como el punto triple. Dado que las tres fases están en equilibrio en el punto triple, sus presiones de vapor serán idénticas a esta temperatura.
- La línea que separa las regiones de líquido y vapor termina en el punto crítico. A temperaturas y presiones mayores que la temperatura y presión críticas, no existe una fase líquida separada. Nos referimos a este estado simplemente como un fluido, aunque también se usa comúnmente el término líquido supercrítico.
La mejor manera de asegurarte de entender un diagrama de fases es imaginar que estás comenzando a cierta temperatura y presión, y luego cambiar solo uno de estos parámetros, manteniendo el otro constante. Estarás atravesando una ruta horizontal o vertical en el diagrama de fases, y habrá un cambio de estado cada vez que tu camino cruce una línea. De especial importancia es la trayectoria horizontal (mostrada por la línea azul en el diagrama anterior) correspondiente a una presión de 1 atmósfera; esta línea define las temperaturas normales de fusión y ebullición de una sustancia.
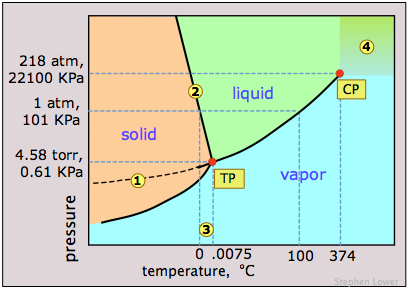
Observe las siguientes características para el diagrama de fases del agua (Figura\(\PageIndex{11}\)):
- La pendiente de la línea 2 que separa las regiones sólida y líquida es negativa; esto refleja la propiedad inusual de que la densidad del líquido es mayor que la del sólido, y significa que el punto de fusión del hielo disminuye a medida que aumenta la presión. Así, si el hielo a 0°C se somete a una alta presión, se encontrará por encima de su punto de fusión y se derretirá. (Contrariamente a lo que a veces se dice, sin embargo, esta no es la razón por la que el hielo se derrita bajo la presión de los patines o esquís de hielo, proporcionando una película lubricante que hace que estos modos de transporte sean tan agradables. La fusión en estos casos surge del calentamiento por fricción).
- La línea discontinua 1 es la extensión de la línea de presión de vapor líquido por debajo del punto de congelación. Esto representa la presión de vapor del agua superenfriada, un estado metaestable de agua que puede existir temporalmente hasta aproximadamente —20°C. (Si vives en una región sujeta a “lluvia helada”, ¡habrás encontrado agua superenfriada!)
- 3 El punto triple (TP) del agua está apenas 0.0075° por encima del punto de congelación; solo a esta temperatura y presión pueden coexistir indefinidamente las tres fases del agua.
- 4 Por encima de la temperatura del punto crítico (CP) de 374°C, no existe ninguna fase líquida separada del agua.
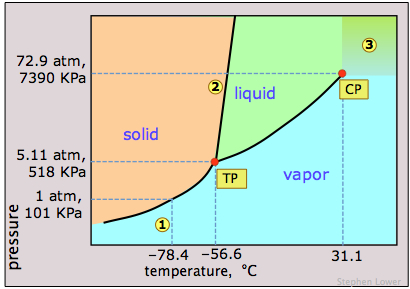
El hielo seco, dióxido de carbono sólido, es ampliamente utilizado como refrigerante y el diagrama de fases en la Figura\(\PageIndex{12}\) muestra por qué es “seco”. La presión de triple punto está en 5.11 atm, por lo que por debajo de esta presión, el CO 2 líquido no puede existir; el sólido solo puede sublimarse directamente a vapor. El dióxido de carbono gaseoso a una presión parcial de 1 atm está en equilibrio con el sólido a 195K (−79 °C, 1); esta es la temperatura normal de sublimación del dióxido de carbono. La temperatura superficial del hielo seco será ligeramente inferior a esta, ya que la presión parcial del CO 2 en contacto con el sólido será por lo general inferior a 1 atm. Observe también que la temperatura crítica del CO 2 es de solo 31°C, lo que significa que en un día muy cálido, el CO 2 en un extintor se vaporizará completamente; por lo tanto, el recipiente debe ser lo suficientemente fuerte como para soportar una presión de 73 atm.
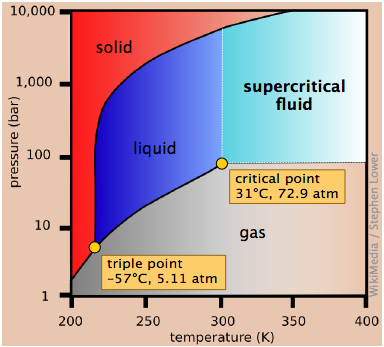
Esta visión del diagrama de fases del dióxido de carbono emplea una escala de presión logarítmica y, por lo tanto, abarca un rango mucho más amplio de presiones, revelando el límite superior de la fase fluida (líquida y supercrítica). El dióxido de carbono supercrítico (CO 2 por encima de su temperatura crítica) posee las propiedades solventes de un líquido y las propiedades penetrantes de un gas; un uso principal es eliminar la cafeína de los granos de café.
El yodo elemental, I 2, forma cristales de color gris oscuro que tienen una apariencia casi metálica. A menudo se usa en clases de química como ejemplo de un sólido que se sublima fácilmente; si ha visto una demostración de este tipo o ha experimentado con ella en el laboratorio, su diagrama de fases podría ser de interés.
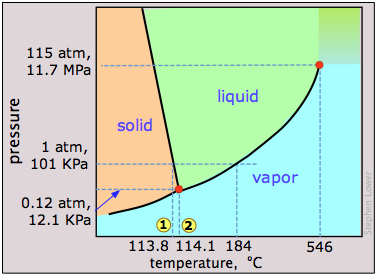
La característica más notable del comportamiento de la fase del yodo es la pequeña diferencia (menor de un grado) entre las temperaturas de su punto triple 1 y punto de fusión 2. Contrariamente a la impresión que muchas personas tienen, no hay nada realmente especial en la tendencia del yodo a sublimarse, que es compartida por muchos cristales moleculares incluyendo hielo y naftaleno (“bolas de polilla”). La presión de vapor del yodo a temperatura ambiente es realmente bastante pequeña — solo alrededor de 0.3 torr (40 Pa) .El hecho de que el yodo sólido tenga un fuerte olor y esté rodeado por un vapor púrpura en un recipiente cerrado es principalmente consecuencia de su fuerte capacidad para absorber la luz verde (esto deja azul y rojo que hacen púrpura) y la alta sensibilidad de nuestras narices a su vapor.
Diagrama de fases de azufre
El azufre exhibe un comportamiento de fase muy complicado que ha desconcertado a los químicos durante más de un siglo; lo que ve aquí es el diagrama de fases muy simplificado que se muestra en la mayoría de los libros de texto. La dificultad surge de la tendencia de las moléculas S 8 a romperse en cadenas (especialmente en el líquido por encima de 159°C) o a reorganizarse en anillos de varios tamaños (S 6 a S 20). Incluso el vapor puede contener una mezcla de especies S 2 a S 10.
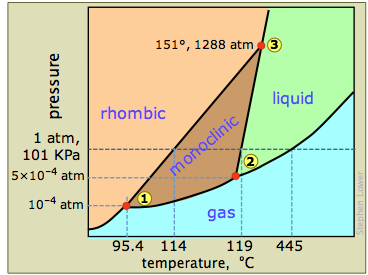
El diagrama de fases del azufre contiene una nueva característica: hay dos fases sólidas, rómbica y monoclínica. Los nombres se refieren a las estructuras cristalinas en las que se disponen las moléculas S 8. Esto da lugar a tres puntos triples, indicados por los números en el diagrama.
Del diagrama de fases en la Figura\(\PageIndex{14}\) identify one example of three phases that never coexist in s ulfur (\(S_8\)(indicio hay varias respuestas correctas)?
Cuando el azufre rómbico (la fase estable de baja temperatura) se calienta lentamente, cambia a la forma monoclínica a 114°C, que luego se funde a 119°. Pero si la forma monoclínica se calienta rápidamente las moléculas no tienen tiempo para reorganizarse, por lo que la disposición rómbica persiste como una fase metaestable hasta que se funde a 119-120°. La formación de más de una fase sólida no es infrecuente —de hecho, si uno explora las presiones muy altas (ver más abajo), parece ser la regla.
Extremos Presión y Temperaturas
Tendemos a pensar en las propiedades de las sustancias tal como existen bajo las condiciones que encontramos en la vida cotidiana, olvidando que la mayor parte de la materia que conforma nuestro mundo está situada dentro de la Tierra, donde las presiones son órdenes de magnitud mayores (Figura\(\PageIndex{15}\)). Los geoquímicos y científicos planetarios necesitan conocer el comportamiento de fase de las sustancias a altas temperaturas y presiones para desarrollar modelos útiles para probar sus teorías sobre la estructura y evolución de la Tierra y del sistema solar.
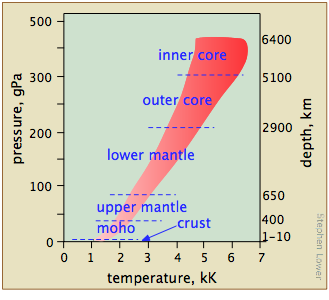
¿Qué rangos de temperaturas y presiones pueden ser de interés y, lo que es más importante, son accesibles experimentalmente?
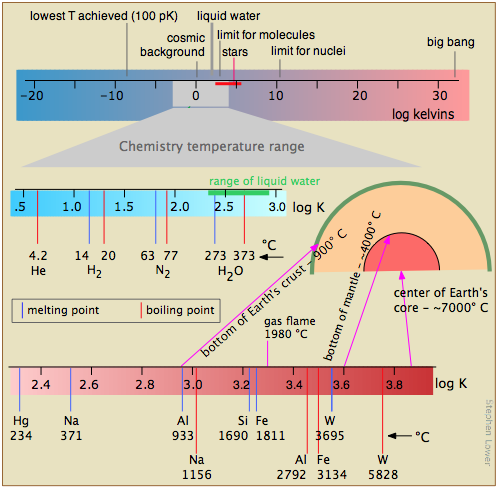
La figura\(\PageIndex{16}\) muestra varias escalas (todas las cuales, tenga en cuenta, son logarítmicas) que cubren respectivamente el rango de temperatura para el universo; las bajas temperaturas de importancia para la química (nótese la línea verde que indica las temperaturas a las que puede existir el agua líquida); las temperaturas más altas, mostrando los puntos de fusión y ebullición de varios elementos para referencia. Las temperaturas más altas que se pueden producir en el laboratorio se logran (pero sólo por intervalos de tiempo muy cortos) mediante pulsos de luz de radiación láser o sincrotrón.
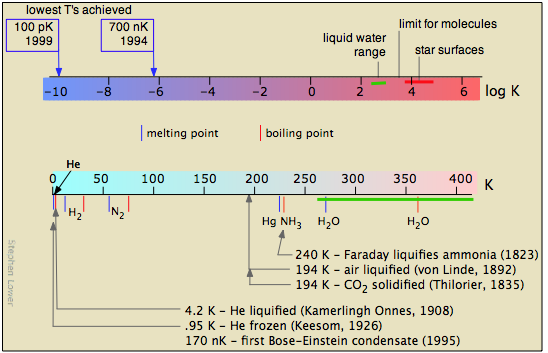
El estudio de las bajas temperaturas está limitado por las leyes de la física que prohíben alcanzar el cero absoluto. Pero el hecho de que no haya límite a lo cerca que uno puede acercarse a 0 K ha fomentado una gran cantidad de experimentación creativa.
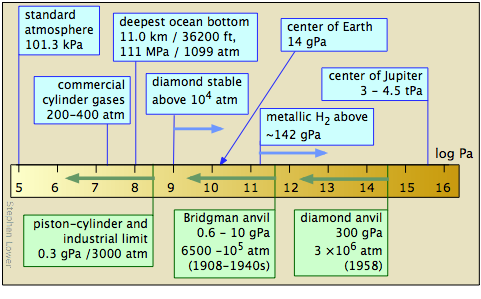
El estudio de la materia a altas presiones no es una tarea fácil. Las técnicas generales fueron pioneras entre 1908-1960 por P.W. Bridgeman de la Universidad de Harvard, cuya obra le valió el Premio Nobel de Física en 1946. El desarrollo más reciente de la celda de yunque de diamante ha ampliado enormemente el rango de presiones alcanzables y los tipos de observaciones que se pueden hacer. Las técnicas de onda de choque han hecho posible la producción de presiones de corta duración en el rango de tPA.
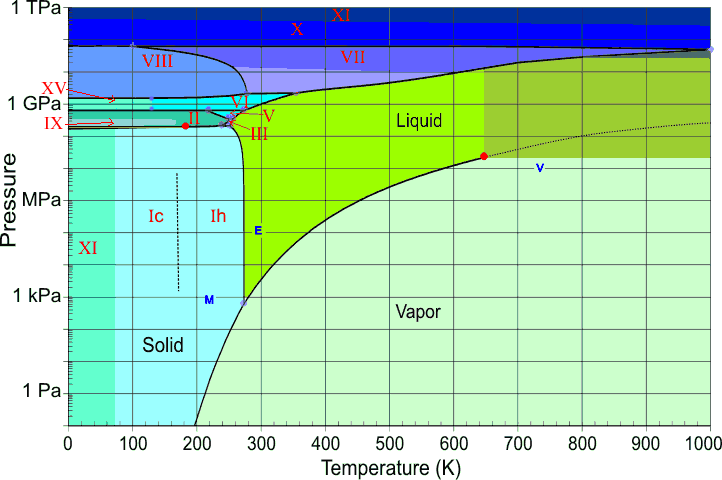
Estudios de laboratorio de alta presión han revelado que muchas sustancias moleculares como el hidrógeno y el agua cambian a fases sólidas con puntos de fusión muy por encima de la temperatura ambiente a presiones muy altas; existe una forma sólida de hielo que permanece congelada incluso a 100°C. A presiones aún más altas, muchas de estas las sustancias se convierten en metales. Se cree que gran parte de la porción interna de los planetas más grandes consiste en hidrógeno metálico —y, de hecho, que todas las sustancias pueden llegar a ser metálicas a presiones suficientemente altas.
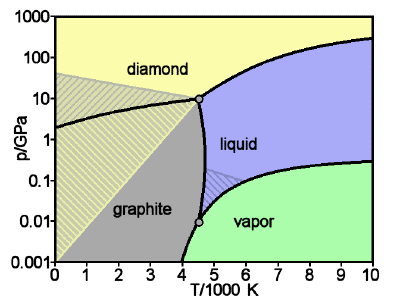
Figura\(\PageIndex{19}\): Diagrama de fases de carbono: diamante y grafito
El grafito es la forma estable de carbono sólido a bajas presiones; el diamante solo es estable por encima de aproximadamente 10 4 atm. Pero una vez que está en esta forma, la velocidad a la que el diamante se convierte de nuevo en grafito es inconmensurablemente lenta en condiciones ambientales ordinarias; simplemente no hay suficiente energía térmica disponible para romper todos esos enlaces carbono-carbono. Por lo que se dice que los diamantes que admiramos en joyas y por los que pagamos caro son metaestables. [imagen: WikiMedia]
Diamantes Sintéticos
Para transformar grafito en diamante a una velocidad razonable, se requeriría una presión de 200,000 atm y una temperatura de aproximadamente 4000 K. Dado que ningún aparato puede sobrevivir a estas condiciones, el proceso, conocido como síntesis a alta presión a alta temperatura (HPHT) se lleva a cabo comercialmente a 70.000 atm. y 2300 K en una solución de níquel fundido, que también actúa como catalizador. Los rastros de Ni en el producto terminado sirven para distinguir los diamantes sintéticos de los naturales. Sin embargo, la mayoría de los diamantes sintéticos son demasiado pequeños (solo unos pocos milímetros) y demasiado defectuosos para la calidad de las gemas, y se utilizan principalmente para fabricar herramientas industriales de molienda y corte.
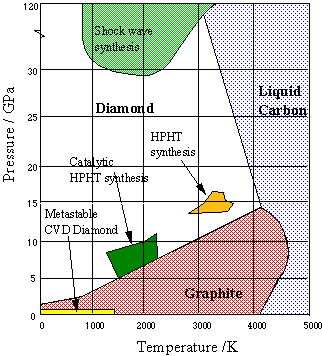
Figura\(\PageIndex{20}\): Diagrama de fases de carbono: diamante y grafito
Más recientemente, las películas delgadas de diamante se han vuelto importantes para aplicaciones de ingeniería y fabricación de semiconductores. Estos se hacen más comúnmente por condensación de carbono gaseoso sobre un sustrato adecuado (deposición química de vapor, CVD). Las condiciones bajo las cuales se hacen los diamantes sintéticos se representan en el diagrama de fases anterior de la Universidad de Bristol.
Video\(\PageIndex{2}\): El químico Roy Gat explica cómo utiliza diagramas de fases para sintetizar diamantes sintéticos a baja presión y temperaturas.
Raridez de fase de helio
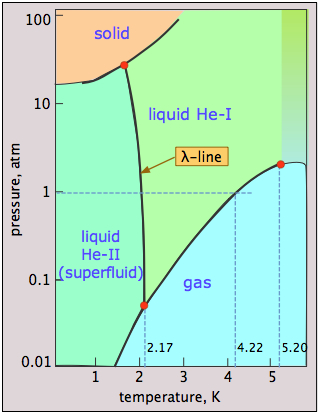
El helio es único en que los fenómenos cuánticos, que normalmente se aplican solo a objetos diminutos como átomos y electrones, se extienden y dominan sus propiedades macroscópicas. Un vistazo al diagrama de fases de\(\ce{^4He}\) revela algo de esta rareza cuántica. Los principales puntos a tener en cuenta son:
- El helio se puede congelar solo a altas presiones;
- El sólido y el gas no pueden coexistir (estar en equilibrio) bajo ninguna condición;
- Hay dos fases líquidas, helio I (un líquido ordinario) y helio II (un líquido ordenado altamente inusual);
- La línea λ (lambda) representa los valores (P, T) en los que las dos fases pueden coexistir;
- Helio-II se comporta como un superfluido, esencialmente un líquido cuántico.
¿Por qué el helio líquido no puede congelarse a bajas presiones? La baja masa de los átomos de He y su confinamiento cercano en el sólido les proporciona una energía de punto cero muy alta (¡el principio de incertidumbre de Heisenberg en acción!) que les permite vibrar con tal amplitud que superan las fuerzas de dispersión que de otro modo mantendrían unido al sólido, manteniendo así los átomos demasiado separados para formar un sólido. Sólo aplicando una alta presión (25 atm) se puede superar este efecto.
Helio-II, líquidos cuánticos y superfluidez
Por lo general, necesitamos la teoría cuántica solo para describir las propiedades de objetos diminutos como los electrones, pero con He-II líquido, se extiende a la escala macroscópica del líquido a granel. \(\ce{^4He}\)los átomos (99.99+ por ciento del helio natural) son bosones, lo que significa que a bajas temperaturas, todos pueden ocupar el mismo estado cuántico (todos los demás átomos normales son fermiones y están sujetos al principio de exclusión de Pauli).
Todos juntos, ahora
Todos los objetos que ocupan el mismo estado cuántico poseen el mismo impulso. Así, cuando un átomo se mueve, todos se mueven juntos. En cierto sentido, esto significa que todo el grueso del líquido He-II actúa como una sola entidad. Esta propiedad, conocida como superfluidez, da lugar a una serie de efectos notables, entre los que destacan:
- El líquido puede fluir a través de un canal estrecho sin fricción, hasta una velocidad crítica que depende de la relación entre el caudal y el ancho del canal;
- Cuando se colocan en un contenedor, forman una película que sube por las paredes y baja por el exterior, buscando el mismo nivel fuera del contenedor que dentro si esto es posible;
- Una pequeña molécula disuelta en Helio-II se comporta igual que lo haría en el vacío.
En Helio-II líquido, sólo alrededor del 10% de los átomos están en tal estado, pero es suficiente para darle al líquido algunas de las extrañas propiedades de un líquido cuántico.
El 3 exhibe propiedades similares, pero debido a su baja abundancia natural, no fue ampliamente estudiada hasta la década de 1940 cuando grandes cantidades estuvieron disponibles como subproducto de la fabricación de armas nucleares. Finalmente, en 1996 se observó su superfluidez a una temperatura de 2 nK. Si bien los átomos de He 3 son fermiones, sólo aquellos que se emparejan (y asumen así las propiedades de los bosones) dan lugar a la superfluidez.
Agua a altas presiones
El agua, como la mayoría de las otras sustancias, exhibe muchas formas sólidas a presiones más altas (Figura\(\PageIndex{22}\)). Hasta el momento, se han identificado quince fases distintas de hielo; estas se designan con números romanos Ice-I a Ice-XV. Ice-I puede existir en dos modificaciones; la red cristalina de Ice-ic es cúbica, mientras que la de hielo-lh es hexagonal. Este último corresponde al hielo ordinario que todos conocemos. Es interesante señalar que varias fases de hielo de alta presión pueden existir a temperaturas superiores a 100°C.