7.3: Enlace de hidrógeno y agua
- Page ID
- 70754
- Identificar tres propiedades especiales del agua que la hacen inusual para una molécula de su tamaño, y explicar cómo estas resultan de los enlaces de hidrógeno.
- Explique qué se entiende por enlaces de hidrógeno y las características estructurales moleculares que lo provocan.
- Describir la “estructura”, tal como es, del agua líquida.
- Esbozar ejemplos estructurales de enlaces de hidrógeno en tres moléculas pequeñas distintas de H 2 O.
- Describir los papeles de los enlaces de hidrógeno en las proteínas y en el ADN.
La mayoría de los estudiantes de química aprenden rápidamente a relacionar la estructura de una molécula con sus propiedades generales. Por lo tanto, generalmente esperamos que moléculas pequeñas formen gases o líquidos, y que las grandes existan como sólidos en condiciones ordinarias. Y luego llegamos a H 2 O, y nos sorprende descubrir que muchas de las predicciones están muy lejos, y que el agua (y por implicación, la vida misma) ¡ni siquiera debería existir en nuestro planeta! En esta sección aprenderemos por qué esta pequeña combinación de tres núcleos y diez electrones posee propiedades especiales que la hacen única entre las más de 15 millones de especies químicas que conocemos actualmente.
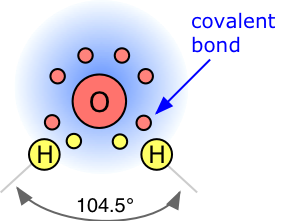
En el agua, cada núcleo de hidrógeno está unido covalentemente al átomo de oxígeno central por un par de electrones que se comparten entre ellos. En H 2 O, solo se utilizan dos de los seis electrones de oxígeno de capa externa para este propósito, dejando cuatro electrones los cuales están organizados en dos pares no enlazantes. Los cuatro pares de electrones que rodean el oxígeno tienden a organizarse lo más lejos posible entre sí para minimizar las repulsiones entre estas nubes de carga negativa. Esto normalmente daría como resultado una geometría tetraédrica en la que el ángulo entre pares de electrones (y por lo tanto el ángulo de enlace H-O-H) es de 109.5°. Sin embargo, debido a que los dos pares no enlazantes permanecen más cerca del átomo de oxígeno, estos ejercen una repulsión más fuerte contra los dos pares de enlaces covalentes, empujando efectivamente los dos átomos de hidrógeno más cerca entre sí. El resultado es una disposición tetraédrica distorsionada en la que el ángulo H-O-H es 104.5°.
El gran momento dipolo del agua conduce a la unión de hidrógeno
La molécula H 2 O es eléctricamente neutra, pero las cargas positivas y negativas no se distribuyen uniformemente. Esto se ilustra por la gradación en color en el diagrama esquemático aquí. La carga electrónica (negativa) se concentra en el extremo de oxígeno de la molécula, debido en parte a los electrones no enlazados (círculos azules sólidos) y a la alta carga nuclear del oxígeno que ejerce una atracción más fuerte sobre los electrones. Este desplazamiento de carga constituye un dipolo eléctrico, representado por la flecha en la parte inferior; se puede pensar en este dipolo como la “imagen” eléctrica de una molécula de agua.
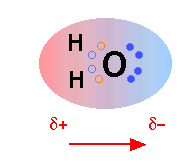
Las cargas opuestas se atraen, por lo que no es sorprendente que el extremo negativo de una molécula de agua tenderá a orientarse para estar cerca del extremo positivo de otra molécula que pasa a estar cerca. La fuerza de esta atracción dipolo-dipolo es menor que la de un enlace químico normal, por lo que está completamente abrumada por movimientos térmicos ordinarios en la fase gaseosa. Sin embargo, cuando las moléculas de H 2 O se agrupan en el líquido, estas fuerzas atractivas ejercen un efecto muy notable, al que llamamos (algo engañosamente) enlaces de hidrógeno. Y a temperaturas lo suficientemente bajas como para apagar los efectos disruptivos de los movimientos térmicos, el agua se congela en hielo en el que los enlaces de hidrógeno forman una red rígida y estable.
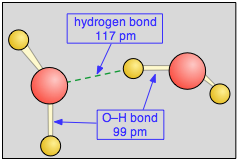
Observe que el enlace de hidrógeno (mostrado por la línea verde discontinua) es algo más largo que el enlace covalente O-H. También es mucho más débil, cerca de 23 kJ mol —1 en comparación con la fuerza de enlace covalente O-H de 492 kJ mol —1.
Cuarenta y una anomalías del agua” — algunas de ellas bastante esotéricas.
Desde hace tiempo se sabe que el agua exhibe muchas propiedades físicas que la distinguen de otras moléculas pequeñas de masa comparable. Aunque los químicos se refieren a estas como las propiedades “anómalas” del agua, de ninguna manera son misteriosas; todas son consecuencias completamente predecibles de la forma en que el tamaño y la carga nuclear del átomo de oxígeno conspiran para distorsionar las nubes de carga electrónica de los átomos de otros elementos cuando estos son químicamente unido al oxígeno.

Punto de ebullición
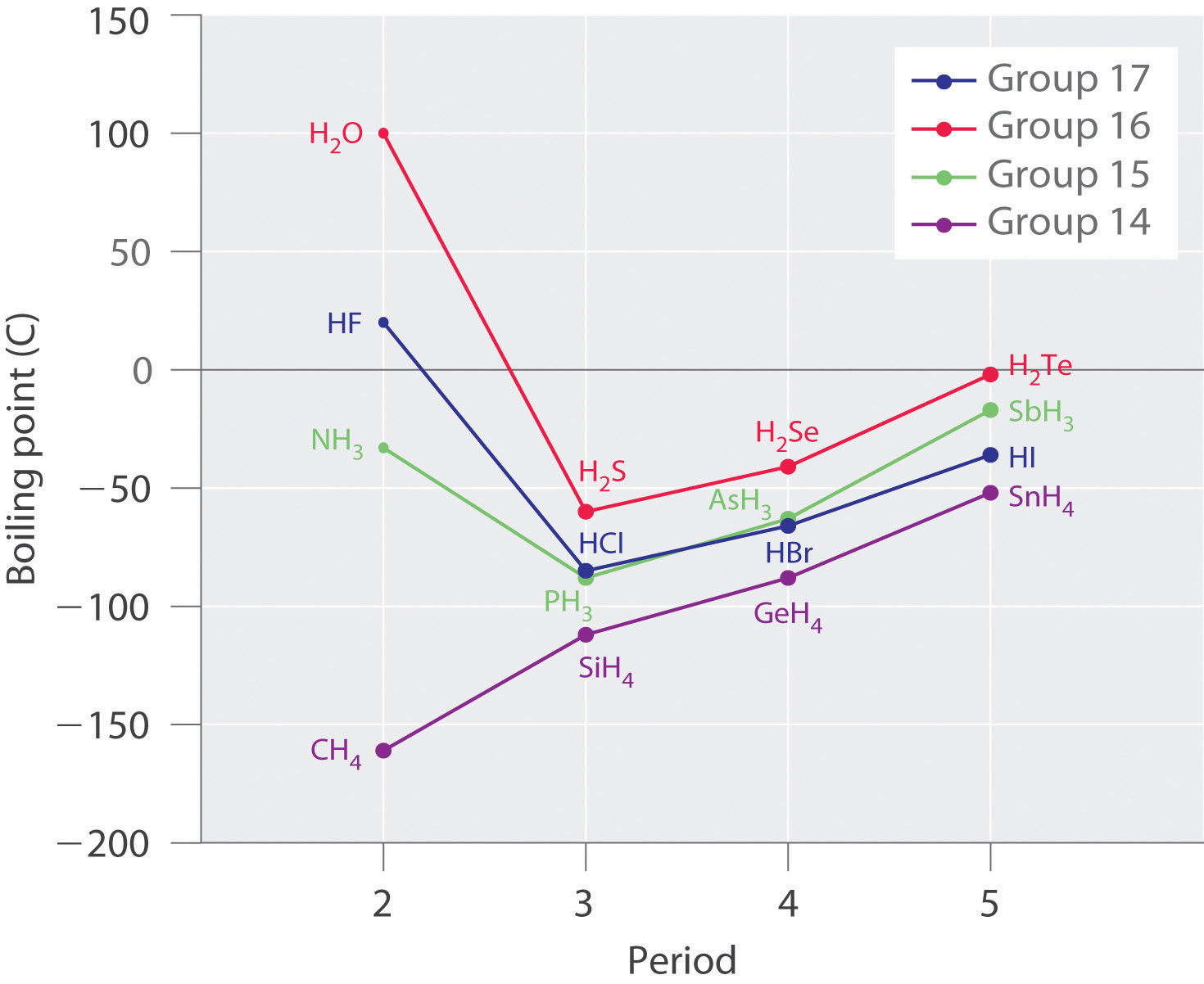
La peculiaridad más aparente del agua es su punto de ebullición muy alto para una molécula tan ligera. El metano líquido CH 4 (peso molecular 16) hierve a —161°C Como se puede ver en este diagrama, la extrapolación de los puntos de ebullición de los diversos compuestos de hidrógeno del Grupo 16 a H 2 O sugiere que esta sustancia debe ser un gas en condiciones normales.
Tensión superficial
En comparación con la mayoría de los otros líquidos, el agua también tiene una alta tensión superficial. ¿Alguna vez has visto a un insecto caminar por la superficie de un estanque? El estrider de agua aprovecha que la superficie del agua actúa como una película elástica que resiste la deformación cuando se le coloca un pequeño peso. (Si tiene cuidado, también puede “flotar” un pequeño clip o grapa de acero en la superficie del agua en una taza). Todo esto se debe a la tensión superficial del agua. Una molécula dentro del grueso de un líquido experimenta atracciones a las moléculas vecinas en todas las direcciones, pero como estas promedian a cero, no hay fuerza neta sobre la molécula. Para una molécula que se encuentra en la superficie, la situación es bastante diferente; experimenta fuerzas solo de lado y hacia abajo, y esto es lo que crea el efecto de membrana estirada.

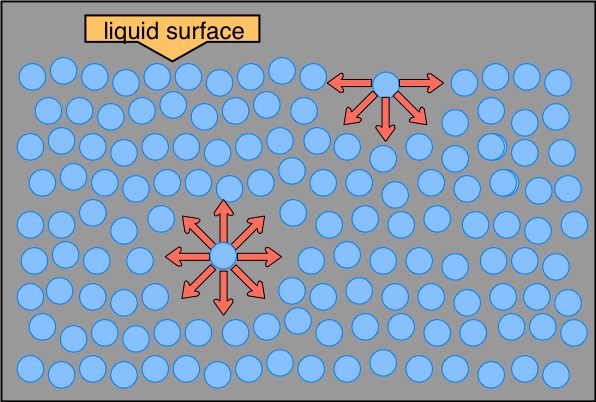
La distinción entre moléculas localizadas en la superficie y las profundas en el interior es especialmente prominente en H 2 O, debido a las fuertes fuerzas de enlace de hidrógeno. La diferencia entre las fuerzas experimentadas por una molécula en la superficie y una en el líquido a granel da lugar a la tensión superficial del líquido. Este dibujo resalta dos moléculas de H 2 O, una en la superficie y la otra en la masa del líquido. La molécula de superficie es atraída por sus vecinos debajo y hacia ambos lados, pero no hay atracciones que apunten en el ángulo sólido de 180° sobre la superficie. Como consecuencia, una molécula en la superficie tenderá a ser arrastrada hacia el grueso del líquido. Pero como siempre debe haber alguna superficie, el efecto general es minimizar la superficie de un líquido.
La forma geométrica que tiene la menor relación entre área superficial y volumen es la esfera, por lo que cantidades muy pequeñas de líquidos tienden a formar gotas esféricas. A medida que las gotas se hacen más grandes, su peso las deforma en la típica forma de lágrima.

El hielo flota en el agua
La configuración energéticamente más favorable de las moléculas H 2 O es aquella en la que cada molécula está unida por hidrógeno a cuatro moléculas vecinas. Debido a los movimientos térmicos descritos anteriormente, este ideal nunca se logra en el líquido, pero cuando el agua se congela en hielo, las moléculas se asientan exactamente en este tipo de disposición en el cristal de hielo. Esta disposición requiere que las moléculas estén algo más separadas de lo que de otro modo sería el caso; como consecuencia, el hielo, en el que los enlaces de hidrógeno están en su máximo, tiene una estructura más abierta, y por lo tanto una densidad menor que el agua.
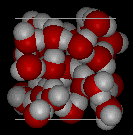
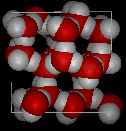
Aquí hay vistas tridimensionales de una estructura local típica de agua (izquierda) y hielo (derecha). Observe la mayor apertura de la estructura de hielo que es necesaria para asegurar el grado más fuerte de enlaces de hidrógeno en una red cristalina uniforme y extendida. La disposición más concurrida y desordenada en el agua líquida solo puede sostenerse por la mayor cantidad de energía térmica disponible por encima del punto de congelación.
Cuando el hielo se derrite, el movimiento térmico más vigoroso interrumpe gran parte de la estructura unida a hidrógeno, permitiendo que las moléculas se empaqueten más estrechamente. El agua es así una de las pocas sustancias cuya forma sólida tiene una densidad menor que el líquido en el punto de congelación. Sin embargo, los grupos localizados de enlaces de hidrógeno aún permanecen; estos se rompen y reforman continuamente a medida que los movimientos térmicos se agitan y empujan las moléculas individuales. A medida que la temperatura del agua se eleva por encima del punto de congelación, la extensión y la vida útil de estos racimos disminuyen, por lo que la densidad del agua aumenta.
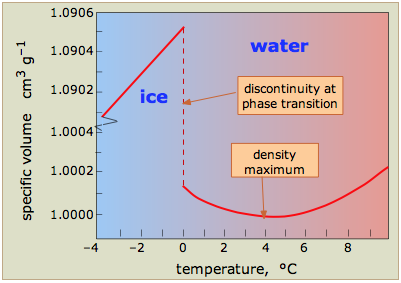
A temperaturas más altas, comienza a dominar otro efecto, común a todas las sustancias: a medida que aumenta la temperatura, también lo hace la amplitud de los movimientos térmicos. Este empujón más vigoroso hace que la distancia promedio entre las moléculas aumente, reduciendo la densidad del líquido; esto es expansión térmica ordinaria.
Debido a que los dos efectos competidores (enlaces de hidrógeno a bajas temperaturas y expansión térmica a temperaturas más altas) conducen ambos a una disminución de la densidad, se deduce que debe haber alguna temperatura a la que la densidad del agua pase por un máximo. Esta temperatura es de 4° C; esta es la temperatura del agua que encontrarás en el fondo de un lago cubierto de hielo en el que esta más densa de todas las aguas ha desplazado al agua más fría y la ha empujado más cerca de la superficie.
Estructura del Agua Líquida
La naturaleza del agua líquida y cómo se organizan e interactúan las moléculas H 2 O dentro de ella son preguntas que han atraído el interés de los químicos durante muchos años. Probablemente no haya líquido que haya recibido un estudio más intensivo, y ahora hay una enorme literatura sobre este tema. Los siguientes hechos están bien establecidos:
- Las moléculas H 2 O se atraen entre sí a través del tipo especial de interacción dipolo-dipolo conocido como enlace de hidrógeno
- un cúmulo unido a hidrógeno en el que se ubican cuatro H 2 Os en las esquinas de un tetraedro imaginario es una configuración especialmente favorable (energía de bajo potencial), pero...
- las moléculas experimentan movimientos térmicos rápidos en una escala de tiempo de picosegundos (10 —12 segundos), por lo que la vida útil de cualquier configuración agrupada específica será fugaz breve.
Una variedad de técnicas que incluyen absorción infrarroja, dispersión de neutrones y resonancia magnética nuclear se han utilizado para sondear la estructura microscópica del agua. La información obtenida de estos experimentos y de cálculos teóricos ha llevado al desarrollo de alrededor de veinte “modelos” que intentan explicar la estructura y el comportamiento del agua. Más recientemente, se han empleado simulaciones por computadora de diversos tipos para explorar qué tan bien estos modelos son capaces de predecir las propiedades físicas observadas del agua.
Este trabajo ha llevado a un refinamiento gradual de nuestras visiones sobre la estructura del agua líquida, pero no ha producido ninguna respuesta definitiva. Hay varias razones para ello, pero la principal es que el concepto mismo de “estructura” (y de “racimos” de agua) depende tanto del marco temporal como del volumen que se considere. Así, siguen abiertas las preguntas de las siguientes clases:
- ¿Cómo se distinguen los miembros de un “cúmulo” de las moléculas adyacentes que no están en ese cúmulo?
- Dado que los enlaces de hidrógeno individuales se rompen y se reforman continuamente en una escala de tiempo de picosegundos, ¿los racimos de agua tienen alguna existencia significativa durante períodos de tiempo más largos? En otras palabras, los conglomerados son transitorios, mientras que la “estructura” implica un arreglo molecular que es más duradero. ¿Podemos entonces usar legítimamente el término “racimos” para describir la estructura del agua?
- Las posibles ubicaciones de las moléculas vecinas alrededor de un H 2 O dado están limitadas por consideraciones energéticas y geométricas, dando lugar así a una cierta cantidad de “estructura” dentro de cualquier elemento de pequeño volumen. No está claro, sin embargo, en qué medida estas estructuras interactúan a medida que se amplía el tamaño del elemento de volumen. Y como se mencionó anteriormente, ¿en qué medida se mantienen estas estructuras por periodos superiores a unos pocos picosegundos?
En la década de 1950 se asumió que el agua líquida consiste en una mezcla de racimos unidos a hidrógeno (H 2 O) n en los que n puede tener una variedad de valores, pero nunca se encontró poca evidencia de la existencia de tales agregados. La presente visión, apoyada por el modelado por computadora y la espectroscopia, es que en una escala de tiempo muy corta, el agua es más como un “gel” que consiste en un solo grupo enorme unido a hidrógeno. En una escala de tiempo de 10 —12 -10 —9 segundos, las rotaciones y otros movimientos térmicos hacen que los enlaces de hidrógeno individuales se rompan y se vuelvan a formar en nuevas configuraciones, induciendo discontinuidades locales siempre cambiantes cuya extensión e influencia depende de la temperatura y la presión.
Hielo
El hielo, como todos los sólidos, tiene una estructura bien definida; cada molécula de agua está rodeada por cuatro H 2 Os. vecinos, dos de estos están unidos por hidrógeno al átomo de oxígeno en la molécula central de H 2 O, y cada uno de los dos átomos de hidrógeno está unido de manera similar a otro H vecino 2 O.
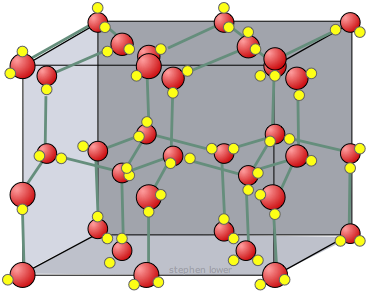
El hielo forma cristales que tienen una estructura reticular hexagonal, que en su pleno desarrollo tenderían a formar prismas hexagonales muy similares a los que a veces se ven en el cuarzo. Esto sucede ocasionalmente, y cualquiera que haya hecho mucho montañismo invernal probablemente haya visto prismas en forma de aguja de cristales de hielo flotando en el aire. En la mayoría de las condiciones, sin embargo, los cristales de copo de nieve que vemos se aplanan en las hermosas estructuras hexagonales similares a fractales que se observan comúnmente.
Copos de nieve
Las moléculas H 2 O que componen las caras planas superior e inferior del prisma están empaquetadas muy estrechamente y unidas (a través de enlaces de hidrógeno) a las moléculas del interior. En contraste con esto, las moléculas que componen los lados del prisma, y especialmente las de las esquinas hexagonales, están mucho más expuestas, de manera que las moléculas atmosféricas de H 2 O que entran en contacto con la mayoría de los lugares de la superficie del cristal se adhieren muy flojamente y migran a lo largo de él hasta que puedan para formar uniones unidas por hidrógeno a estas esquinas, convirtiéndose así en parte del sólido y extendiendo la estructura a lo largo de estas seis direcciones. Este proceso se perpetúa a medida que las nuevas extensiones adquieren una estructura hexagonal.
¿Por qué el hielo es resbaladizo?
A temperaturas tan bajas como 200 K, la superficie del hielo es altamente desordenada y parecida al agua. A medida que la temperatura se acerca al punto de congelación, esta región de desorden se extiende más abajo desde la superficie y actúa como lubricante.
La ilustración está tomada de un artículo en la edición del 7 de abril de 2008 de C&EN en honor al químico físico Gabor Somorjai quien fue pionero en los métodos modernos de estudio de superficies.
Agua “pura”
Para un químico, el término “puro” sólo tiene significado en el contexto de una aplicación o proceso particular. El agua destilada o desionizada que utilizamos en el laboratorio contiene gases atmosféricos disueltos y ocasionalmente algo de sílice, pero sus pequeñas cantidades e inercia relativa hacen que estas impurezas sean insignificantes para la mayoría de los propósitos. Cuando se requiere agua de la mayor pureza obtenible para ciertos tipos de mediciones exigentes, comúnmente se filtra, desioniza y destila al triple vacío. Pero incluso esta agua “químicamente pura” es una mezcla de especies isotópicas: hay dos isótopos estables tanto de hidrógeno (H 1 y H 2, este último a menudo denotado por D) como de oxígeno (O 16 y O 18) que dan lugar a combinaciones como H 2 O 18 , HDO 16, etc., todos los cuales son fácilmente identificables en los espectros infrarrojos del vapor de agua. Y para colmo, los dos átomos de hidrógeno en el agua contienen protones cuyos momentos magnéticos pueden ser paralelos o antiparalelos, dando lugar a orto- y para- agua, respectivamente. Las dos formas están normalmente presentes en una relación o/p de 3:1.
La cantidad de isótopos raros de oxígeno e hidrógeno en el agua varía lo suficiente de un lugar a otro que ahora es posible determinar la edad y la fuente de una muestra de agua en particular con cierta precisión. Estas diferencias se reflejan en los perfiles isotópicos H y O de los organismos. Así, el análisis isotópico del cabello humano puede ser una herramienta útil para la investigación del crimen y la investigación antropológica.
Más información sobre los enlaces de hidrógeno
Los enlaces de hidrógeno se forman cuando la nube de electrones de un átomo de hidrógeno que está unido a uno de los átomos más electronegativos es distorsionada por ese átomo, dejando una carga positiva parcial sobre el hidrógeno. Debido al tamaño muy pequeño del átomo de hidrógeno, la densidad de esta carga parcial es lo suficientemente grande como para permitirle interactuar con los electrones de par solitario en un átomo electronegativo cercano. Aunque el enlace de hidrógeno se describe comúnmente como una forma de atracción dipolo-dipolo, ahora está claro que implica una cierta medida de intercambio de electrones (entre los electrones externos no enlazantes y el hidrógeno) también, por lo que estos enlaces poseen algún carácter covalente.
Los enlaces de hidrógeno son más largos que los enlaces covalentes ordinarios, y también son más débiles. La evidencia experimental de enlaces de hidrógeno generalmente proviene de estudios de difracción de rayos X en sólidos que revelan distancias más cortas de lo normal entre el hidrógeno y otros átomos.
Enlace de hidrógeno en moléculas pequeñas
Los siguientes ejemplos muestran algo del amplio alcance de los enlaces de hidrógeno en las moléculas.
| El amoníaco (mp —78, pb —33°C) está unido a hidrógeno en los estados líquido y sólido. | |
 |
Los enlaces de hidrógeno son responsables de la solubilidad notablemente alta del amoníaco en agua. |
| Muchos ácidos orgánicos (carboxílicos) forman dímeros unidos a hidrógeno en estado sólido. | |
| Aquí el aceptor de enlaces de hidrógeno es la nube de electrones π de un anillo de benceno. Este tipo de interacción es importante para mantener la forma de las proteínas. | |
|
El fluoruro de hidrógeno (mp —92, pb 33°C) es otra sustancia común que está fuertemente unida a hidrógeno en sus fases condensadas. |
|
| El ion bifluoruro (para el cual no se puede escribir ninguna estructura de Lewis adecuada) puede considerarse como un ion complejo mantenido unido por el enlace de hidrógeno más fuerte conocido: aproximadamente 155 kJ mol —1. | |
Enlace de hidrógeno en biopolímeros
Los enlaces de hidrógeno juegan un papel esencial en los polímeros naturales de origen biológico de dos maneras:
- Enlace de hidrógeno entre cadenas poliméricas adyacentes (enlace intermolecular);
- Enlace de hidrógeno entre diferentes partes de la misma cadena (enlace intramolecular;
- Enlace de hidrógeno de las moléculas de agua a grupos —OH en la cadena del polímero (“agua unida”) que ayuda a mantener la forma del polímero.
Los ejemplos que siguen son representativos de varios tipos de biopolímeros.
Celulosa
La celulosa es un polímero lineal de glucosa (ver arriba), que contiene de 300 a más de 10,000 unidades, dependiendo de la fuente. Como principal componente estructural de las plantas (junto con la lignina en los árboles), la celulosa es la sustancia orgánica más abundante en la tierra. El papel de los enlaces de hidrógeno es reticular moléculas individuales para construir láminas como se muestra aquí. Estas hojas se apilan en una matriz escalonada sostenida por las fuerzas de van der Waals. Además, los enlaces de hidrógeno de las pilas adyacentes los agrupan en una estructura más fuerte y rígida.
Proteínas
Estos polímeros elaborados a partir de los aminoácidos R-CH (NH 2) COOH dependen de enlaces de hidrógeno intramoleculares para mantener su forma (estructura secundaria y terciaria) lo cual es esencial para su importante función como catalizadores biológicos (enzimas). Las moléculas de agua unidas a hidrógeno incrustadas en la proteína también son importantes para su integridad estructural.
El principal enlace de hidrógeno en las proteínas se encuentra entre los grupos -N—H de las partes “amino” con los grupos -C=O de las partes “ácidas”. Estas interacciones dan lugar a los dos tipos principales de la estructura secundaria que se refiere a la disposición de la cadena polimérica de aminoácidos:
hélice alfa[imágenes] |
lámina beta |
Aunque el carbono no suele considerarse particularmente electronegativo, ahora también se sabe que los enlaces de hidrógeno C—H-X son significativos en las proteínas.
ADN (ácido desoxirribonucleico)
¡Quién eres depende totalmente de los enlaces de hidrógeno! El ADN, como probablemente sabrás, es el más famoso de los biopolímeros debido a su papel central en la definición de la estructura y función de todos los organismos vivos. Cada cadena de ADN se construye a partir de una secuencia de cuatro monómeros de nucleótidos diferentes que consisten en un azúcar desoxirribosa, grupos fosfato y una base nitrogenada convencionalmente identificada por las letras A, T, C y G. El ADN en sí consiste en dos de estos cadenas de polinucleótidos que se enrollan alrededor de un eje común en una configuración algo así como la hélice alfa de la proteína descrita anteriormente. Las cadenas principales de azúcar y fosfato están en el exterior de manera que las bases nucleotídicas están en el interior y enfrentadas entre sí. Las dos cadenas se mantienen unidas por enlaces de hidrógeno que unen un átomo de nitrógeno de un nucleótido en una cadena con un nitrógeno u oxígeno en el nucleótido que está enfrente de él en la otra cadena.

Los enlaces de hidrógeno eficientes dentro de esta configuración solo pueden ocurrir entre los pares A-T y C-G, por lo que estos dos pares complementarios constituyen el “alfabeto” que codifica la información genética que se transcribe cada vez que se construyen nuevas moléculas proteicas. Las moléculas de agua, unidas por hidrógeno a las partes externas de la hélice de ADN, ayudan a estabilizarla.


