8.2.2C: Soluciones de Solutos Líquidos en Solventes Líquidos
- Page ID
- 70917
Mientras que todos los gases se mezclarán para formar soluciones independientemente de las proporciones, los líquidos son mucho más quisquillosos. Algunos líquidos, como el alcohol etílico y el agua, son miscibles en todas las proporciones. Otros, como el aceite proverbial y el agua, no lo son; cada líquido solo tiene una solubilidad limitada en el otro, y una vez que se supera cualquiera de estos límites, la mezcla se separa en dos fases.
| soluto → | líquido |
|---|---|
| energía para dispersar soluto | varía |
| energía para introducir en solvente | varía |
| aumento de la entropía | moderado |
| miscibilidad | “como se disuelve como” |
La razón de esta variabilidad es evidente a partir de la tabla. La mezcla de dos líquidos puede ser exotérmica, endotérmica o sin efecto térmico, dependiendo de las sustancias particulares. Cualquiera que sea el caso, los factores energéticos no suelen ser muy grandes, pero tampoco lo es el aumento de la aleatoriedad; los dos factores suelen estar suficientemente equilibrados para producir miscibilidad limitada.
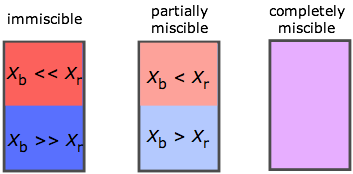
El rango de posibilidades se muestra aquí en términos de las fracciones molares X de dos líquidos A y B. Si A y B son sólo ligeramente miscibles, se separan en dos capas según sus densidades relativas. Tenga en cuenta que cuando se toman en cuenta los niveles de traza, no hay dos líquidos totalmente inmiscibles.
Como se disuelve como
Una regla general útil es que los líquidos son completamente miscibles cuando sus fuerzas intermoleculares son de naturaleza muy similar; “como se disuelve como”. Así, el agua es miscible con otros líquidos que pueden enganchar en enlaces de hidrógeno, mientras que un líquido hidrocarburo en el que Londres o las fuerzas de dispersión sean el único efecto intermolecular significativo solo será completamente miscible con tipos similares de líquidos.
Sustancias como los alcoholes, CH 3 (CH 2) n OH, que son enlaces de hidrógeno (y por lo tanto hidrófilos) en un extremo e hidrófobos en el otro, tienden a ser al menos parcialmente miscibles con ambos tipos de disolventes. Si n es grande, dominan las propiedades de los hidrocarburos y el alcohol solo tiene una solubilidad limitada en agua. Valores muy pequeños de n permiten que el grupo —OH domine, por lo que la miscibilidad en agua aumenta y se vuelve ilimitada en etanol (n = 1) y metanol (n = 0), pero la miscibilidad con hidrocarburos disminuye debido a la energía requerida para romper los enlaces de hidrógeno alcohol-alcohol cuando se agrega el líquido no polar.
Estas consideraciones se han vuelto bastante importantes en el desarrollo de combustibles automotrices alternativos basados en la mezcla de estos alcoholes con la gasolina. A temperaturas ordinarias el aumento de la entropía de la mezcla es lo suficientemente grande como para que el factor de energía desfavorable se supere por completo, y la mezcla es completamente miscible. A bajas temperaturas, el factor de entropía se vuelve menos predominante, y la mezcla de combustible puede separarse en dos fases, presentando graves problemas al filtro de combustible y al carburador.


