8.10.9C: Electrolitos débiles y fuertes
- Page ID
- 70868
El estudio serio de las soluciones electrolíticas comenzó en la última parte del siglo XIX, principalmente en Alemania —y antes de que se entendieran bien los detalles de disociación e ionización. Estos estudios revelaron que las conductividades equivalentes de los electrolitos disminuyen con la concentración (o más exactamente, con la raíz cuadrada de la concentración), pero lo hacen de varias formas distintas que se distinguen por sus comportamientos a concentraciones muy pequeñas. Esto llevó a la clasificación de los electrolitos como débiles, intermedios y fuertes.
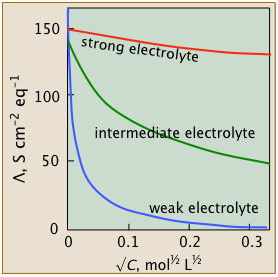
Notarás que las parcelas de conductividades vs. √ c comienzan en c =0. Por supuesto, es imposible medir la conductancia de un electrolito a concentraciones muy pequeñas (¡sin mencionar cero!) , pero para electrolitos fuertes e intermedios, se puede extrapolar una serie de observaciones a cero. Los valores resultantes se conocen como conductancias equivalentes limitantes o en ocasiones como “conductancias equivalentes a dilución infinita”, designadas por λ°.
- Electrolitos fuertes
- Estos sistemas de buen comportamiento incluyen muchas sales simples como NaCl, así como todos los ácidos fuertes.
Las gráficas λ vs √c siguen de cerca la relación lineal - λ = λ° — b √ c
- Electrolitos intermedios
- Estas sales “no tan fuertes” no pueden ajustarse del todo a la ecuación lineal anterior, pero sus conductividades pueden extrapolarse a dilución infinita.
- Electrolitos débiles
- “Menos es más” para estas rarezas que poseen la notable capacidad de exhibir conductividad equivalente infinita a dilución infinita. Aunque λ° no se puede estimar por extrapolación, existe una solución inteligente.
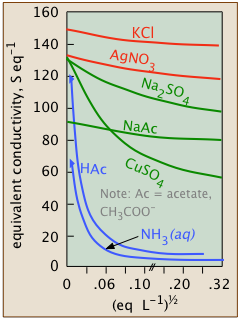
La conductividad disminuye a medida que aumentan las concentraciones
Dado que los iones son los portadores de carga, podríamos esperar que la conductividad de una solución sea directamente proporcional a sus concentraciones en la solución. Entonces, si el electrolito está totalmente disociado, la conductividad debe ser directamente proporcional a la concentración de electrolito. Pero este comportamiento ideal nunca se observa; en cambio, la conductividad de electrolitos de todo tipo disminuye a medida que aumenta la concentración.
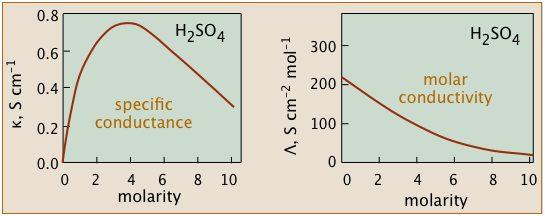
La no idealidad de las soluciones electrolíticas también se refleja en sus propiedades coligativas, especialmente la depresión del punto de congelación y la presión osmótica. La causa principal de esto es la presencia de la atmósfera iónica que se introdujo anteriormente. En la medida en que los iones que tienen signos de carga opuestos tienen más probabilidades de estar más cerca, esperaríamos que sus cargas se cancelaran parcialmente, reduciendo su tendencia a migrar en respuesta a un gradiente de potencial aplicado.
Un efecto secundario surge del hecho de que a medida que un ion migra a través de la solución, su nube de contra-iones no le sigue el ritmo. En cambio, se adquieren continuamente nuevos contraiones en el borde de ataque del movimiento, mientras que los existentes se dejan atrás en el lado opuesto. Se necesita algún tiempo para que los contraiones perdidos se disipen, por lo que siempre hay más contraiones en el borde de salida. La asimetría resultante del campo de contra-iones ejerce un efecto retardador sobre el ion central, reduciendo su velocidad de migración, y así su contribución a la conductividad de la solución.
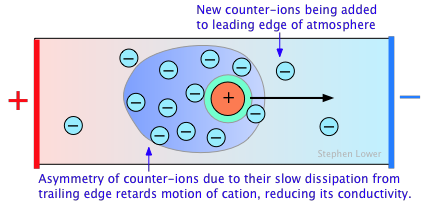
El tratamiento cuantitativo de estos efectos fue elaborado por primera vez por P. Debye y W. Huckel a principios de la década de 1920, y fue mejorado por Ostwald unos años después. Este trabajo representó uno de los mayores avances de la química física en la primera mitad del siglo XX, y puso el comportamiento de las soluciones electrolíticas sobre una base teórica sólida. Aun así, la teoría de Debye-Huckel se descompone para concentraciones superiores a aproximadamente 10 —3 M L —1 para la mayoría de los iones.
No todos los electrolitos se disocian totalmente en solución
las parcelas para electrolitos fuertes se explica en gran medida por los efectos discutidos inmediatamente anteriormente. La existencia de electrolitos intermedios sirvió como primer indicio de que muchas sales no están completamente ionizadas en el agua; esto pronto se confirmó por mediciones de sus propiedades coligativas.
La curvatura de las parcelas para electrolitos intermedios es una consecuencia simple del efecto Le Chatelier, que predice que el equilibrio
\[MX_{(aq)} = M^+_{(aq)} + X^–_{(aq)}\]
se desplazará hacia la izquierda a medida que aumente la concentración de los iones “libres”. En soluciones más diluidas, las concentraciones reales de estos iones son menores, pero su abundancia fraccional en relación con la forma no disociada es mayor. A medida que la solución se acerca a la concentración cero, prácticamente toda la\(MX_{(aq)}\) se disocia y la conductividad alcanza su valor límite.
Los electrolitos débiles se disocian solo a una dilución extremadamente alta
| ácido fluorhídrico | HF | K a = 10 —3.2 |
| ácido acético | CH 3 COOH | K a = 10 —6.3 |
| ion bicarbonato | HCO 3 — | K a = 10 —10.3 |
| amoníaco | NH 3 | K b = 10 —4.7 |
La disociación, por supuesto, es cuestión de grado. Las constantes de equilibrio para la disociación de una sal electrolítica intermedia MX están típicamente en el intervalo de 1-200. Esto contrasta con la gran cantidad de ácidos débiles (así como bases débiles) cuyas constantes de disociación suelen oscilar entre 10 —3 y menores de 10 —10.
Estos electrolitos débiles, al igual que los intermedios, estarán totalmente disociados en el límite de concentración cero; si la escala de la gráfica de electrólito débil (azul) mostrada anteriormente se magnificara en muchos órdenes de magnitud, la curva se parecería a la del electrolito intermedio por encima de él, y un valor para λ° se pudo encontrar por extrapolación. Pero a una dilución tan alta, la conductividad sería tan pequeña que quedaría enmascarada por la del agua misma (es decir, por los iones H + y OH —en equilibrio con la masiva concentración de agua 55.6 M L —1) — haciendo que los valores de λ en esta región sean prácticamente inconmensurables.


