11.4: Expresiones de equilibrio
- Page ID
- 70694
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Asegúrese de comprender a fondo las siguientes ideas esenciales:
- El cociente de equilibrio Q es el valor de la expresión de equilibrio de una reacción para cualquier conjunto arbitrario de concentraciones o presiones parciales de los componentes de la reacción.
- La constante de equilibrio K es el valor de Q cuando la reacción está en equilibrio. K tiene un valor único para una reacción dada a una temperatura y presión fijas.
- Q y K pueden expresarse en términos de concentraciones, presiones parciales o, cuando sea apropiado, en alguna combinación de estas.
- Para una reacción en la que todos los componentes sean gases, Q c y K c tendrán valores diferentes excepto en el caso especial en el que el número total de moles de gas no cambie.
- Los términos de concentración para sustancias cuyas concentraciones no cambian en la reacción no aparecen en expresiones de equilibrio. Los ejemplos más comunes son [H 2 O] cuando la reacción tiene lugar en solución acuosa (de manera que [H 2 O] es efectivamente constante a 55.6 M), y en reacciones heterogéneas que involucran sólidos, en las que la concentración del sólido está determinada por la densidad de el propio sólido.
- Se dice que una reacción cuya constante de equilibrio está en el rango de aproximadamente 0.01 a 100 es incompleta o [termodinámicamente] reversible.
- Q y K se tratan convencionalmente como cantidades adimensionales, y normalmente no es necesario que tengan unidades asociadas con ellas.
- Las reacciones heterogéneas son aquellas en las que están involucradas dos o más fases; las reacciones homogéneas tienen lugar en una sola fase. Un tipo común de reacción heterogénea es la pérdida de agua de cristalización por un hidrato sólido como CuSO 4·5H 2 O.
- La expresión de equilibrio se puede manipular y combinar de las siguientes maneras:
- Si la reacción se escribe a la inversa, Q se convierte en Q —1;
- Si los coeficientes de una ecuación se multiplican por n, Q se convierte en Q n;
- Q para la suma de dos reacciones (es decir, para dos reacciones que tienen lugar en secuencia) es el producto (Q 1) (Q 2).
Sabes que una expresión constante de equilibrio se parece a K = [productos]/[reactivos]. Pero, ¿cómo se traduce esto a un formato que se relaciona con el sistema químico real que le interesa? Esta lección le mostrará cómo escribir las expresiones constantes de equilibrio que necesitará usar al tratar los problemas de cálculo de equilibrio en el capítulo que sigue a este.
Las presiones pueden expresar concentraciones
Aunque comúnmente escribimos cocientes de equilibrio y constantes de equilibrio en términos de concentraciones molares, se puede usar cualquier término similar a la concentración, incluyendo fracción molar y molalidad. A veces los símbolos\(K_c\),\(K_x\), y\(K_m\) se utilizan para denotar estas formas de la constante de equilibrio. Hay que tener en cuenta que los valores numéricos de K y Q's expresados de estas diferentes formas generalmente no serán los mismos.
La mayoría de los equilibrios que tratamos en este curso ocurren en soluciones líquidas y mezclas gaseosas. Podemos expresar\(K_c\) valores en términos de moles por litro para ambos, pero cuando se trata de gases suele ser más conveniente usar presiones parciales. Estas dos medidas de concentración son, por supuesto, directamente proporcionales:
\[c=\dfrac{n}{V}=\dfrac{\dfrac{PV}{RT}}{V}=\dfrac{P}{RT} \label{Eq1}\]
así que para una reacción\(A_{(g)} \rightarrow B_{(g)}\) podemos escribir la constante de equilibrio como
\[K_p =\dfrac{P_B}{P_A} \label{Eq2}\]
Debido a las interacciones entre moléculas, especialmente cuando están involucrados iones, todas estas formas de la constante de equilibrio son aproximadamente correctas, funcionando mejor a bajas concentraciones o presiones. La única constante de equilibrio que es verdaderamente “constante” (excepto que todavía varía con la temperatura!) se expresa en términos de actividades, que se puede considerar como “concentraciones efectivas” que permiten interacciones entre moléculas. En la práctica, esta distinción sólo se vuelve importante para los equilibrios que involucran gases a presiones muy altas (como las que suelen encontrarse en la ingeniería química) y en soluciones iónicas más concentradas que alrededor de 0.001 M. No vamos a tratar mucho con las actividades en este curso.
Para una reacción como
\[CO_{2\, (g)} + OH^–_{(aq)} \rightleftharpoons HCO_{3\, (aq)}^- \label{Eq3}\]
que involucra componentes gaseosos y disueltos, comúnmente se usa una constante de equilibrio “híbrida”:
\[ K =\dfrac{[HCO_3^-]}{P_{CO_2}[OH^-]} \label{Eq4}\]
Claramente, es esencial estar seguro de las unidades cuando se ve una constante de equilibrio representada simplemente por "\(K\)”.
En esta lección (y en la mayoría de las otras de este conjunto) expresamos concentraciones en mol L —1 y presiones en atmósferas. Aunque esto refleja el uso común entre los químicos (¡los mayores, especialmente!) , estas unidades no forman parte del sistema SI que ha sido el estándar internacional desde la última parte del siglo XX.
Las concentraciones molares ahora se expresan más adecuadamente en mol dm —3 y la “atmósfera estándar" corresponde a una presión de 101.325 kPa. Hasta 1990, 1 atm era la “presión estándar” empleada en los cálculos relacionados con las leyes de gas, y también en la termodinámica. Desde esa fecha, la “presión estándar” ha sido de 100.000 kPa, expresada también en 1 bar.
Para fines más prácticos, las diferencias entre estos valores son tan pequeñas que se pueden descuidar.
Conversión entre\(K_p\) y\(K_c\)
A veces es necesario convertir entre constantes de equilibrio expresadas en diferentes unidades. El caso más común involucra constantes de equilibrio de presión y concentración. Obsérvese que cuando V se expresa en litros y P en atmósferas, R debe tener el valor 0.08206 L-ATM/mol K.). La ley de gas ideal relaciona la presión parcial de un gas con el número de moles y su volumen:
\[PV = nRT \]
Las concentraciones se expresan en moles/unidad de volumen N/v, por lo que reordenando la ecuación anterior obtenemos la relación explícita de presión a concentración:
\[P = \left(\dfrac{n}{V} \right)RT \label{Eq5}\]
Por el contrario,
\[c = \dfrac{n}{V} = \dfrac{P}{RT}\]
por lo que una concentración de un gas [A] se puede expresar como\(\dfrac{P_A}{RT}\).
Para una reacción de la forma\(A + 3 B\rightleftharpoons 2C\), podemos escribir
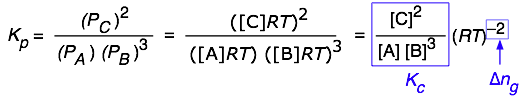
Suponiendo que todos los componentes son gases, la diferencia
\[(\text{moles of gas in products}) – (\text{moles of gas in reactants}) = \Delta{n_g} \nonumber\]
está dado por
\[ \color{red} {K_p = K_c (RT)^{\Delta{n_g}} \label{Eq6}}\]
¡No muestres concentraciones inmutables!
Las sustancias cuyas concentraciones no experimentan cambios significativos en una reacción química no aparecen en expresiones constantes de equilibrio. ¿Cómo no puede cambiar la concentración de un reactivo o producto cuando se produce una reacción que involucra esa sustancia? Hay dos casos generales a considerar.
La sustancia es también el Solvente
Esto sucede todo el tiempo en la química ácido-base. Así, para la hidrólisis del ion cianuro
\[\ce{CN^{-} + H2O <=> HCN + OH^{–}} \nonumber\]
escribimos
\[K_c= \dfrac{[\ce{HCN}][\ce{OH^-}]}{[\ce{CN^-}]} \nonumber\]
en el que no aparece ningún\([H_2O]\) término. La justificación de esta omisión es que el agua es tanto el disolvente como el reactivo, pero solo la pequeña porción que actúa como reactivo normalmente iría en la expresión de equilibrio. La cantidad de agua consumida en la reacción es tan pequeña (porque\(K\) es muy pequeña) que cualquier cambio en la concentración\(H_2O\) de la del agua pura (55.6 mol L —1) será insignificante.
Del mismo modo, para la “autodisociación” del agua
\[H_2O = H^+ + OH^– \nonumber\]
la constante de equilibrio se expresa como el “producto iónico”
\[K_w = [H^+][OH^–] \nonumber\]
Ten cuidado de tirar H 2 O siempre que lo veas. En la reacción de esterificación
\[\ce{CH3COOH + C2H5OH <=> CH3COOC2H5 + H2O} \nonumber\]
que discutimos en una sección anterior, un término [H 2 O] debe estar presente en la expresión de equilibrio si se supone que la reacción es entre los dos líquidos ácido acético y etanol. Si, por otro lado, la reacción se lleva a cabo entre una solución acuosa diluida del ácido y el alcohol, entonces no se incluiría el término [H 2 O].
La sustancia es una fase sólida o líquida pura
Esto se ve con mayor frecuencia en los equilibrios de solubilidad, pero hay muchas otras reacciones en las que los sólidos están directamente involucrados:
\[CaF_{2\, (s)} \rightarrow Ca^{2+}_{(aq)} + 2F^-_{(aq)} \label{Eq11}\]
\[Fe_3O_4(s) + 4 H_{2\, (g)} \rightarrow 4 H_2O_{(g)} + 3Fe_{(s)} \label{Eq12}\]
Se trata de reacciones heterogéneas (es decir, reacciones en las que algunos componentes se encuentran en diferentes fases), y el argumento aquí es que la concentración solo es significativa cuando se aplica a una sustancia dentro de una sola fase.
Así el término se\([CaF_2]\) referiría a la “concentración de fluoruro de calcio dentro del sólido\(CaF_2\) “, que es una constante dependiendo de la masa molar de\(CaF_2\) y la densidad de ese sólido. Las concentraciones de los dos iones serán independientes de la cantidad de sólido\(CaF_2\) en contacto con el agua; en otras palabras, el sistema puede estar en equilibrio siempre que alguno\(CaF_2\) esté presente. Lanzar los términos de concentración constante puede llevar a algunas expresiones de equilibrio de aspecto bastante escaso. Por ejemplo, la expresión de equilibrio para cada uno de los procesos mostrados en la siguiente tabla consiste únicamente en un solo término que implica la presión parcial de un gas:
| \(CaCO_{3(s)} \rightleftharpoons CaO_{(s)} + CO_{2(g)}\) |
\(K_p = P_{CO_2}\) |
Descomposición térmica de la piedra caliza, un primer paso en la fabricación del cemento. |
| \ (Na_2SO_4\ cdot 10 H_2O_ {(s)} Na_2SO_ {4 (s)} + 10 H_2O_ {(g)}\) |
\(K_p = P_{H_2O}^{10}\) |
El sulfato de sodio decahidratado es un sólido en el que se incorporan moléculas de H2O (“aguas de hidratación”) a la estructura cristalina.) |
| \(I_{2(s)} \rightleftharpoons I_{2(g)}\) |
\(K_p = P_{I_2}\) |
sublimación de yodo sólido; esta es la fuente del vapor púrpura que se puede ver arriba de yodo sólido en un recipiente cerrado. |
| \(H_2O_{(l)} \rightleftharpoons H_2O_{(g)}\) |
\(K_p = P_{H_2O}\) |
Vaporización de agua. Cuando la presión parcial del vapor de agua en el aire es igual a K, la humedad relativa es del 100%. |
Los dos últimos procesos representan cambios de estado (cambios de fase) que pueden tratarse exactamente igual que las reacciones químicas. En cada uno de los procesos heterogéneos mostrados en la Tabla\(\PageIndex{1}\), los reactivos y productos pueden estar en equilibrio (es decir, coexistir permanentemente) sólo cuando la presión parcial del producto gaseoso tiene el valor consistente con lo indicado\(K_p\). Ten en cuenta también que todos estos\(K_p\) aumentan con la temperatura.
¿Cuáles son los valores del\(K_p\) equilibrio entre el agua líquida y su vapor a 25°C, 100°C y 120°C? La presión de vapor del agua a estas tres temperaturas es de 23.8 torr, 760 torr (1 atm) y 1489 torr, respectivamente.
Comentario: Estas presiones de vapor son las presiones parciales del vapor de agua en equilibrio con el líquido, por lo que son idénticas a las\(K_p\)'s cuando se expresan en unidades de atmósferas.
Solución
|
25°C
|
100°C
|
120°C
|
|---|---|---|
| \(K_p = \dfrac{23.8\; torr}{ 760\; torr/atm} = 0.031\; atm\) | \(K_p = 1.00\; atm\) | \(K_p = \dfrac{1489\; torr}{ 760\; torr/atm} = 1.96\; atm\) |
| La presión parcial de H2O sobre la superficie del agua líquida en un recipiente cerrado a 25°C se acumulará hasta este valor. Si se retira la cubierta para que no se pueda mantener esta presión, el sistema dejará de estar en equilibrio y el agua se evaporará. |
Esta temperatura corresponde, por supuesto, al punto de ebullición del agua. El punto de ebullición normal de un líquido es la temperatura a la que la presión parcial de su vapor es de 1 atm.
|
La única manera de calentar el agua por encima de su punto de ebullición normal es hacerlo en un recipiente cerrado que pueda soportar el aumento de la presión de vapor. Por lo tanto, una olla a presión que funcione a 120°C debe diseñarse para soportar una presión interna de al menos 2 atm. |
Valores de Constantes de Equilibrio
o “reversible”.
A medida que una constante de equilibrio se acerca a los límites de cero o infinito, la reacción se puede caracterizar cada vez más como un proceso unidireccional; decimos que es “completa” o “irreversible”. Este último término, por supuesto, no debe tomarse literalmente; el principio de Le Chatelier aún se aplica (especialmente en lo que respecta a la temperatura), pero la adición o eliminación de reactivos o productos tendrá menos efecto.
Reacciones Cinéticamente Impedidas
Si bien no es de ninguna manera una regla general, con frecuencia sucede que las reacciones que tienen constantes de equilibrio muy grandes se ven obstaculizadas cinéticamente, muchas veces en la medida en que la reacción esencialmente no tiene lugar.
Los ejemplos de la siguiente tabla pretenden mostrar que los números (valores de K), por más aburridos que se vean, ¡sí tienen consecuencias prácticas!
| Reacción |
K
|
observaciones |
|---|---|---|
| \(N_{2(g)} + O_{2(g)} \rightleftharpoons 2 NO_{(g)}\) | \(5 \times 10^{–31}\)a 25°C, 0.0013 a 2100°C |
Estos dos valores muy diferentes de K ilustran muy bien por qué reducir las temperaturas de la cámara de combustión en los motores de automóviles es respetuoso con el medio ambiente. |
| \(3 H_{2(g)} + N_{2(g)} \rightleftharpoons 2 NH_{3(g)}\) | \(7 \times 10^5\)a 25°C, 56 a 1300°C |
Consulte la discusión de esta reacción en la sección sobre el proceso Haber. |
| \(H_{2(g)} \rightleftharpoons 2 H_{(g)}\) | \(10^{–36}\)a 25°C, \(6 \times 10^{–5}\) a 5000° |
La disociación de cualquier molécula estable en sus átomos es endotérmica. Esto significa que todas las moléculas se descompondrán a temperaturas suficientemente altas. |
| \(H_2O_{(g)} \rightleftharpoons H_{2(g)} + ½ O_{2(g)}\) | \(8 \times 10^{–41}\)a 25°C | ¡No encontrarás el agua como una muy buena fuente de gas oxígeno a temperaturas normales! |
| \ (CH_3COOH_ {(l)}\ derecho-izquierdocharpoons 2 H_2O_ {(l)} + 2 C_ {(s)}\) |
\(K_c = 10^{13}\)a 25°C | Esto nos dice que el ácido acético tiene una gran tendencia a descomponerse en carbono, pero nunca nadie ha encontrado grafito (¡ni diamantes!) formando en una botella de vinagre. ¡Un buen ejemplo de una reacción súper cinéticamente obstaculizada! |
La expresión de equilibrio para la síntesis de amoníaco
\[3 H_{2(g)} + N_{2(g)} \rightarrow 2 NH_{3(g)} \label{Eq13}\]
se puede expresar como
\[ K_p =\dfrac{P^2_{NH_3}}{P_{N_2}P^3_{H_2}} \label{Eq14}\]
o
\[ K_c = \dfrac{[NH_3]^2}{[N_2] [H_2]^3} \label{Eq15}\]
por lo que\(K_p\) para este proceso parecería tener unidades de atm —1, y se\(K_c\) expresaría en mol —2 L 2. Y sin embargo, estas cantidades a menudo se representan como adimensionales. ¿Cuál es el correcto? La respuesta es que ambas formas son aceptables. Hay algunas situaciones (que te encontrarás más adelante) en las que los K deben considerarse adimensionales, pero al simplemente citar el valor de una constante de equilibrio es permisible incluir las unidades, y esto incluso puede ser útil para eliminar cualquier duda sobre las unidades del individuo términos en expresiones de equilibrio que contienen términos tanto de presión como de concentración. Al realizar sus propios cálculos, sin embargo, rara vez hay una necesidad real de mostrar las unidades.
Estrictamente hablando, las expresiones de equilibrio no tienen unidades porque los términos de concentración o presión que entran en ellas son realmente proporciones que tienen las formas (n mol L —1)/(1 mol L —1) o (n atm)/(1 atm) en las que la cantidad unitaria en el denominador se refiere al estado estándar de la sustancia; así las unidades siempre cancelan. (¡Pero no se espera que los alumnos de primer año sepan esto!)
Para sustancias que son líquidos o sólidos, el estado estándar es solo la concentración de la sustancia dentro del líquido o sólido, así que para algo así como CaF (s), el término que entra en la expresión de equilibrio es [CaF 2]/[CaF 2] que cancela a la unidad; este es el razón por la que no necesitamos incluir términos para fases sólidas o líquidas en expresiones de equilibrio. El tema de los estados estándar nos llevaría más allá de donde necesitamos estar en este punto del curso, por lo que simplemente diremos que el concepto se hace necesario por el hecho de que la energía, que en última instancia gobierna el cambio químico, siempre es relativa a algún valor cero definido arbitrariamente que, para las sustancias químicas, es el estado estándar.
Cómo afecta la ecuación de reacción a K
Es importante recordar que un cociente o constante de equilibrio siempre está ligado a una ecuación química específica, y si escribimos la ecuación a la inversa o multiplicamos sus coeficientes por un factor común, el valor de\(Q\) o\(K\) cambiará. Las reglas son muy simples:
- Escribir la ecuación a la inversa invertirá la expresión de equilibrio;
- Multiplicar los coeficientes por un factor común elevará Q o K a la potencia correspondiente.
Estas son algunas de las posibilidades para la reacción que implica el equilibrio entre el agua gaseosa y sus elementos:
Ejemplo 1:\(\ce{2 H2 + O2 <=> 2 H2O} \) con expresión de equilibrio\[K_p = \dfrac{P_{H_2O}^2}{P_{H_2}^2P_{O_2}} \nonumber\]
Ejemplo 2:\(\ce{10 H2 + 5 O2 <=> 10 H2O}\) con expresión de equilibrio\[\begin{align*} K_p &= \dfrac{P_{H_2O}^{10}}{P_{H_2}^{10}P_{O_2}^5} \\[4pt] &= \left(\dfrac{P_{H_2O}^2}{P_{H_2}^2P_{O_2}}\right)^{5}\end{align*}\]
Ejemplo 3:\(\ce{H2 + 1/2 O2 <=> H2O} \) con expresión de equilibrio\[\begin{align*} K_p &= \dfrac{P_{H_2O}}{P_{H_2}P_{O_2}^{1/2}} \\[4pt] &= \left(\dfrac{P_{H_2O}^2}{P_{H_2}^2P_{O_2}}\right)^{1/2} \end{align*}\]
Ejemplo 4:\(\ce{H2O <=> H2 + 1/2 O2 } \) con expresión de equilibrio\[\begin{align*} K_p &= \dfrac{P_{H_2}P_{O_2}^{1/2}}{P_{H_2O}} \\[4pt] &= \left(\dfrac{P_{H_2O}^2}{P_{H_2}^2P_{O_2}}\right)^{-1/2} \end{align*}\]
Muchos cambios químicos pueden considerarse como la suma o diferencia de otras dos o más reacciones. Si conocemos las constantes de equilibrio de los procesos individuales, podemos calcularlas fácilmente para la reacción general de acuerdo con la siguiente regla.
La constante de equilibrio para la suma de dos o más reacciones es el producto de las constantes de equilibrio para cada uno de los pasos.
Calcular el valor de\(K\) para la reacción
\[\ce{CaCO3(s) + H^{+}(aq) <=> Ca^{2+}(aq) + HCO^{–}3(aq)} \nonumber\]
dadas las siguientes constantes de equilibrio:
|
\(CaCO_{3(s)} \rightleftharpoons Ca^{2+}_{(aq)} + CO^{2–}_{3(aq)}\) |
\(K_1 = 10^{–6.3}\) |
|
\(HCO^–_{3(aq)} \rightleftharpoons H^+_{(aq)} + CO^{2–}_{3(aq)}\) |
\(K_2 = 10^{–10.3}\) |
Solución
La reacción neta es la suma de la reacción 1 y la inversa de la reacción 2:
|
\(CaCO_{3(s)} \rightleftharpoons Ca^{2+}_{(aq)} + CO^{2–}_{3(aq)}\) |
\(K_1 = 10^{–6.3}\) |
|
\( H^+_{(aq)} + CO^{2–}_{3(aq)} \rightleftharpoons HCO^–_{3(aq)} \) |
\(K_{–2} = 10^{–(–10.3)}\) |
|
\(CaCO_{3(s)} + H^+_{(aq)} \rightarrow Ca^{2+}_{(aq)} + HCO^–_{3(aq)}\) |
\(K = \dfrac{K_1}{K_2} = 10^{(-6.4+10.3)} =10^{+3.9}\) |
Comentario:
Esta reacción neta describe la disolución de la piedra caliza por ácido; es responsable del efecto erosivo de la lluvia ácida en edificios y estatuas. Este es un ejemplo de una reacción que prácticamente no tiene tendencia a darse por sí misma (pequeña K1) siendo “impulsada” por una segunda reacción que tiene una gran constante de equilibrio (K —2). Desde el punto de vista del principio de Le Chatelier, la primera reacción se “tira hacia la derecha” por la eliminación de carbonato por ión hidrógeno. Las reacciones acopladas de este tipo se encuentran ampliamente en todas las áreas de la química, y especialmente en la bioquímica, en las que una docena de reacciones pueden estar vinculadas.
La síntesis de\(\ce{HBr}\) from hydrogen and liquid bromine has an equilibrium constan t\(K_p = 4.5 \times 10^{15}\) a t 25°C.Dado que la presión de vapor del bromo líquido es de 0.28 atm, encontrar\(K_p\) for the homogeneous gas-phase reaction at the same temperature.
Solución
La reacción neta que buscamos es la suma de la síntesis heterogénea de\(\ce{HBr}\) and the reverse of the vaporization of liquid bromine:
| \(H_{2(g)} + Br_{2(l)} \rightleftharpoons 2 HBr_{(g)}\) | \(K_p = 4.5\times 10^{15}\) |
| \(Br_{2(g)} \rightleftharpoons Br_{2(l)}\) | \(K_p = (0.28)^{–1}\) |
| \(H_{2(g)} + Br_{2(g)} \rightleftharpoons 2 HBr_{(g)}\) | \(K_p = 1.6 \times 10^{16}\) |
Más sobre reacciones heterogéneas
Las reacciones heterogéneas son aquellas que involucran más de una fase. Algunos ejemplos:
| \(Fe(s) + O_2(g) \rightleftharpoons FeO_2(s)\) | aire-oxidación de hierro metálico (formación de óxido) |
|---|---|
| \ (Fe (s) + O_2 (g)\ rightleftharpoons FeO_2 (s)\)” style="text-align:center; ">\ (caf_2 (s)\ rightleftharpoons Ca (aq) + F^+ (aq)\ _ | disolución de fluoruro de calcio en agua |
| \ (Fe (s) + O_2 (g)\ rightleftharpoons FeO_2 (s)\)” style="text-align:center; ">\(H_2O(s) \rightleftharpoons H_2O(g)\) | sublimación de hielo (un cambio de fase) |
| \ (Fe (s) + O_2 (g)\ derechoderpoones izquierdos FeO_2 (s)\) ">
\ (NaHCO_3 (s) + H^+ (aq)\ derechazarpoons |
formación de gas dióxido de carbono a partir del bicarbonato de sodio cuando se agrega agua al polvo de hornear (los iones hidrógeno provienen del ácido tartárico, el otro componente del polvo de hornear). |
La presión de vapor de los hidratos sólidos
Un tipo de reacción heterogénea particularmente interesante es aquella en la que un sólido está en equilibrio con un gas. La sublimación de hielo ilustrada en la tabla anterior es un ejemplo muy común. La constante de equilibrio para este proceso es simplemente la presión parcial del vapor de agua en equilibrio con el sólido, la presión de vapor del hielo.
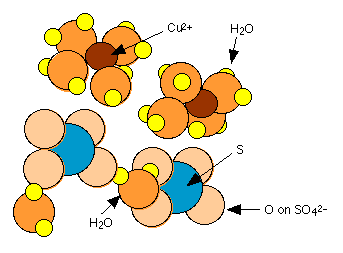
Muchas sales inorgánicas comunes forman sólidos que incorporan moléculas de agua en sus estructuras cristalinas. Estas moléculas de agua generalmente se mantienen con bastante holguras y pueden escapar como vapor de agua. El sulfato de cobre (II), por ejemplo forma un pentahidrato en el que cuatro de las moléculas de agua se coordinan con el ion Cu 2 + mientras que la quinta está unida por hidrógeno a SO 4 2—. Esta última agua está más unida, de manera que el pentahidrato pierde agua en dos etapas al calentarse:
\[\ce{CuSO4 \cdot 5H2O ->[140^oC] CuSO4 \cdot 5H2O ->[400^oC] CuSO4} \nonumber\]
Estas etapas de deshidratación se llevan a cabo a las temperaturas indicadas anteriormente, pero a cualquier temperatura, parte de la humedad puede escapar de un hidrato. Para la deshidratación completa del pentahidrato podemos definir una constante de equilibrio:
\[\ce{CuSO4 \cdot 5H2O(s) <=> CuSO4(s) + 5 H2O(g)} \quad K_p = 1.14 \times 10^{10} \nonumber\]
La presión de vapor del hidrato (para esta reacción) es la presión parcial del vapor de agua a la que los dos sólidos pueden coexistir indefinidamente; su valor es \(K_p\)1/5 atm. Si un hidrato se expone al aire en el que la presión parcial del vapor de agua es menor que su presión de vapor, la reacción procederá a la derecha y el hidrato perderá humedad. Las presiones de vapor siempre aumentan con la temperatura, por lo que cualquiera de estos compuestos puede deshidratarse por calentamiento.
La pérdida de agua suele provocar una ruptura en la estructura del cristal; esto se ve comúnmente con el sulfato de sodio, cuya presión de vapor es lo suficientemente grande como para que pueda superar la presión parcial del vapor de agua en el aire cuando la humedad relativa es baja. Lo que se ve es que los cristales bien formados del decahidrato sufren deterioro en forma polvorienta, fenómeno conocido como eflorescenc e.
| nombre | fórmula | presión de vapor, torr | |
|---|---|---|---|
| 25°C | 30°C | ||
| sulfato de sodio decahidratado | Na 2 SO 4 ·10H 2 O | 19.2 | 25.3 |
| sulfato de cobre (II) pentahidrato | CuSO 4 ·5H 2 O | 7.8 | 12.5 |
| cloruro de calcio monohidrato | CaCl 2 ·H 2 O | 3.1 | 5.1 |
| (agua) | H 2 O | 23.5 | 31.6 |
¿A qué humedad relativa el sulfato de cobre pentahidratado perderá sus aguas de hidratación cuando la temperatura del aire sea de 30°C? ¿Qué es\(K_p\) for this process at this temperature?
SoluciónDe la Tabla\(\PageIndex{3}\), vemos que la presión de vapor del hidrato es de 12.5 torr, lo que corresponde a una humedad relativa de 12.5/31.6 = 0.40 o 40%. Esta es la humedad que se mantendrá si el hidrato se coloca en un recipiente cerrado de aire seco
Para esta hidra comió\(K_p = \sqrt{p_{H_2O)}}\), así la presión parcial del vapor de agua que estará en equilibrio con el hidrato y el sólido deshidratado (¡recuerda que ambos sólidos deben estar presentes para tener equilibrio!) , expresado en atmósferas, será
\[\left(\dfrac{12.5}{760}\right)^5 = 1.20 \times 10^{-9}. \nonumber\]
Uno de los primeros hidratos investigados en detalle fue el sulfato de calcio hemihidratado (CaSO 4 ·½ H 2 O) que Le Chatelier (el del “principio”) demostró ser la forma endurecida de CaSO 4 conocida como yeso de París. El CaSO 4 anhidro forma cristales compactos en polvo, mientras que los cristales alargados del hemihidrato se unen en una masa similar al cemento que hace que este material sea útil para hacer objetos de arte, moldes para inmovilizar extremidades dañadas y como material de construcción (ignífugo, paneles de yeso).


