3.2.1: Conexiones culturales- Bertollidos- Un desafío a la estequiometría química
- Page ID
- 75954
Estequiometría
Los químicos están comprometidos con la idea de que una ecuación química equilibrada como
\[2 Fe + O_2 \rightarrow 2 FeO \label{1} \]
no sólo indica cuántos átomos o moléculas de cada tipo están involucrados en una reacción, también indica la cantidad de cada sustancia que está involucrada. La ecuación (1) dice que 1 átomo de Fe puede reaccionar con 2 O 2 moléculas para dar 2 unidades de fórmula de FeO. Aquí estamos usando el término “unidad de fórmula” para indicar que la sustancia puede no ser una molécula, sino más bien un compuesto iónico o ["cristal de red"]. Una “unidad de fórmula” da la composición de la sustancia sin especificar el tipo de unión.
La ecuación también dice que 1 mol de átomos de Fe reaccionaría con 2 mol O 2 produciendo 2 mol FeO.
Nos hemos acostumbrado tanto a la idea de los átomos, que parece lógico que las ecuaciones representen números enteros de átomos. Hablamos ahora de las relaciones estequiométricas de los átomos cuando queremos indicar que deben combinarse en pequeñas proporciones de números enteros, como 1:1 en FeO. La palabra estequiométrica proviene de las palabras griegas estequión, “elemento “y metron, “medida “. De ahí que la relación estequiométrica mide un elemento (o compuesto) contra otro.
Un reto para el razonamiento estequiométrico
Pero la idea de proporciones estequiométricas de números enteros se opuso fuertemente a principios del siglo XIX. Esto es comprensible, porque la Ley de Proporciones Definidas es bastante anti-intuitiva. Después de todo, parece que generalmente se pueden mezclar las cosas en prácticamente cualquier proporción para obtener los resultados deseados. Dado que la teoría atómica de Dalton implicaba que los átomos debían combinarse en proporciones definidas, muchos de sus contemporáneos se opusieron a la teoría atómica. La teoría de Dalton explicaba la anterior Ley de composición constante de Proust (Ley de proporciones definidas o “Ley de Proust" (1797)) [1],
De hecho, hay muchos compuestos importantes que son “no estequiométricos”, ¡incluido el producto de la Ecuación (1)! A menudo se les llama “Berthollides” por el químico inorgánico francés Claude Louis Berthollet (1748—1822), quien atacó la teoría atómica de Dalton (1803-5) y la Ley de Proust [2]. N. S. Kurnakov introdujo los términos “Daltonides” y “Berthollides” en 1912-14 para designar compuestos químicos de composición constante (Daltonides) y composición variable (Berthollides) [3].
|
Claude Louis Berhollet. Oponente a la Ley de la Composición Constante |
Joseph Proust (1754-1826). Descubridor de la Ley de la Composición Constante |
Este episodio en la historia de la química es un buen ejemplo de la afirmación de los filósofos de la ciencia de que los contraejemplos de una teoría aceptada pueden no ser reconocidos. El concepto de estequiometría se utilizó para encubrir las excepciones más evidentes y, durante más de un siglo, se ignoraron sustancias que no se pudieron hacer para ajustarse a estas nuevas reglas hasta que Kurnakov llamó la atención sobre Berthollides [4] [5].
Compuestos no estequiométricos
Berthollet se opuso a la teoría atómica de Dalton, señalando muchas reacciones, como la reacción de muchos metales de transición con el oxígeno, que no son estequiométricas. Algunos de sus escritos están disponibles en línea. La reacción en la Ecuación (1) a menudo no da FeO. En la naturaleza, FeO es el wüstite mineral, que tiene la estequiometría real más cercana a Fe 0.95 O. Por cada ion Fe 2 + “faltante”, el cristal contiene dos iones Fe 3 + para suministrar la carga 2+ faltante para el saldo de carga [6]. En el siguiente diagrama, una vacante (Fe 2 +) compensada por dos sustituciones (Fe 3 +) en puntos tardíos. El “par Frenkel” ocurre cuando un ion reticular es reemplazado por un ion intersticial en algunos compuestos no estequiométricos. La composición de un compuesto no estequiométrico puede variar solo ligeramente, como en wüstite donde la fórmula puede escribirse como Fe 1 -x O, donde x es un número pequeño (~0.05). En algunos casos, al igual que los sulfuros de cobre, la variación puede ser mucho mayor [7]. Para fines prácticos, el término describe materiales donde la no estequiometría es al menos 1% de la composición ideal.
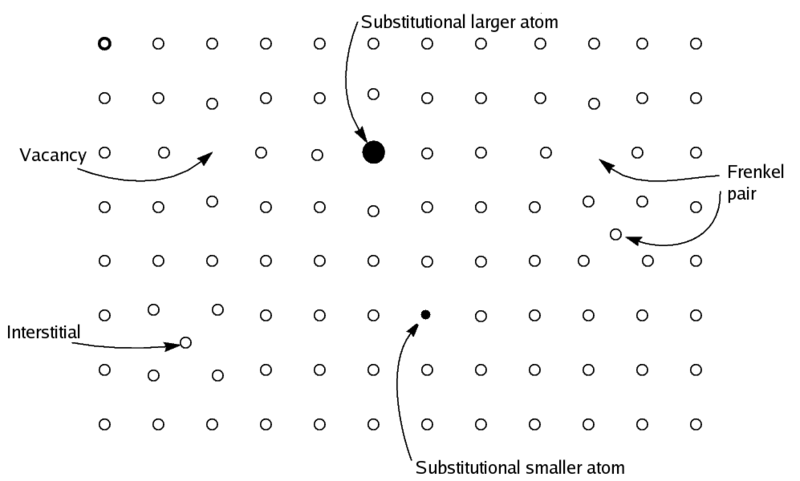
Detalles de Razonamiento Estequiométrico
Para contrastar compuestos estequiométricos con compuestos no estequiométricos, consulte la Ecuación (2),
\[3 Fe + 2 O_2 \rightarrow Fe_3O_4 \label{2} \]
Además de las relaciones atómicas, también nos dice que 2 × 3 mol = 6 mol Fe reaccionará con 2 × 2 mol = 4 mol O 2, y que ½ × 3 mol = 1.5 mol Fe requiere solo ½ × 2 mol = 1 mol O 2. Es decir, la ecuación indica que exactamente 2 mol O 2 deben reaccionar por cada 3 mol de Fe consumidos. A los efectos de calcular cuánto O 2 se requiere para reaccionar con una cierta cantidad de Fe por lo tanto, la información significativa contenida en la Ec. (2) es la relación
\[\dfrac{\text{2 mol O}_{\text{2}}}{\text{3 mol Fe}} \nonumber \]
Llamaremos a tal relación derivada de una ecuación química balanceada una relación estequiométrica y le daremos el símbolo S. Así, para la Ec. (2),
\[\text{S}\left( \frac{\text{O}_{\text{2}}}{\text{Fe}} \right)=\frac{\text{2 mol O}_{\text{2}}}{\text{3 mol Fe}} \tag{3}\]
Razonamiento estequiométrico y compuestos no estequiométricos
En circunstancias normales, la relación estequiométrica se mantiene de cerca (Fe 3 O 4 es una combinación de Fe 2 O 3 y FeO, por lo que puede incorporar la no estequiometría de FeO descrita anteriormente). Pero condiciones geológicas o sintéticas inusuales conducen a otras estequiometrías. Por ejemplo, una técnica denominada “deposición por pulverización catódica” o “pulverización catódica” implica calentar un reactivo al vacío con una pequeña cantidad del segundo reactivo presente como vapor, como se muestra en la Figura de la derecha. El producto se recolecta sobre un sustrato frío.
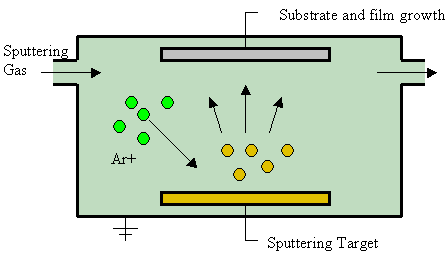
Esto conduce a bertollidos cuando una muestra de hierro se pulveriza catódicamente en presencia de vapor de agua. Se obtuvieron composiciones de óxido que variaron de Fe 3 O 4 a Fe 2 O 3, dependiendo de la temperatura y presión [8]. Tendrían relaciones estequiométricas que van desde\(\frac{\text{2 mol O}_{\text{2}}}{\text{3 mol Fe}}\) para la Ecuación (2).
a\(\frac{\text{1.5 mol O}_{\text{2}}}{\text{2 mol Fe}}\) para la reacción 2 Fe + 1.5 O 2 → Fe 2 O 3, y la mayoría de las proporciones no se reducirían fácilmente a proporciones de números enteros.
Es notable que las relaciones estequiométricas se utilizan para comprender y guiar la síntesis de compuestos incluso no estequiométricos, por lo que esta es realmente un área importante de la química.
Derivar todas las relaciones estequiométricas posibles de la ecuación (2)
Solución
Cualquier relación de cantidades de sustancia dada por los coeficientes en la ecuación puede ser utilizada:
\[\text{S}\left( \frac{\text{Fe}}{\text{O}_{2}} \right)=\frac{\text{3 mol Fe}}{\text{2 mol O}_{\text{2}}}~~~~~~\text{S}\left( \frac{\text{Fe}_{3}\text{O}_{4}}{\text{Fe}} \right)=\frac{\text{1 mol Fe}_{3}\text{O}_{4}}{\text{3 mol Fe}}\]\[\text{S}\left( \frac{\text{O}_{2}}{\text{Fe}_{3}\text{O}_{4}} \right)=\frac{\text{2 mol O}_{2}}{\text{1 mol Fe}_{2}\text{O}_{4}}~~~~~\text{S}\left( \frac{\text{Fe}}{\text{Fe}_{\text{3}}\text{O}_{4}} \right)=\frac{\text{3 mol Fe}}{\text{1 mol Fe}_{\text{3}}\text{O}_{4}}\]
Cuando ocurre alguna reacción química estequiométrica, las cantidades de sustancias consumidas o producidas están relacionadas por las proporciones estequiométricas apropiadas. Usando la Ec. (2) como ejemplo, esto significa que la relación de la cantidad de O 2 consumida a la cantidad de Fe consumida debe ser la relación estequiométrica S (O 2 /Fe):\(\frac{n_{\text{O}_{\text{2}}\text{ consumed}}}{n_{\text{Fe}_\text{ consumed}}}=\text{S}\left( \frac{\text{O}_{\text{2}}}{\text{Fe}} \right)=\frac{\text{2 mol O}_{\text{2}}}{\text{3 mol Fe}}\) De igual manera, la relación de la cantidad de Fe 3 O 4 producida a la cantidad de Fe consumida debe ser
S (Fe 3 O 4 /Fe):
\[\frac{n_{\text{Fe}_{3}\text{O}_{4}}\text{ produced}}{n_{\text{Fe}\text{ consumed}}}\]
Nótese que en la palabra Ec. (4a) y la ecuación simbólica (4b), X e Y pueden representar cualquier reactivo o cualquier producto en la ecuación química equilibrada de la que se derivó la relación estequiométrica. No importa la cantidad de cada reactivo que tengamos, las cantidades de reactivos consumidos y las cantidades de productos producidos estarán en proporciones estequiométricas apropiadas.
Encuentra la cantidad de Fe 3 O 4 producida cuando se consumen 3.68 mol de Fe de acuerdo con la Ec. (2).
Solución
La cantidad de Fe 3 O 4 producida debe estar en la relación estequiométrica S (Fe 3 O 4 /Fe) a la cantidad de Fe consumida:
\[\text{S}\left( \frac{\text{Fe}_{3}\text{O}_{4}}{\text{Fe}} \right)\]
Multiplicando ambos lados n Fe consumido, por tenemos
\[n_{\text{Fe}_{3}\text{O}_{4}\text{ produced}}\]
Esta es una ilustración típica del uso de una relación estequiométrica como factor de conversión. El Ejemplo 2 es análogo a los Ejemplos 1 y 2 de Factores y Funciones de Conversión, donde se empleó densidad como factor de conversión entre masa y volumen. El Ejemplo 2 también es análogo a los Ejemplos 2.4 y 2.6, en los que se utilizaron como factores de conversión la constante de Avogadro y la masa molar. Al igual que en estos casos anteriores, no hay necesidad de memorizar o hacer manipulaciones algebraicas con la Ec. (4) cuando se utiliza la relación estequiométrica. Simplemente recuerde que los coeficientes en una ecuación química equilibrada dan proporciones estequiométricas, y que la elección adecuada da como resultado la cancelación de unidades. En forma de hoja de ruta\(\text{amount of X consumed or produced}\overset{\begin{smallmatrix} \text{stoichiometric} \\ \text{ ratio X/Y} \end{smallmatrix}}{\longleftrightarrow}\text{amount of Y consumed or produced}\) o simbólicamente.
-
-
- \(n_{\text{X consumed or produced}}\text{ }\overset{S\text{(X/Y)}}{\longleftrightarrow}\text{ }n_{\text{Y consumed or produced}}\)
-
Al usar relaciones estequiométricas, asegúrese de indicar siempre moles de qué. Sólo se pueden cancelar moles de la misma sustancia. Es decir, 1 mol Fe cancela 1 mol Fe pero no cancela 1 mol Fe 3 O 4.
El siguiente ejemplo muestra que las relaciones estequiométricas también son útiles en problemas que involucran la masa de un reactivo o producto.
Agrega texto de ejemplo aquí.
Solución
Agrega texto de ejemplo aquí.
Calcular la masa de Oxígeno (O 2) consumido cuando 3.68 mol Fe reacciona de acuerdo con la Ecuación (2).
Solución
El problema pide que calculemos la masa de O 2 consumida. Como aprendimos en el Ejemplo 2 de La masa molar, la masa molar se puede utilizar para convertir de la cantidad de O 2 a la masa de O 2. Por lo tanto este problema en efecto es pedir que calculemos la cantidad de O 2 consumida a partir de la cantidad de Fe consumida. Este es el mismo problema que en el Ejemplo 2. Requiere la relación estequiométrica
\[\text{S}\left( \frac{\text{O}_{\text{2}}}{\text{Fe}} \right)=\frac{\text{2 mol O}_{\text{2}}}{\text{3 mol Fe}}\]\[n_{\text{O}_{\text{2}}}\text{ consumed}\]
La masa de O 2 es\(\text{m}_{\text{O}_{\text{2}}}=\text{2}\text{.45 mol O}_{\text{2}}\times \frac{\text{32}\text{.0 g O}_{\text{2}}}{\text{1 mol O}_{\text{2}}}=\text{78.5 g O}_{\text{2}}\) Con la práctica este tipo de problema se puede resolver en un solo paso concentrándose en las unidades. La relación estequiométrica apropiada convertirá moles de Fe en moles de O 2 y la masa molar convertirá moles de O 2 en gramos de O 2. Un mapa de ruta esquemático para el cálculo de un solo paso se puede escribir como\(n_{\text{Fe}}~~\xrightarrow{S\text{(O}_{\text{2}}\text{/Fe}\text{)}}~~n_{\text{O}_{\text{2}}}~~\xrightarrow{M_{\text{O}_{\text{2}}}}\text{ }m_{\text{O}_{\text{2}}}\) Así\(\text{m}_{\text{O}_{\text{2}}}=\text{3.68 mol Fe}~~\times ~~\frac{\text{2 mol O}_{\text{2}}}{\text{3 mol Fe}}~~\times~~\frac{\text{32.0 g}}{\text{1 mol O}_{\text{2}}}=\text{78.5 g O}_{2}\)
Estos cálculos se pueden organizar como una tabla, con entradas debajo de los respectivos reactivos y productos en la ecuación química. Podrá verificar los cálculos adicionales de la masa del producto.
| 3 Fe | + 2 O 2 → | 1 Fe 3 O 4 | |
|---|---|---|---|
| m (g) | 205.5 | 78.5 | 284.0 |
| M (g/mol) | 55.845 | 32.0 | 231.54 |
| n (mol) | 3.68 | 2.45 | 1.23 |
Ejemplo 4
Señalamos anteriormente que cuando se pulpule el hierro en presencia de vapor de agua, se puede producir una gama de productos desde Fe 3 O 4 hasta Fe 2 O 3 (roya común). Preparar una tabla similar a la anterior para la reacción en la que 0.200 g de Fe se convierten en Fe 2 O 3.
Solución
Primero, escribe una ecuación equilibrada
2 Fe + 3 H 2 O → Fe 2 O 3 + 3 H 2 El problema da la masa de Fe. Pensando en el problema antes de intentar resolverlo, nos damos cuenta de que la masa molar de Fe podría ser utilizada para calcular la cantidad de Fe consumida. Entonces necesitamos una relación estequiométrica para obtener la cantidad de O 2 consumida y la cantidad de Fe 2 O 3 y H 2 producida. Finalmente, las masas molares de O 2, Fe 2 O 3 y H 2 permiten calcular la masa de O 2, Fe 2 O 3 y H 2.
Podríamos comenzar la tabla ingresando la masa dada, y las masas molares que calculamos a partir de tablas de peso atómico:
| 2 Fe | + 3 H 2 O → | 2 Fe 2 O 3 | + 3 H 2 | |
|---|---|---|---|---|
| m (g) | 0.200 | |||
| M (g/mol) | 55.845 | 32.0 | 159.69 | 2.016 |
| n (mol) |
Ahora podemos calcular la cantidad de Fe presente:
\[\text{n (mol)}~~ = ~~\frac{\text{m (g)}}{\text{M (g/mol)}}\]\[\text{n (mol)} ~~=~~\frac{\text{0.200 g Fe}}{\text{55.847 g/mol}}~~=~~\text{0.00358 mol Fe}\]
Luego se utilizan las relaciones estequiométricas para calcular las cantidades de agua y productos:
\[\text{S}\left( \frac{\text{H}_{\text{2}}\text{O}}{\text{Fe}} \right)=\frac{\text{3 mol H}_{\text{2}}\text{O}}{\text{2 mol Fe}}\]
Por lo que la cantidad de agua requerida es
0.00358 mol Fe x (3 mol H 2 O/2 mol Fe) = 0.00537 mol H 2 O
De igual manera, utilizamos la relación estequiométrica para calcular la cantidad de producto:
\[\text{S}\left( \frac{\text{Fe}_{\text{2}}\text{O}_{3}}{\text{Fe}} \right)=\frac{\text{1 mol Fe}_{\text{2}}\text{O}_{3}}{\text{2 mol Fe}}\]
Por lo que la cantidad de Fe 2 O 3 producida es
0.00358 mol Fe x (1 mol Fe 2 O 3/2 mol Fe) = 0.00179 mol Fe 2 O 3.
La cantidad de H 2 producida debe ser la misma que la cantidad de agua consumida, ya que están en la proporción 3:3 de la ecuación.
Podemos agregar estos a la tabla:
| 2 Fe | + 3 H 2 O → | 2 Fe 2 O 3 | + 3 H 2 | |
|---|---|---|---|---|
| m (g) | 0.200 | |||
| M (g/mol) | 55.845 | 32.0 | 159.69 | 2.016 |
| n (mol) | 0.00358 | 0.00537 | 0.00179 | 0.00537 |
Finalmente, podemos usar las masas molares para convertir de cantidades (en moles) a masas (en g):
| 2 Fe | + 3 H 2 O → | 2 Fe 2 O 3 | + 3 H 2 | |
|---|---|---|---|---|
| m (g) | 0.200 | 0.097 | 0.286 | 0.0108 |
| M (g/mol) | 55.845 | 18.015 | 159.69 | 2.016 |
| n (mol) | 0.00358 | 0.00537 | 0.00179 | 0.00537 |
Obsérvese que la suma de las masas de reactivos es igual a la suma de las masas de los productos.
Referencias
- es.wikipedia.org/wiki/Joseph_Proust
- es.wikipedia.org/wiki/Claude_Louis_Berthollet
- http://encyclopedia2.thefreedictionary.com/Daltonides+and+Berthollides
- J.P. Suchet, Daltonides, bertollidas y vidrios inorgánicos”; Journal of Non-Crystalline Solids, V.6, #4, (1971) 370-392
- www.sciencedirect.com/science... 5&searchtype=a
- es.wikipedia.org/wiki/Compuesto no estequiométrico_no
- es.wikipedia.org/wiki/Sulfuro de cobre
- jap.aip.org/resource/1/japiau... sauthorized=no




