3.2.2: Medio Ambiente- Eficiencia Atómica y Premio Presidencial de Química Verde 2006
- Page ID
- 75989
Los Premios Presidenciales del Desafío de Química Verde [1] comenzaron en 1995 como un esfuerzo para reconocer a individuos y empresas por innovaciones en química verde.

Réplica de reloj IWC Normalmente se otorgan cinco premios cada año, uno en cada una de cinco categorías: Académico, Pequeñas Empresas, Caminos Sintéticos Más Verdes, Condiciones de Reacción Más Verdes y Diseño de Productos Químicos Más Verdes. Un comité de la American Chemical Society selecciona a los premiados. Hasta 2006, un total de 57 tecnologías han sido reconocidas para el premio, y se han presentado más de 1000 nominaciones.
El propilenglicol es un reemplazo potencial para el etilenglicol tóxico en anticongelantes utilizados en automóviles, sistemas de calefacción solar y deshielo de alas de aviones. También se utiliza como solvente en productos farmacéuticos, o como humectante en cosméticos, así como el ingrediente principal en barras desodorantes, en máquinas de niebla, y una multitud de otros usos.
Es una sustancia química industrial lo suficientemente importante que el Premio Presidencial de Química Verde 2006 fue otorgado al profesor Galen J. Suppes de la Universidad de Missouri/Columbia por una síntesis mejorada.
El propilenglicol se sintetiza en el laboratorio por oxidación de propileno (CH 2 CHCH 3, ver Figura anterior) con permanganato de potasio:
\[3 \ce{CH_2CHCH_3} + 2 \ce{KMnO_4} + 4 \ce{H_2O} \rightarrow 3 \ce{HO-CH_2-CHOH-CH_3} + 2 \ce{MnO_2} + 2 \ce{KOH} \label{1} \]
Esto se considera una síntesis “buena”, ya que convierte casi todo el material de partida en el producto deseado. Pero ambiental (y económicamente) es extremadamente indeseable, por varias razones. Utiliza un producto petroquímico no renovable como reactivo, utiliza un agente oxidante costoso (KMnO 4), produce un fuerte cáustico (KOH) como producto y un subproducto indeseable (MnO 2). Tiene una ventaja: Se procede a bajas temperaturas.
Estequiometría
Abreviemos la ecuación\(\ref{1}\) simbolizando propileno como P y propilenglicol como PG para facilitar la discusión:
\[\ce{3 P + 2 KMnO_4 + 4 H_2O \rightarrow 3 PG + 2 MnO_2 + 2 KOH} \label{1a} \]
Una ecuación química equilibrada como la Ecuación (1) anterior no solo indica cuántas moléculas de cada tipo están involucradas en una reacción, también indica la cantidad de cada sustancia que está involucrada. La ecuación (1) dice que 3 moléculas de propileno (P) reaccionan con 2 KMnO 4 unidades de fórmula y 4 moléculas H 2 O para dar 3 moléculas de propilenglicol (PG), 2 unidades de fórmula de MnO 2 y 2 unidades de fórmula de KOH . Aquí utilizamos el término “unidad de fórmula” en los casos en que las sustancias no son necesariamente moléculas, sino iónicas u otras especies.
La ecuación también dice que 3 mol de P reacciona con 2 mol de KMnO 4 y 4 mol de agua produciendo 2 mol de PG, 2 mol de MnO 2 y 2 mol de KOH.
Sin embargo, la ecuación equilibrada hace más que esto. También nos dice que 2 × 3 = = 6 mol P reaccionará con 2 x 2 = 4 mol KMnO 4 y 2 x 4 = 8 mol de agua, y que ½ × 3 = 1.5 mol P requiere solo ½ × 2 =1 mol KMnO 4 y ½ × 4 = 2 mol de H 2 O. En otras palabras, la ecuación indica que exactamente 4 mol H 2 O deben reaccionar por cada 3 mol de P y 2 mol de KMnO 4 consumidos. A los efectos de calcular cuánto KMnO 4 se requiere para reaccionar con una cierta cantidad de P, por lo tanto, la información significativa contenida en la Ecuación\(\ref{1}\) es la relación
\[\dfrac{\text{2 mol KMnO}_{\text{4}}}{\text {3 mol P}} \nonumber \]
Llamaremos a tal relación derivada de una ecuación química balanceada una relación estequiométrica y le daremos el símbolo S. Así, para Ecuación\(\ref{1}\),
\[\text{S}\left( \frac{\text{KMnO}_{\text{4}}}{\text{P}} \right)=\frac{\text{2 mol KMnO}_{\text{4}}}{\text{3 mol P}} \label{2} \]
La palabra estequiométrica proviene de las palabras griegas estequión, “elemento “y metron, “medida “. De ahí que la relación estequiométrica mide un elemento (o compuesto) contra otro.
Derivar todas las relaciones estequiométricas posibles de la Ecuación\(\ref{1}\).
Solución
Cualquier relación de cantidades de sustancia dada por los coeficientes en la ecuación puede ser utilizada:
\[\text{S}\left( \frac{\text{KMnO}_{4}}{\text{H}_{\text{2}}\text{O}} \right)=\frac{\text{2 mol KMnO}_{4}}{\text{4 mol H}_{\text{2}}\text{O}} \nonumber \]
\[\text{S}\left( \frac{\text{H}_{\text{2}}\text{O}}{\text{P}} \right)=\frac{\text{4 mol H}_{\text{2}}\text{O}}{\text{2 mol P}}\nonumber \]
\[\text{S}\left( \frac{\text{KMnO}_{4}}{\text{P}} \right)=\frac{\text{2 mol KMnO}_{4}}{\text{3 mol P}}\nonumber \]
\[\text{S}\left( \frac{\text{H}_{\text{2}}\text{O}}{\text{MnO}_{\text{2}}} \right)=\frac{\text{4 mol H}_{\text{2}}\text{O}}{\text{2 mol MnO}_{\text{2}}}\nonumber \]
\[\text{S}\left( \frac{\text{KMnO}_{4}}{\text{MnO}_{\text{2}}} \right)=\frac{\text{2 mol KMnO}_{4}}{\text{2 mol MnO}_{\text{2}}}\nonumber \]
\[\text{S}\left( \frac{\text{P}}{\text{H}_{\text{2}}\text{O}} \right)=\frac{\text{3 mol P}}{\text{4 mol H}_{\text{2}}\text{O}}\nonumber \]
Hay varias relaciones estequiométricas más, ya que pueden vincular cualquier reactivo a cualquier otro reactivo, cualquier reactivo a cualquier producto, o cualquier producto a cualquier otro producto. Cuando ocurre alguna reacción química, las cantidades de sustancias consumidas o producidas están relacionadas por las proporciones estequiométricas apropiadas. Usando la Ecuación\ ref {1} como ejemplo, esto significa que la relación de la cantidad de KMnO 4 consumida a la cantidad de propileno (P) consumida debe ser la relación estequiométrica S (KMnO 4 /P):
\[\frac{n_{\text{KMnO}_{\text{4}}\text{ consumed}}}{n_{\text{P consumed}}} = \text{S}\left( \frac{\text{KMnO}_{\text{4}}}{\text{P}} \right)=\frac{\text{2 mol KMnO}_{\text{4}}}{\text{3 mol P}} \nonumber \]
De igual manera, la relación entre la cantidad de MnO 2 producida y la cantidad de P consumida debe ser S (MnO 2 /P):
\[\frac{n_{\text{MnO}_{\text{2}}\text{ produced}}}{n_{\text{P consumed}}} = \text{S}\left( \frac{\text{MnO}_{\text{2}}}{\text{P}} \right) = \frac{\text{2 mol MnO}_{\text{2}}}{\text{3 mol P}} \nonumber \]
En general podemos decir que
\ (\ text {Relación estequiométrica}\ left (\ frac {\ text {X}} {\ text {Y}}\ derecha) =\ frac {\ text {cantidad de X consumida o producida}} {\ texto {cantidad de Y consumida o producida}}\ texto {(3}\ texto {a)}\ nonumber\]
o, en símbolos,
\[\text{S}\left( \frac{\text{X}}{\text{Y}} \right)=\frac{n_{\text{X consumed or produced}}}{n_{\text{Y consumed or produced}}}\text{ (3}\text{b)} \nonumber \]
Nótese que en la palabra Ecuación\ ref {3a} y la Ecuación simbólica\ ref {3b}, X e Y pueden representar cualquier reactivo o cualquier producto en la ecuación química equilibrada de la que se derivó la relación estequiométrica. No importa la cantidad de cada reactivo que tengamos, las cantidades de reactivos consumidos y las cantidades de productos producidos estarán en proporciones estequiométricas apropiadas.
Si se consumen 3.68 moles de propileno (P) de acuerdo con la Ecuación\ ref {1}, encuentre las cantidades de (a) permanganato de potasio (KMnO 4) requeridas, y las cantidades de
- propilenglicol, PG y
- MnO 2 producido (suponiendo que haya mucho del otro reactivo, hay agua disponible).
Solución
a. La cantidad de KMnO 4 requerida debe estar en la relación estequiométrica S (KMnO 4/P) a la cantidad de propileno consumido:
\[\text{S}\left( \frac{\text{KMnO}_{4}}{\text{P}} \right) = \frac{n_{\text{KMnO}_{\text{4 consumed}}}}{n_{\text{P consumed}}} \nonumber \]
Multiplicando ambos lados n P consumidos, por tenemos\(n_{\text{KMnO}_{\text{4 consumed}}} = n_{\text{P consumed}}\times \text{S}\left( \frac{\text{KMnO}_{4}}{\text{P}} \right) = \text{3}\text{.68 mol P}\times \frac{\text{2 mol KMnO}_{4}}{\text{3 mol P}}=\text{2}\text{.45 mol KMnO}_{4}\)
b. La cantidad de propilenglicol producida debe estar en la relación estequiométrica S (PG/P) a la cantidad de propileno consumido:
\[\text{S}\left( \frac{\text{PG}}{\text{P}} \right)=\frac{n_{\text{PG produced}}}{n_{\text{P consumed}}} \nonumber \]
Multiplicando ambos lados n P consumidos, por tenemos
\[n_{\text{PG produced}}=n_{\text{P consumed}}\times \text{S}\left( \frac{\text{PG}}{\text{P}} \right) = \text{3}\text{.68 mol P}\times \frac{\text{3 mol PG}}{\text{3 mol P}}=\text{3}\text{.68 mol PG} \nonumber \]
c. De igual manera, la cantidad de MnO 2 producida debe estar en la relación estequiométrica S (MnO 2/P) a la cantidad de propileno consumido:
\[\text{S}\left( \frac{\text{MnO}_{2}}{\text{P}} \right) = \frac{n_{\text{MnO}_{\text{2 produced}}}}{n_{\text{P consumed}}} \nonumber \]
Multiplicando ambos lados n P consumidos, por tenemos
\[n_{\text{MnO}_{\text{2 produced}}} = n_{\text{P consumed}}\times \text{S}\left( \frac{\text{MnO}_{2}}{\text{P}} \right) = \text{3}\text{.68 mol P}\times \frac{\text{2 mol MnO}_{2}}{\text{3 mol P}}=\text{2}\text{.45 mol MnO}_{2} \nonumber \]
Estos cálculos se pueden organizar como una tabla, con entradas debajo de los respectivos reactivos y productos en la ecuación química. Podrá verificar los cálculos adicionales.
| 3 CH 2 CHCH 3 | + 2 kmNo 4 | + 4 H 2 O → | 3 CH 2 (OH) CH (OH) CH 3 | + 2 MnO | + 2 KOH | |
|---|---|---|---|---|---|---|
| n (mol) | 3.68 | 2.45 | 4.91 | 3.68 | 2.45 | 2.45 |
Esta es una ilustración típica del uso de una relación estequiométrica como factor de conversión. El Ejemplo 2 es análogo a los Ejemplos 1 y 2 de Factores y Funciones de Conversión, donde se empleó densidad como factor de conversión entre masa y volumen. El Ejemplo 2 también es análogo a los Ejemplos 2.4 y 2.6, en los que se utilizaron como factores de conversión la constante de Avogadro y la masa molar. Como en estos casos anteriores, no hay necesidad de memorizar o hacer manipulaciones algebraicas con la Ecuación\ ref {3} cuando se utiliza la relación estequiométrica. Simplemente recuerde que los coeficientes en una ecuación química equilibrada dan proporciones estequiométricas, y que la elección adecuada da como resultado la cancelación de unidades. En forma de hoja de ruta
\[\text{amount of X consumed or produced}\overset{\begin{smallmatrix} \text{stoichiometric} \\ \text{ ratio X/Y} \end{smallmatrix}}{\longleftrightarrow}\text{amount of Y consumed or produced} \nonumber \]
o simbólicamente.
\[n_{\text{X consumed or produced}}\text{ }\overset{S\text{(X/Y)}}{\longleftrightarrow}\text{ }n_{\text{Y consumed or produced}} \nonumber \]
Al usar relaciones estequiométricas, asegúrese de indicar siempre moles de qué. Sólo se pueden cancelar moles de la misma sustancia. Es decir, 1 mol KMnO 4 cancela 1 mol KMnO 4 pero no cancela 1 mol H 2 O.
Masas de Reactivos y Productos
También podemos calcular las masas de reactivos y productos. Las masas molares se pueden determinar a partir de las fórmulas, y las masas se calculan de la siguiente manera:
m (g) = n (mol) x M (g/mol)
Para KMnO 4,
m kmNo 4 = n kmNo 4 x M kmNo 4
m KMnO 4 = 2.45 mol x 158.03 g/mol = 387.17 g
Este resultado se agrega a la siguiente tabla, y es posible que desee ver si puede verificar los otros resultados en la tabla.
| 3 CH 2 CHCH 3 | + 2 kmNo 4 | + 4 H 2 O → | 3 CH 2 (OH) CH (OH) CH 3 | + 2 MnO | + 2 KOH | |
|---|---|---|---|---|---|---|
| n (mol) | 3.68 | 2.45 | 4.91 | 3.68 | 2.45 | 2.45 |
| M (g/mol) | 42.08 | 158.03 | 18.02 | 76.10 | 86.94 | 56.11 |
| m (g) | 155 | 387 | 88.47 | 280 | 213 | 138 |
Economía Atom
Observe que parece haber un montón de cosas extrañas en esta síntesis. Requiere 387 g de KMnO 4, pero eso resulta únicamente en la adición de dos grupos -OH a cada molécula de propileno (y pueden provenir, en parte, de H 2 O).
Como medida de esta ineficiencia, Barry trost desarrolló el concepto de economía atómica, y por esta obra recibió el Premio Presidencial Green Chemistry Challenge en 1998 [2]. La economía porcentual de átomos se define como
\[\text{% atom economy} = \dfrac{\text{mass of atoms utilized}}{\text{mass of all reactant atoms}} \times 100\% \label{atomecon}\]
Entonces vemos que la masa de reactivos que realmente terminan en productos es de 155 g (3.68 mol) de propileno y 125.2 g de grupos OH (2 x 3.68 mol, o 7.36 mol, con una masa molar de 17.01 g/mol OH), para un total de 280 g La masa de todos los reactivos es
155 g + 387 g + 88,5 g = 630 g,
así que el porcentaje de eficiencia atómica es (vía Ecuación\ ref {atomecon})
\[\text{% atom economy} = \dfrac{280 g}{630 g} x 100% = 44.4% \nonumber\]
Vemos que en esta síntesis se desperdician muchos átomos. A modo de comparación, veamos varios procesos industriales que se han desarrollado.
El sistema del profesor Suppes que ganó el Green Chemistry Award combina un nuevo catalizador de cobre-cromita para convertir la glicerina en propilenglicol. En primer lugar, utiliza un subproducto de la síntesis de biodiesel, la glicerina (más que el propileno utilizado anteriormente, que proviene del petróleo). Segundo, utiliza un catalizador, que no se consume en una reacción química y por lo tanto no reduce la economía atómica. Finalmente, este proceso utiliza una temperatura y una presión más bajas que los sistemas anteriores (428 °F frente a 500 °F y <145 psi versus >2,170 psi), y produce menos subproducto que los catalizadores similares [3].
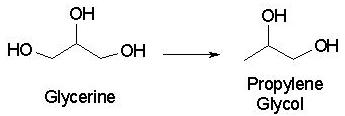
La síntesis de propilenglicol a partir de glicerina
La reacción implica deshidratación (eliminación de -H y -OH, o H 2 O) de glicerina, (produciendo 2,3-dihidroxipropeno o 3-hidroxipropanal) seguido de hidrogenación del doble enlace resultante para dar el producto final. La ecuación general para la reacción es
\[\ce{H2 + HO-CH2CH(OH)CH2OH → HO-CH2-CHOH-CH3 + H2O } \label{4} \]
Calcular la masa de hidrógeno que se requiere para reaccionar con 100 g de glicerina, y las masas de propilenglicol y agua que resultan en la Síntesis Suppes Green de propilenglicol.
Solución
Primero, iniciaremos el mismo tipo de tabla que usamos anteriormente, pero comenzaremos con la información que tenemos: la masa de glicerina, y las masas molares que podemos calcular a partir de fórmulas:
| HO-CH 2 CH (OH) CH 2 OH | + H 2 → | CH 2 (OH) CH (OH) CH 3 | + H 2 O | |
|---|---|---|---|---|
| M (g/mol) | 92.1 | 2.02 | 76.10 | 18.02 |
| m (g) | 100 | |||
| n (mol) |
Sabemos que la estequiometría de la reacción involucra las cantidades de reactivos y productos, no sus masas, por lo que convertiremos cada masa en una cantidad. Por ejemplo, la cantidad de glicerina es:
\[\begin{align*} n(mol) &= \dfrac{m(g)}{M\, (g/mol)} \\[4pt] &= \dfrac{100\, g}{92.1\, g/mol} \\[4pt] &= 1.09\, mol \end{align*} \]
| HO-CH 2 CH (OH) CH 2 OH | + H 2 → | CH 2 (OH) CH (OH) CH 3 | + H 2 O | |
|---|---|---|---|---|
| M (g/mol) | 92.1 | 2.02 | 76.10 | 18.02 |
| m (g) | 100 | |||
| n (mol) | 1.09 |
Podemos calcular fácilmente las otras cantidades, porque las relaciones estequiométricas son todas 1. Entonces, para la cantidad de hidrógeno consumido:
\[\text{n}_{\text{H}_{2}} = \text{n}_{\text{HO-CH}_{2}\text{CH(OH)CH}_{2}\text{OH}} ~x~\frac{\text{1 mol H}_{2}}{\text{1 mol HO-CH}_{2}\text{CH(OH)CH}_{2}\text{OH}} \nonumber \]
\[\text{n}_{\text{H}_{2}} = \text{1.09 mol} ~x~\frac{\text{1 mol H}_{2}}{\text{1 mol HO-CH}_{2}\text{CH(OH)CH}_{2}\text{OH}} = 1.09 mol \nonumber \]
| HO-CH 2 CH (OH) CH 2 OH | + H 2 → | CH 2 (OH) CH (OH) CH 3 | + H 2 O | |
|---|---|---|---|---|
| M (g/mol) | 92.1 | 2.02 | 76.10 | 18.02 |
| m (g) | 100 | |||
| n (mol) | 1.09 | 1.09 | 1.09 | 1.09 |
Ahora podemos usar las cantidades para calcular las masas de los otros reactivos y productos, recordando que
m (g) = n (mol) x M (g/mol).
Entonces, para el hidrógeno,
m H 2 = 1.09 mol x 2.02 g/mol = 2.20 g.
Verifique las otras entradas de la tabla:
| HO-CH 2 CH (OH) CH 2 OH | + H 2 → | CH 2 (OH) CH (OH) CH 3 | + H 2 O | |
|---|---|---|---|---|
| M (g/mol) | 92.1 | 2.02 | 76.10 | 18.02 |
| m (g) | 100 | 2.20 | 83.0 | 19.6 |
| n (mol) | 1.09 | 1.09 | 1.09 | 1.09 |
Ahora podemos calcular el porcentaje de economía atómica para este proceso:
% economía de átomos =\(\frac{mass ~of ~atoms ~utilized}{mass ~of~all ~reactant ~atoms} x 100%\)
Todos los átomos en los reactivos excepto un átomo de oxígeno que se elimina de la glicerina. Dado que tenemos 1.09 mol de glicerina, la masa de oxígeno no incorporado al producto es de 1.09 mol O x 15.999 g/mol O = 17.44 g O. La masa de reactivos utilizados es por lo tanto de 100 g - 17.44 g = 82.56 g, y la masa de producto formado es de 83.0 g.
porcentaje de economía de átomos =\(\frac{82.56}{83.0} ~x~ 100% = 99.5%\)
No solo eso, sino que el producto, el agua, es inocuo, ¡y usa un reactivo sobreproducido! El costo principal es calentar y presurizar el reactor.
¿Qué masa de oxígeno se consumiría cuando se queme 3.3 × 10 15 g, 3.3 Pg (petagramas), de octano (C 8 H 18) para producir CO 2 y H 2 O?
Solución
Primero, escribe una ecuación balanceada
\[\ce{2C8H18 + 25O2 → 16CO2 + 18H2O} \nonumber \]
El problema da la masa de C 8 H 18 quemada y pide la masa de O 2 requerida para combinar con ella. Pensando el problema antes de intentar resolverlo, nos damos cuenta de que la masa molar de octano podría usarse para calcular la cantidad de octano consumido. Entonces necesitamos una relación estequiométrica para obtener la cantidad de O 2 consumida. Finalmente, la masa molar de O 2 permite el cálculo de la masa de O 2. Simbólicamente
\[m_{\text{C}_{\text{8}}\text{H}_{\text{18}}}\text{ }\xrightarrow{M_{\text{C}_{\text{8}}\text{H}_{\text{18}}}}\text{ }n_{\text{C}_{\text{8}}\text{H}_{\text{18}}}\text{ }\xrightarrow{S\text{(SO}_{\text{2}}\text{/C}_{\text{8}}\text{H}_{\text{18}}\text{)}}\text{ }n_{\text{O}_{\text{2}}}\xrightarrow{M_{\text{O}_{\text{2}}}}\text{ }m_{\text{O}_{\text{2}}} \nonumber \]
\[m_{\text{O}_{\text{2}}}=\text{3}\text{.3 }\times \text{ 10}^{\text{15}}\text{ g }\times \text{ }\frac{\text{1 mol C}_{\text{8}}\text{H}_{\text{18}}}{\text{114 g}}\text{ }\times \text{ }\frac{\text{25 mol O}_{\text{2}}}{\text{2 mol C}_{\text{8}}\text{H}_{\text{18}}}\text{ }\times \text{ }\frac{\text{32}\text{.00 g}}{\text{1 mol O}_{\text{2}}}=\text{1}\text{.2 }\times \text{ 10}^{\text{16}}\text{ g } \nonumber \]
Así se necesitarían 12 Pg (petagramas) de O 2. La gran masa de oxígeno obtenida en este ejemplo es una estimación de cuánto O 2 se elimina de la atmósfera terrestre cada año por las actividades humanas. El octano, un componente de la gasolina, fue elegido para representar carbón, gas y otros combustibles fósiles. Afortunadamente, la masa total de oxígeno en el aire (1.2 × 10 21 g) es mucho mayor que el consumo anual. Si fuéramos a seguir quemando combustible al ritmo actual, tardaríamos unos 100 000 años en agotar todo el O 2. ¡En realidad vamos a consumir los combustibles fósiles mucho antes de eso! Una de las menos preocupaciones ambientales es quedarse sin oxígeno atmosférico.
Referencias
- www.epa.gov/greenchemistry/pu... c/presgcc.html
- es.wikipedia.org/wiki/Química Verde
- Lekha Charan Meher†, Rajesh Gopinath, S. N. Naik y Ajay K. Dalai. Ind. Ing. Chem. Res., 2009, 48 (4), pp 1840—1846


