3.2.3: Vida cotidiana- Por qué las grasas no suman las etiquetas de nutrición alimentaria
- Page ID
- 75955
Ecuaciones y relaciones de masas en la vida cotidiana
Si eres observador y prestas atención a las etiquetas nutricionales en los alimentos, es posible que hayas notado etiquetas como la de aquí, donde las grasas no parecen sumar.
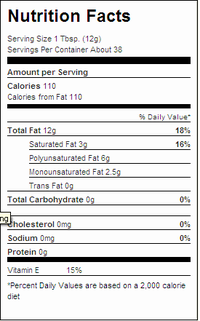
Si una porción de 12 g de Crisco ® contiene 3 g de grasa saturada, 0g de grasa trans, 6 g de grasa poliinsaturada y 2.5 g de grasa monoinsaturada [1] ¿qué pasó con los 0.5 g de grasa faltantes? 3 g + 0 g + 6 g + 2.5 g = 11.5 g!
En muchos casos hay una disparidad mayor que esta. Las grasas no suman [2] porque el peso del glicerol no está incluido en los componentes enumerados por separado. Los ácidos grasos trans ahora son reconocidos como un importante factor de riesgo dietético para enfermedades cardiovasculares, y la FDA de Estados Unidos ha revisado los requisitos de etiquetado de alimentos para incluir las grasas trans. [3]
¿Las empresas nos están jalando la lana sobre los ojos? Para entender lo que está pasando, necesitamos investigar la naturaleza de las grasas y aceites vegetales, que son triglicéridos.
Triglicéridos
Las grasas y aceites vegetales son todos triglicéridos, los cuales contienen una “cadena principal” de glicerol ( ) de tres carbonos con 3 “ácidos grasos” de cadena larga unidos a través de enlaces éster, como en la siguiente figura. La forma real se muestra en el modelo Jmol, que se puede girar con el ratón. Los triglicéridos se llaman “grasas” cuando son sólidos o semisólidos, y “aceites” cuando son líquidos.
) de tres carbonos con 3 “ácidos grasos” de cadena larga unidos a través de enlaces éster, como en la siguiente figura. La forma real se muestra en el modelo Jmol, que se puede girar con el ratón. Los triglicéridos se llaman “grasas” cuando son sólidos o semisólidos, y “aceites” cuando son líquidos.
|
Un triglicérido, insaturado en general, con la “cadena principal” de glicerol a la izquierda, y ácido palmítico saturado, ácido oleico monoinsaturado y ácido alfa-linolénico poliinsaturado. La forma de los ácidos no se representa con precisión.
|
Los ácidos grasos de cadena larga pueden estar saturados con átomos de hidrógeno, en cuyo caso tienen todos los enlaces simples como el ácido graso superior en la Figura (que es ácido palmítico). Si tienen menos átomos de hidrógeno, son insaturados y tienen dobles enlaces como el ácido graso medio en la Figura (que es ácido oleico). El ácido graso inferior es poliinsaturado, con múltiples dobles enlaces (es ácido linolénico). Varios aceites de cocina tienen |concentraciones conocidas de ácidos grasos saturados e insaturados.
A partir de 2010, Crisco consiste en una mezcla de aceite de soja, aceite de semilla de algodón completamente hidrogenado y aceites de soja y algodón parcialmente hidrogenados. Cada uno de estos aceites es una mezcla compleja de triglicéridos, todos con diferentes sustituyentes de ácidos grasos. (Hemos discutido los beneficios e inconvenientes de los aceites saturados e insaturados en otros lugares).
Un triglicérido se llamaría “insaturado” si contenía solo 1 ácido graso insaturado (y 2 insaturados), entonces, ¿cómo se puede reportar de manera confiable la cantidad real de ácidos grasos saturados e insaturados? Los triglicéridos tienen que descomponerse en sus ácidos grasos componentes, y la cantidad total de cada tipo (saturados, monoinsaturados y poliinsaturados) reportados por separado. Pero esto deja fuera el glicerol que resulta de la descomposición, como se muestra en la siguiente ecuación para el triglicérido que contiene 2 sustituyentes de ácido palmítico (P = C 16 H 32 O 2) y 1 ácido linolénico (L = C 18 H 30 O 2). El triglicérido puede abreviarse “GPPL” para glicerol (G) con 2 sustituyentes ácido palmítico y 1 ácido linolénico (L):
\[\ce{(C16H32O2)}\textbf{CH}_\textbf{2}\textbf{CH} \ce{(C16H32O2)}\textbf{CH}_\textbf{2}\ce{-(C18H30O2) + 3 H2O} \xrightarrow{\ce{NaOH}} \ce{1 C3H6O3 + 2 C16H32O2 + 1 C18H30O2} \nonumber \]
-
-
-
-
- GPPL + 3 H 2 O Glicerol + 2 P + 1 L (1)
-
-
-
A esto se le llama reacción de “hidrólisis”, porque el agua provoca la descomposición. El hidróxido de sodio (NaOH) escrito encima de la flecha indica que el NaOH es un catalizador, y no se consume ni se integra en los productos de la reacción química.
Esta ecuación química equilibrada puede decirnos a dónde ha ido la masa faltante de la etiqueta nutricional.
La ecuación no sólo dice cuántas moléculas de cada tipo están involucradas en una reacción, también indica la cantidad de cada sustancia que está involucrada, por lo que nos permitirá averiguar cuánta agua se consume y cuánta glicerina se produce, y esas explicarán las masas “faltantes” en el etiqueta nutricional.
La ecuación dice que 1 moléculas GPPL pueden reaccionar con 3 moléculas H 2 O para dar 1 molécula G, 2 moléculas P y 1 molécula L. También dice que 1 mol de GPPL reaccionaría con 3 mol H 2 O produciendo 1 mol G, 2 mol P, y 1 mol L.
Sin embargo, la ecuación equilibrada hace más que esto. También nos dice que 2 × 1 = 2 mol GPPL reaccionará con 2 × 3 = 6 mol H 2 O, para formar 2 × 1 = 2 mol G, y que ½ × 1 = 0.5 mol GPPL requiere solo ½ × 3 = 1.5 mol H 2 O. En otras palabras, la ecuación indica que exactamente 3 mol H 2 O deben reaccionar por cada 1 mol GPPL consumido, y por cada 1 mol de GPPL que se consume, se producirá 1 mol G, 2 mol P y 1 mol L. A los efectos de calcular cuánto H 2 O se requiere para reaccionar con una cierta cantidad de GPPL, la información significativa contenida en la Ec. (1) es la relación
\[\dfrac {\text {3 mol H}_{\text{2}}{\text{O}}} {\text {1 mol GPPL}} \nonumber \]
Llamaremos a tal relación derivada de una ecuación química balanceada una relación estequiométrica y le daremos el símbolo S. Así, para la Ec. (1),\(\text{S}\left( \frac{\text{H}_{\text{2}}\text{O}}{\text{GPPL}} \right)~=~\frac{\text{3 mol H}_{\text{2}}\text{O}}{\text{1 mol GPPL}\text{)}}\)
La palabra estequiométrica proviene de las palabras griegas estequión, “elemento “y metron, “medida “. De ahí que la relación estequiométrica mide un elemento (o compuesto) contra otro.
Derivar todas las relaciones estequiométricas posibles de la ecuación (1)
Solución
Cualquier relación de cantidades de sustancia dada por los coeficientes en la ecuación puede ser utilizada:
\[\text{S}\left( \frac{\text{GPPL}}{\text{G}} \right)=\frac{\text{1 mol GPPL}}{\text{1 mol G}}\]
\[\text{S}\left( \frac{\text{L}}{\text{P}} \right)=\frac{\text{1 mol L}}{\text{2 mol P}}\]
\[\text{S}\left( \frac{\text{GPPL}}{\text{P}} \right)=\frac{\text{1 mol GPPL}}{\text{2 mol P}}\]
\[\text{S}\left( \frac{\text{L}}{\text{H}_{\text{2}}\text{O}} \right)=\frac{\text{1 mol L}}{\text{3 mol H}_{\text{2}}\text{O}}\]
\[\text{S}\left( \frac{\text{P}}{\text{H}_{\text{2}}\text{O}} \right)=\frac{\text{2 mol P}}{\text{3 mol H}_{\text{2}}\text{O}}\]
\[\text{S}\left( \frac{\text{G}}{\text{H}_{\text{2}}\text{O}} \right)=\frac{\text{1 mol G}}{\text{3 mol H}_{\text{2}}\text{O}}\]
Cuando ocurre alguna reacción química, las cantidades de sustancias consumidas o producidas están relacionadas por las proporciones estequiométricas apropiadas. Usando la Ec. (1) como ejemplo, esto significa que la relación de la cantidad de H 2 O consumida a la cantidad de GPPL consumida debe ser la relación estequiométrica S (H 2 O/GPPL):
\(\frac{n_{\text{H}_{\text{2}}\text{O}\text{ consumed}}}{n_{\text{GPPL}\text{ consumed}}}\)\(=\text{S}\left( \frac{\text{H}_{\text{2}}\text{O}}{\text{GPPL}} \right)=\frac{\text{3 mol H}_{\text{2}}\text{O}}{\text{1 mol GPPL}}\)De igual manera, la relación entre la cantidad de G producida y la cantidad de GPPL consumida debe ser
S (G/GPPL):
\[\frac{n_{\text{G produced}}}{n_{\text{GPPL}\text{ consumed}}}~=~\text{S}\left( \frac{\text{G}}{\text{GPPL}} \right)=\frac{\text{1 mol G}}{\text{1 mol GPPL}}\]
En general podemos decir que
\[\text{Stoichiometric ratio }\left( \frac{\text{X}}{\text{Y}} \right)=\frac{\text{amount of X consumed or produced}}{\text{amount of Y consumed or produced}}\text{ (3}\text{a)}\]
o, en símbolos,
\[\text{S}\left( \frac{\text{X}}{\text{Y}} \right)=\frac{n_{\text{X consumed or produced}}}{n_{\text{Y consumed or produced}}}\text{ (3}\text{b)}\]
Nótese que en la palabra Ec. (3a) y la ecuación simbólica (3b), X e Y pueden representar cualquier reactivo o cualquier producto en la ecuación química equilibrada de la que se derivó la relación estequiométrica. No importa la cantidad de cada reactivo que tengamos, las cantidades de reactivos consumidos y las cantidades de productos producidos estarán en proporciones estequiométricas apropiadas.
Encuentre la cantidad de glicerol que se produce cuando se consumen 3.68 mol H 2 O de acuerdo con la Ec. (1).
(C 16 H 32 O 2) CH 2 CH (C 16 H 32 O 2) CH 2 - (C 18 H 30 O 2) + 3 H 2 O\(\xrightarrow{\text{NaOH}}\) 1 C 3 H 6 O 3 + 2 C 16 H 32 O 2 + 1 C 18 H 30 O 2
-
-
-
-
- GPPL + 3 H 2 O\(\xrightarrow{\text{NaOH}}\) Glicerol + 2 P + 1 L (1)
-
-
-
Solución
La cantidad de glicerol producida debe estar en la relación estequiométrica S (G/H 2 O) a la cantidad de agua consumida:
\[\text{S}\left( \frac{\text{G}}{\text{H}_{\text{2}}\text{O}} \right)=\frac{n_{\text{G produced}}}{n_{\text{H}_{\text{2}}\text{O consumed}}}\]
Multiplicando ambos lados n H 2 O consumidos, por tenemos
\[n_{\text{G}\text{O produced}}=n_{\text{H}_{\text{2}}\text{O}\text{ consumed}}\times \text{S}\left( \frac{\text{G}}{\text{H}_{\text{2}}\text{O}} \right)=\text{3}\text{.68 mol H}_{\text{2}}\text{O}\times \frac{\text{1 mol G}}{\text{3 mol H}_{\text{2}}\text{O}}=\text{1}\text{0.23 mol H}\]
Esta es una ilustración típica del uso de una relación estequiométrica como factor de conversión. El Ejemplo 2 es análogo a los Ejemplos 1 y 2 de Factores y Funciones de Conversión, donde se empleó densidad como factor de conversión entre masa y volumen. El Ejemplo 2 también es análogo a los Ejemplos 2.4 y 2.6, en los que se utilizaron como factores de conversión la constante de Avogadro y la masa molar. Al igual que en estos casos anteriores, no hay necesidad de memorizar o hacer manipulaciones algebraicas con la Ec. (3) cuando se utiliza la relación estequiométrica. Simplemente recuerde que los coeficientes en una ecuación química equilibrada dan proporciones estequiométricas, y que la elección adecuada da como resultado la cancelación de unidades. En forma de hoja de ruta\(\text{amount of X consumed or produced}\overset{\begin{smallmatrix} \text{stoichiometric} \\ \text{ ratio X/Y} \end{smallmatrix}}{\longleftrightarrow}\text{amount of Y consumed or produced}\) o simbólicamente. \(n_{\text{X consumed or produced}}\text{ }\overset{S\text{(X/Y)}}{\longleftrightarrow}\text{ }n_{\text{Y consumed or produced}}\)
Al usar relaciones estequiométricas, asegúrese de indicar siempre moles de qué. Sólo se pueden cancelar moles de la misma sustancia. Es decir, 1 mol NH 3 cancela 1 mol NH 3 pero no cancela 1 mol H 2 O
El siguiente ejemplo muestra que las relaciones estequiométricas también son útiles en problemas que involucran la masa de un reactivo o producto.
- Calcular la masa de glicerol (G) producida cuando se hacen reaccionar 3.84 mol de GPPL con H 2 O adecuado de acuerdo con la Ecuación (1).
- Demostrar que una etiqueta nutricional para esta grasa tendría grasas trans, insaturadas y poliinsaturadas que no suman a la grasa total.
Solución
El problema pide que calculemos la masa de glicerol producida. Como aprendimos en el Ejemplo 2 de La masa molar, la masa molar se puede utilizar para convertir de la cantidad de glicerol a la masa de glicerol. Por lo tanto este problema en efecto es pedir que calculemos la cantidad de glicerol producida a partir de la cantidad de GPPL consumida. Este es el mismo problema que en el Ejemplo 2. Requiere la relación estequiométrica
\[\text{S}\left( \frac{\text{G}}{\text{GPPL}} \right)=\frac{\text{1 mol G}}{\text{1 mol GPPL}}\]
La cantidad de glicerol, G, producida es entonces
\[n_{\text{G produced}}=n_{\text{GPPL consumed}}\text{ }\!\!\times\!\!\text{ conversion factor}=\text{3}\text{.84 mol GPPL}\times \frac{\text{1 mol G}}{\text{1 mol GPPL}}=\text{3}\text{.84 mol G}\]
La masa de glicerol, (G = C 3 H 6 O 3) es\(\text{m}_{\text{G}}~=~\text{3}\text{.84 mol G}\times \frac{\text{92}\text{.1 g G}}{\text{1 mol G}}=\text{354 g G}\) Con la práctica este tipo de problema se puede resolver en un solo paso concentrándose en las unidades. La relación estequiométrica apropiada convertirá moles de O 2 en moles de SO 2 y la masa molar convertirá moles de SO 2 en gramos de SO 2. Un mapa de ruta esquemático para el cálculo de un solo paso se puede escribir como\(n_{\text{G}} ~ \xrightarrow{S\text{(G}\text{/GPPL}\text{)}}~ n_{\text{G}}~\xrightarrow{M_{\text{G}}} ~ m_{\text{G}}\) Así\(\text{m}_{\text{G}}=\text{3}\text{.84 mol GPPL}\times ~ \frac{\text{1 mol G}}{\text{1 mol GPPL}} ~ \times ~ \frac{\text{92}\text{.1 g}}{\text{1 mol G}}=\text{354 g}\) Estos cálculos se pueden organizar como una tabla, con entradas debajo de los respectivos reactivos y productos en la ecuación química. Podrá verificar los cálculos adicionales.
| C 16 H 32 O 2) CH 2 CH (C 16 H 32 O 2) CH 2 - (C 18 H 30 O 2) GPPL |
+ 3 H 2 O | → C 3 H 6 O 3 G |
+ 2 C 16 H 32 O 2 P |
+ 1 C 18 H 30 O 2 L |
|
|---|---|---|---|---|---|
| m (g) | 3185 | 208 | 354 | 1969 | 1069 |
| M (g/mol) | 829.3 | 18.02 | 92.1 | 256.4 | 278.4 |
| n (mol) | 3.84 | 11.52 | 3.84 | 7.68 | 3.84 |
b. Cuando calculamos las masas de todos los reactivos y productos, obtenemos los resultados que se muestran en la tabla. En este caso, la masa total de grasa es de 3185 g, es una grasa mixta saturada (ácido palmítico) y poliinsaturada (ácido linolénico), que se degrada a 1969 g de grasa saturada y 1069 g de grasa poliinsaturada. Asumimos que no se produjeron grasas trans y no hay ácidos grasos monoinsaturados. Entonces la etiqueta tendría números proporcionales a:
| Grasa Total | 3185 |
| Grasas Saturadas | 1969 |
| Grasas Trans | 0 |
| Grasas no saturadas | 0 |
| Grasa poliinsaturada | 1069 |
Los componentes suman 3038 g, que es menor que la grasa total debido a que no se contabilizan la masa de glicerol (354 g) y agua (207.6).
Demostrar que el cálculo de la masa de agua requerida para reaccionar con 3.68 mol de GPPL en el ejemplo anterior es correcto.
Solución
Simbólicamente
\[n_{\text{GPPL}} ~ \xrightarrow{S\text{(H}_{\text{2}}\text{O}\text{/GPPL}\text{)}} ~ n_{\text{H}_{\text{2}}\text{O}}~\xrightarrow{M_{\text{H}_{\text{2}}\text{O}}} ~ m_{\text{H}_{\text{2}}\text{O}}\]
\[3.84 \text{mol GPPL}~\times~\frac{\text{3 mol H}_{\text{2}}\text{O}}{\text{1 mol GPPL}} ~ \times ~ \frac{\text{18}\text{.02 g}}{\text{1 mol H}_{\text{2}}\text{O}}=\text{208 g }\]
Referencias
- www.crisco.com/products/produ... =17&prodid=803
- Wolke, R. L. “Lo que Einstein le dijo a su cocinero”, W.W. Norton & Co., NY 2002, p. 72
- Plantilla:Cite journal


