3.3.2: Ambiente- TSP, estequiometría ecológica y floraciones de algas
- Page ID
- 75967
Floraciones de algas
Las floraciones de algas como las de las fotos de abajo pueden ser dañinas cuando las algas son tóxicas, o si reducen la concentración de oxígeno lo suficiente como para emperilizar a otros organismos. [1]. Las floraciones son visibles porque las concentraciones de algas pueden alcanzar millones de células por mililitro. Las floraciones a menudo resultan cuando se suministra un reactivo limitante al medio ambiente, ya sea de forma natural o a través de actividades humanas. Un reactivo limitante es uno de varios reactivos que son necesarios para que ocurra una reacción, pero que está presente en baja concentración, por lo que no se produce reacción aunque haya un exceso de todos los demás reactivos.
|
Floración de algas coccolítoforas en el mar de Bering en 1998 [2] |
Una “marea roja” que puede envenenar mariscos y causar enfermedades humanas o la muerte, causada por una especie dinoflagelada. [3] |
El reactivo limitante que impide el crecimiento incontrolado de algas suele ser el fósforo, y puede estar en bajas concentraciones debido a que las fuentes minerales de fosfato (“roca de fosfato”, como la apatita) son insolubles.
Roca Fosfato Solubilizante: H 3 PO 4
El fosfato a menudo limita el crecimiento de los cultivos alimentarios, por lo que producir fosfato soluble es un sector importante de la industria de fertilizantes. La escorrentía de los campos agrícolas suele ser la causa de las floraciones de algas.
La roca de fosfato se solubiliza para fertilizantes mediante tratamiento con ácido sulfúrico, dando ácido fosfórico y, como subproducto, yeso (CaSO 4 · 2 H 2 O utilizado en Yeso de París y “drywall”).
La reacción es:
- Ca 5 (PO 4) 3 Cl + 5 H 2 SO 4 + 10 H 2 O → 3 H 3 PO 4 + 5 CaSO 4 · 2 H 2 O + HCl
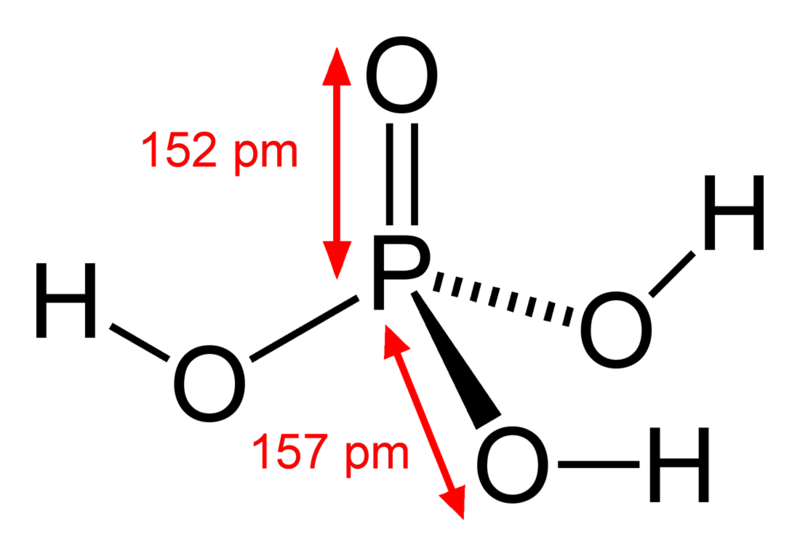
Ácido Fosfórico [4]
Reactivo limitante Ejemplo 1
EJEMPLO 1 Cuando 100.0 g de roca cloroapetita reaccionan con 100.0 g de ácido sulfúrico para formar ácido fosfórico y yeso, ¿cuál es el reactivo limitante? — Solución La ecuación equilibrada
- Ca 5 (PO 4) 3 Cl + 5 H 2 SO 4 + 2 H 2 O → 3 H 3 PO 4 + 5 CaSO 4 · 2 H 2 O + HCl
nos dice que según la teoría atómica, se requiere 1 mol Ca 5 (PO 4) 3 Cl por cada 5 moles de H 2 SO 4. Es decir, la relación estequiométrica S (Ca 5 (PO 4) 3 Cl /H 2 SO 4) = 1 mol Ca 5 (PO 4) 3 Cl/ 5 mol H 2 SO 4. Veamos cuántos moles de cada uno tenemos en realidad
\ (\ begin {align} & n_ {\ texto {Ca} _ _ {\ texto {5}}\ texto {(PO} _ {\ texto {4}}\ texto {)} _ {\ texto {3}}\ texto {Cl}} =\ texto {100}\ texto {.0 g}\ veces\ frac {\ texto {1 mol}} {\ texto {520}\ texto {.8 g}} =\ texto {0}\ texto {.192 mol Ca} _ _ {\ texto {5}}\ texto {(PO} _ {\ texto {4}}\ texto {)} _ {\ texto {3}}\ texto {Cl}\\ & n_ {\ texto {H} _ _ {\ texto {2}}\ texto {SO} _ _ {\ texto { 4}}} =\ texto {100}\ texto {.0 g}\ veces\ frac {\ texto {1 mol} _ {\ texto {2}}} {\ texto {98}\ texto {.1 g}} =\ texto {1}\ texto {.02 mol H} _ {\ texto {2}}\ texto {SO} _ _ {\ texto {4}} \\ end {align}) Si todo el H 2 SO 4 reaccionara, requeriría 1.02 mol H 2 SO 4 x (1 mol Ca 5 (PO 4) 3 Cl/5 mol H 2 SO 4) = 0.204 mol Ca 5 (PO 4) 3 Cl, pero solo 0.192 mol está presente. Entonces Ca 5 (PO 4) 3 Cl es el reactivo limitante, y todos los H 2 SO 4 no pueden reaccionar.
Cuando termine la reacción, 0.960 mol H 2 SO 4 habrá reaccionado con 0.192 mol Ca 5 (PO 4) 3 Cl y habrá (1.02 — 0.960) mol H 2 SO 4 = 0.06 mol H 2 SO 4 sobrante. Ca 5 (PO 4) 3 Cl es por lo tanto el reactivo limitante.
Estos cálculos se pueden organizar como una tabla, con entradas debajo de los respectivos reactivos y productos en la ecuación química. Se muestran cálculos para cada caso posible, asumiendo que un reactivo está completamente consumido y determinando si hay suficiente de los otros reactivos para consumirlo. Si no, ese escenario se descarta.
| Ca 5 (PO 4) 3 Cl | + 5 H 2 SO 4 | + 10 H 2 O → | 3 H 3 PO 4 | + 5 CASO 4 · 2 H 2 O | + HCl | |
|---|---|---|---|---|---|---|
| m (g) | 100 | 100 | ||||
| M (g/mol) | 521 | 98.1 | 18.0 | 98.0 | 172.2 | 36.5 |
| n (mol) | 0.192 | 1.02 | — | — | — | — |
| si todos los Ca 5 (PO 4) 3 Cl reaccionan | -0.192 | -0.960 | -1.92 | +0.576 | +0.960 | +0.192 |
Cantidades reales de reacción |
0.192 | 0.960 | 1.92 | 0.576 | 0.960 | 0.192 |
Masas de reacción reales |
100 | 94.2 | 34.2 | 56.5 | 165.2 | 7.0 |
A partir de este ejemplo se puede comenzar a ver qué hay que hacer para determinar cuál de dos reactivos, X o Y, es limitante. Debemos comparar la relación estequiométrica S (X/Y) con la relación real de cantidades de X e Y que inicialmente se mezclaron entre sí. En el Ejemplo 1 esta relación de cantidades iniciales\(\frac{n_{\text{Ca}_{\text{5}}\text{(PO}_{\text{4}}\text{)}_{\text{3}}\text{Cl}\text{(initial)}}}{n_{\text{H}_{\text{2}}\text{SO}_{\text{4}}}\text{(initial)}}=\frac{\text{0.192 mol Ca}_{\text{5}}\text{(PO}_{\text{4}}\text{)}_{\text{3}}\text{Cl}}{\text{1.02 mol H}_{\text{2}}\text{SO}_{\text{4}}}= \frac{\text{0.188 mol Ca}_{\text{5}}\text{(PO}_{\text{4}}\text{)}_{\text{3}}\text{Cl}}{\text{mol H}_{\text{2}}\text{SO}_{\text{4}} }\) fue menor que la relación estequiométrica\(\text{S}\left( \frac{\text{Ca}_{\text{5}}\text{(PO}_{\text{4}}\text{)}_{\text{3}}\text{Cl}}{\text{H}_{\text{2}}\text{SO}_{\text{4}}} \right)=\frac{\text{1 mol Ca}_{\text{5}}\text{(PO}_{\text{4}}\text{)}_{\text{3}}\text{Cl}}{\text{5 mol H}_{\text{2}}\text{SO}_{\text{4}}}= \frac{\text{0.200 mol Ca}_{\text{5}}\text{(PO}_{\text{4}}\text{)}_{\text{3}}\text{Cl}}{\text{mol H}_{\text{2}}\text{SO}_{\text{4}} }\) Esto indicó que no había suficiente Ca 5 (PO 4) 3 Cl para reaccionar con todos los H 2 SO 4 y Ca 5 (PO 4) 3 El Cl fue el reactivo limitante. La regla general correspondiente, para cualquier reactivo X e Y, es\ (\ begin {align} &\ text {If}\ frac {n_ {\ text {X}}\ text {(initial)}} {n_ {\ text {Y}}\ text {(initial)}}\ text {es menor que S}\ left (\ frac {\ text {X}} {\ text {Y}\ derecha)\ texto {, entonces X es limitante}\ texto {.}\\ &\ &\ texto {Si}\ frac {n_ {\ texto {X}}\ text {(initial)}} {n_ {\ text {Y}}\ text {(inicial)}}\ text {es mayor que S}\ left (\ frac {\ text {X}} {\ text {Y}}\ right)\ text {, entonces Y está limitando}\ text {.}\ \ end {align}\) (Por supuesto, cuando las cantidades de X y Y están exactamente en la relación estequiométrica, ambos reactivos se consumirán completamente al mismo tiempo, y tampoco está en exceso.). Esta regla general para determinar el reactivo limitante se aplica en el siguiente ejemplo.
Fosfato trisódico, TSP
El ácido fosfórico puede aplicarse como una solución fertilizante, o convertirse en fosfato trisódico (TSP), un sólido:
- H 3 PO 4 + 3 NaOH → 3 Na 3 PO 4 + 3 H 2 O
El TSP se utiliza como agente limpiador y desengrasante, y se utilizó ampliamente en detergentes domésticos en Estados Unidos hasta que sus efectos nocivos sobre el medio ambiente fueron apreciados en la década de 1970. [6]
Reactivos limitantes y estequiometría ecológica
Dado que la liberación de TSP y ácido fosfórico puede no controlarse en todos los países, y en todas las actividades, a menudo proporcionan una fuente de fósforo que es un reactivo limitante en la naturaleza debido a la baja solubilidad de los fosfatos minerales.
Como explicamos cuando discutimos la importancia de las fórmulas, la estequiometría ecológica examina la relación estequiométrica entre las demandas nutricionales de una especie y los alimentos disponibles para la especie. [7] [8]. Los proponentes aseguran que “la estequiometría ecológica reconoce que los propios organismos son resultado de reacciones químicas y así su crecimiento y reproducción pueden verse limitados por suministros de elementos químicos clave [especialmente carbono (C), nitrógeno (N) y fósforo (P)]”. [9]
Por ejemplo, al escribir una ecuación química aproximada para la fotosíntesis en algas oceánicas, podemos predecir qué nutrientes (nitrógeno como nitrato de potasio, KNO 3 -, fósforo como ácido fosfórico, H 3 PO 4 2 -, etc.) se requieren para crecimiento de algas y qué productos resultan de la respiración de algas.
106 CO 2 (g) + 16 KNO 3 (aq) + H 3 PO 4 (aq) + 122 H 2 O (l) + 16 H + (aq) ↔
C 106 H 263 O 110 N 16 P 1 (s) + 138 O 2 (g) + 16 K + (1)
La “fórmula” para las algas, (C 106 H 263 O 110 N 16 P 1) (M = 3553.259 g/mol) no representa una sola molécula, sino solo la composición general de las algas (se podría llamar una fórmula molecular “promedio”) [10].
El Ejemplo 4 de Ecuaciones y Relaciones de Masa también ilustra la idea de que un reactivo en una ecuación química puede consumirse completamente sin agotar todos los demás. En el medio ambiente, los reactivos económicos como el O 2 atmosférico a menudo se suministran en exceso. Alguna porción de dicho reactivo quedará inalterada después de la reacción. Por el contrario, al menos un reactivo suele consumirse completamente. Cuando se ha ido, los otros reactivos sobrantes no tienen nada con qué reaccionar y no se pueden convertir en productos. La sustancia que se agota primero es el reactivo limitante.
Reactivo limitante Ejemplo 2
EJEMPLO 2 En un experimento a pequeña escala para modelar la escorrentía de fertilizantes, el agua que contiene 10 g de H 3 PO 4 contamina un pequeño estanque que ya contiene 300 g de KNO 3. Si el estanque contiene algas estables que se forman de acuerdo con la ecuación anterior, y hay abundancia de CO 2 y otros reactivos disponibles, (a) ¿cuál es el reactivo limitante, y (b) cuántas algas pueden formar como resultado de la escorrentía?
Solución
a) La relación estequiométrica que conecta KNO 3 y H 3 PO 4 es
\(\text{S}\left( \frac{\text{KNO}_{\text{3}}}{\text{H}_{\text{3}}\text{PO}_{\text{4}}} \right)=\frac{\text{16 mol KNO}_{\text{3}}}{\text{1 mol H}_{\text{3}}\text{PO}_{\text{4}}} \)Las cantidades iniciales de KNO 3 y H 3 PO 4 se calculan utilizando las masas molares apropiadas\ (\ begin {align} &\ text {} n_ {\ text {KNO} _ {\ text {3}}\ text {(initial)} =\ text {300 g}\ times\ frac {\ text {1 mol KNO} _ {\ text {3}}} {\ text {101}\ text {.1 g}} =\ texto {2.96}\ texto { mol KNO} _ {\ texto {3}}\ &\ & n_ {\ texto {H} _ {\ texto {3}}\ texto {PO} _ {\ texto {4}}}\ texto {(inicial)} =\ texto {10}\ texto {.0 g}\ veces\ frac {\ texto {\ texto {1 mol H} _ {\ texto {3}}\ texto {PO} _ {\ texto {4}}} {\ texto {98,0 g}} =\ texto {0}\ texto {.102}\ texto {mol H} _ {\ text {3}}\ text {PO} _ {\ text {4}}\ \ end {align}\) Su relación es \(\frac{n_{\text{KNO}_{\text{3}}}\text{(initial)}}{n_{\text{H}_{\text{3}}\text{PO}_{\text{4}}}\text{(initial)}}=\frac{\text{2}\text{.96}\text{mol KNO}_{\text{3}}}{\text{0}\text{.102}\text{mol H}_{\text{3}}\text{PO}_{\text{4}}}=\frac{\text{29}\text{.0 mol KNO}_{\text{3}}}{\text{1 mol H}_{\text{3}}\text{PO}_{\text{4}}}\)Dado que esta relación es mayor que la relación estequiométrica, se tiene más que suficiente KNO 3 para reaccionar con todos los H 3 PO 4. H 3 PO 4 es el reactivo limitante, y primero querrás pedir más de él ya que se consumirá primero. b) La cantidad de producto formado en una reacción puede calcularse a través de una relación estequiométrica apropiada a partir de la cantidad de un reactivo que se consumió. Parte del exceso de reactivo KNO 3 quedará sobrante, pero se consumirá toda la cantidad inicial de H 3 PO 4. Por lo tanto utilizamos n H 3 PO 4 (inicial) para calcular la cantidad de algas que se pueden obtener\(n_{\text{H}_{\text{3}}\text{PO}_{\text{4}}}\text{ }\xrightarrow{S\text{(Algae/H}_{\text{3}}\text{PO}_{\text{4}}\text{)}}\text{ }n_{\text{Algae}}\xrightarrow{M_{\text{Algae}}}\text{ }m_{\text{Algae}}\)\(m_{\text{Algae}}=\text{0.102}\text{ mol H}_{\text{3}}\text{PO}_{\text{4}}\text{ }\times \text{ }\frac{\text{1 mol Algae}}{\text{1 mol H}_{\text{3}}\text{PO}_{\text{4}}}\text{ }\times \text{ }\frac{\text{3553 g}}{\text{mol Algae}}=\text{362 g Algae}\) Tenga en cuenta que solo 10 g de H 3 PO 4 permitieron el consumo de 456 g de dióxido de carbono para hacer 362 g de ¡Algas!
Estos cálculos se pueden organizar como una tabla, con entradas debajo de los respectivos reactivos y productos en la ecuación química. Se han omitido los H + y K +.
| 106 CO 2 | + 16 KNO 3 | + H 3 PO 4 | + 122 H 2 O ↔ | C 106 H 263 O 110 N 16 P 1 | + 138 O 2 | |
|---|---|---|---|---|---|---|
| m (g) | 300 | 10 | ||||
| M (g/mol) | 44 | 101.1 | 98.0 | 18.0 | 3553.259 | 32 |
| n (mol) presente | 2.96 | 0.102 | — | — | — | |
| si todos los H 3 PO 4 reaccionan | -1.63 | -0.102 | ||||
Cantidades reales de reacción |
-10.81 | -1.63 | -0.102 | -12.44 | +0.102 | +14.1 |
Masas de reacción reales |
-476 | -165 | -10 | -224 | 362 |
450 |
Como se puede ver en el ejemplo, en un caso donde haya un reactivo limitante, se debe utilizar la cantidad inicial del reactivo limitante para calcular la cantidad de producto formado. Usar la cantidad inicial de un reactivo presente en exceso sería incorrecto, ya que dicho reactivo no se consume del todo.
El concepto de reactivo limitante fue utilizado por el químico alemán del siglo XIX Justus von Liebig (1807 a 1873) para derivar una importante ley biológica y ecológica. La ley del mínimo de Liebig establece que la sustancia esencial disponible en la menor cantidad relativa a algún mínimo crítico controlará el crecimiento y reproducción de cualquier especie de vida vegetal o animal. Cuando un grupo de organismos se queda sin ese reactivo limitante esencial, las reacciones químicas necesarias para el crecimiento y la reproducción deben detenerse. Las vitaminas, proteínas y otros nutrientes son esenciales para el crecimiento del cuerpo humano y de las poblaciones humanas. De igual manera, el crecimiento de algas en cuerpos naturales de agua como el lago Erie se puede inhibir al reducir el suministro de nutrientes como el fósforo en forma de fosfatos. Es por esta razón que muchos estados han regulado o prohibido el uso de fosfatos en detergentes y están construyendo plantas de tratamiento que pueden eliminar fosfatos de las aguas residuales municipales antes de que ingresen a lagos o arroyos.
Referencias
- es.wikipedia.org/wiki/Algal_Bloom
- es.wikipedia.org/wiki/Algal_Bloom
- es.wikipedia.org/wiki/Algal_Bloom
- es.wikipedia.org/wiki/Ácido fosforico
- es.wikipedia.org/wiki/Trisodio_fosfato
- es.wikipedia.org/wiki/Trisodio_fosfato
- Estequiometría ecológica: La biolgia de elementos desde las moléculas hasta la biosfera; Robert W. Sterner y James J. Elser; Princeton University Press, Princeton, NJ, 2002.
- es.wikipedia.org/wiki/Estequiometria ecológica
- http://www.plosbiology.org/article/i...l.pbio.0050181
- Estequiometría ecológica: La biolgia de elementos desde las moléculas hasta la biosfera; Robert W. Sterner y James J. Elser; Princeton University Press, Princeton, NJ, 2002, p. 30.




