5.14: Hidrógeno, Helio, Litio
- Page ID
- 75419
Con cierta familiaridad con las propiedades de los electrones simples, como el electrón único alrededor del núcleo de hidrógeno anterior, podemos discutir los átomos que contienen más de un electrón. Las imágenes que se encuentran aquí representan la densidad de ondas electrónicas por número de puntos. Así, más puntos indican más densidad de electrones 'nube' en esa región. En estos diagramas, cada onda de electrones se muestra con un color diferente y puede activar y desactivar la vista de cada onda electrónica usando los botones debajo de los diagramas de densidad de puntos.
Helio
El primer elemento de la tabla periódica con más de un electrón es el helio, que tiene dos electrones. A continuación se muestran diagramas de densidad de puntos para ambos electrones. Un electrón está codificado por colores en azul y el otro en verde. Obsérvese que ambos electrones ocupan el mismo orbital, es decir, un orbital de 1 s. Resulta que 2 es el número máximo de electrones que cualquier orbital puede contener. Esta restricción está relacionada con una propiedad de los electrones aún no discutidos, a saber, su espín. Los electrones no sólo pueden moverse de un lugar a otro, sino que también pueden rotar o girar sobre sí mismos. Dos orientaciones (en sentido horario y antihorario, denominadas spin up o spin down) son posibles para este giro. Según el principio de exclusión Pauli, si dos electrones ocupan el mismo orbital, deben tener espines opuestos. Se dice que dos de esos electrones están emparejados por espín y a menudo se representan por flechas que apuntan en diferentes direcciones, es decir, por el símbolo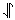 . Se dice que dos electrones que giran en la misma dirección tienen sus espines paralelos y están indicados por
. Se dice que dos electrones que giran en la misma dirección tienen sus espines paralelos y están indicados por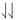 . El principio Pauli implica que si dos electrones tienen espines paralelos, deben ocupar orbitales diferentes.
. El principio Pauli implica que si dos electrones tienen espines paralelos, deben ocupar orbitales diferentes.
Una característica obvia del átomo de helio que se muestra a continuación es que es algo más pequeño que el átomo de hidrógeno dibujado a la misma escala anterior. Esta contracción es causada por el incremento de la carga en el núcleo de +1 en el átomo de hidrógeno a +2 en el átomo de helio. Esto tira con más fuerza tanto las nubes de electrones verdes como las azules. Este efecto está compensado, pero en menor medida, por la repulsión mutua de las dos nubes de electrones.
Litio
En la imagen de densidad de puntos a continuación, los tres electrones del átomo de litio están codificados por colores azul, verde y rojo. Al igual que en el átomo anterior, dos electrones (azul y verde) ocupan el orbital de 1 s. El principio Pauli impide que más de dos electrones ocupen este orbital, por lo que el tercer electrón (rojo) debe ocupar el siguiente orbital superior en energía, es decir, el orbital 2s. Una forma taquigráfica conveniente para indicar esta configuración electrónica es
1 s 2 2 s 1
Los superíndices 2 y 1 indican que hay dos electrones en el orbital de 1 s y un electrón en el orbital de 2 s, respectivamente.
Al igual que en el caso del helio, el incremento de la carga nuclear a +3 produce una reducción correspondiente en el tamaño de la órbita del litio 1 s. En agudo contraste con este orbital interno compacto se encuentra la nube muy grande y muy difusa del electrón externo de 2 s. Hay dos razones por las que esta nube de 2 s es tan grande. La primera razón es que el número cuántico principal n ha aumentado de 1 a 2. Como se muestra en la Figura 1 de la página Orbitales, la nube de electrones de 2 s es mayor que 1 s incluso en el átomo de hidrógeno con una carga nuclear de solo +1. Una segunda razón es que los dos electrones de 1 s suelen estar más cerca del núcleo que el electrón de 2 s. Estos dos electrones de 1 s tienen el efecto de tamizar o apantallar el electrón externo de la fuerza de atracción total de la carga +3 en el núcleo. Cuando el electrón de 2 s está a cierta distancia del núcleo, “ve” no sólo la carga +3 en el núcleo sino también las dos cargas negativas cercanas. El efecto general es casi como si dos de las tres cargas positivas en el núcleo fueran canceladas, dejando una carga neta de + 1 para retener el electrón externo al átomo. Esta situación también se puede describir diciendo que la carga nuclear efectiva está cerca de +1.
Debe quedar claro de la Placa 4 que cuando un átomo de litio interactúa con otro átomo, es mucho más probable que el electrón de 2 s esté involucrado que cualquiera de los dos electrones de 1 s. En la terminología de Lewis, es un electrón de valencia y ocupa una concha de valencia. El par de electrones de 1 s son una capa completa y forman el núcleo del átomo de litio. Por lo tanto, existe una estrecha correspondencia entre la imagen onda-mecánica y las ideas anteriores, menos matemáticas de Lewis. También vale la pena señalar que el modelo de onda del litio da un átomo esférico, un gran avance sobre las órbitas alargadas que fueron necesarias para describir los átomos de metales alcalinos en la teoría de Bohr (ver imagen del átomo de Bohr).


