8.19: Compuestos Orgánicos de Nitrógeno
- Page ID
- 75730
Existe una tremenda variedad de compuestos orgánicos que pueden derivarse del carbono, hidrógeno y oxígeno, lo cual es evidente a partir de las numerosas secciones anteriores que discuten estos compuestos. Si incluimos el nitrógeno como posible constituyente de estas estructuras moleculares, surgen muchas más posibilidades. Sin embargo, la mayoría de los compuestos que contienen nitrógeno son menos importantes comercialmente, y solo discutiremos algunos de ellos aquí.
Las aminas pueden derivarse del amoníaco reemplazando uno, dos o los tres hidrógenos con grupos alquilo. Algunos ejemplos son
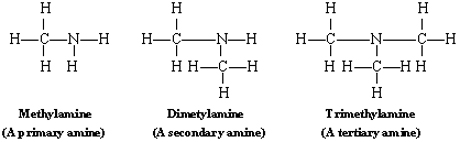
Los términos primario (uno), secundario (dos) y terciario (tres) se refieren al número de hidrógenos que han sido reemplazados. Tanto las aminas primarias como las secundarias son capaces de formar puentes de hidrógeno consigo mismas, pero las aminas terciarias no tienen hidrógenos en el átomo de nitrógeno electronegativo.
Las aminas suelen tener olores desagradables, oliendo “a pescado”. Las tres metilaminas enumeradas anteriormente pueden aislarse de la salmuera de arenque. Las aminas, así como el amoníaco, se producen por descomposición de compuestos que contienen nitrógeno cuando muere un organismo vivo. Las metilaminas se obtienen comercialmente por condensación de metanol con amoníaco sobre un catalizador de óxido de aluminio:
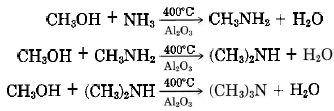
La dimetilamina es la más importante, siendo utilizada en la preparación de herbicidas, en la vulcanización del caucho, y para sintetizar dimetilformamida, un solvente importante.
Las amidas son otro compuesto orgánico importante que contiene nitrógeno. La característica clave de una amina es un átomo de nitrógeno unido a un átomo de carbono de carbonilo. Al igual que los ésteres, las amidas se forman en una reacción de condensación. Mientras que los ésteres se forman a partir de la reacción de condensación de un alcohol y un ácido carboxílico, las amidas se forman a partir de la condensación de una amina y un ácido carboxílico:
Esta reacción general suele ser desfavorable, debido a que el grupo hidroxilo actúa como un mal grupo lápida. Los químicos orgánicos han ideado métodos para solucionarlo mediante el uso de ciertos químicos para activar el ácido carboxílico y permitir la adición de la amina.
Como las amidas se forman por reacciones de condensación, muchos polímeros de condensación importantes involucran enlaces amida. El nylon, por ejemplo, se forma a partir de la condensación de amida de hexacetilendiamina y ácido adípico.
Un segundo conjunto de polímeros de condensación formados a partir de enlaces amida son las proteínas y péptidos que se encuentran en su cuerpo y en todos los organismos. Estos polímeros se forman a partir de otro compuesto orgánico de nitrógeno, el aminoácido. Estas moléculas contienen tanto un grupo amina como un grupo carboxilo. Ejemplos de tales aminoácidos son glicina y lisina:
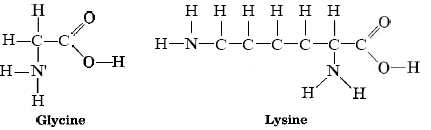
Los aminoácidos son los constituyentes a partir de los cuales se elaboran las proteínas. Algunos, como la glicina, se pueden sintetizar en el cuerpo humano, pero otros no. La lisina es un ejemplo de un aminoácido esencial, uno que debe estar presente en la dieta humana porque no se puede sintetizar dentro del cuerpo. Como se mencionó, la condensación de aminoácidos en péptidos forma enlaces amida. Por esta razón, los científicos a veces se refieren a la cadena principal amida de una proteína o péptido. Una proteína tiene una larga serie de enlaces amida, como se puede observar en la siguiente figura que muestra la síntesis de un tripéptido a partir de tres aminoácidos:
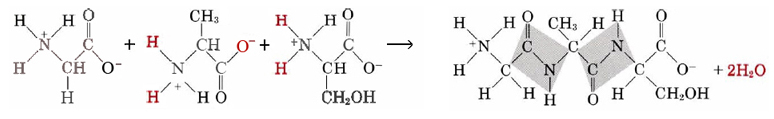
Aminoácidos y proteínas discutidos en las secciones sobre enzimas y en un conjunto de secciones dedicadas a las proteínas y su química en los sistemas vivos.
Las fuerzas intermoleculares y los puntos de ebullición de los compuestos orgánicos que contienen nitrógeno pueden explicarse de acuerdo con los mismos principios utilizados para las sustancias que contienen oxígeno.
Racionalizar los siguientes puntos de ebullición: a) 0°C para CH 3 CH 2 CH 2 CH 3; b) 11°C para CH 3 CH 2 OCH 3; c) 97°C para CH 3 CH 2 CH 2 OH; y d) 170°C para NH 2 CH 2 CH 2 CH 2 OH.
Solución Las cuatro moléculas tienen geometrías muy similares y el mismo número de electrones (26 electrones de valencia más 8 electrones centrales), por lo que sus fuerzas londinenses deberían ser aproximadamente las mismas. El compuesto (a) es un alcano y no polar. Por el contrario, el compuesto (b) es un éter y debe ser ligeramente polar. Esta ligera polaridad da como resultado un punto de ebullición ligeramente superior. El compuesto (c) es isomérico con el compuesto (b) pero es un alcohol. Hay enlaces de hidrógeno entre las moléculas de (c), y su punto de ebullición es mucho mayor. La molécula (d) tiene tanto un grupo amino como un grupo hidroxilo, cada uno de los cuales puede participar en enlaces de hidrógeno. Consecuentemente tiene el punto de ebullición más alto de todos.


