8.18: Ésteres
- Page ID
- 75626
El acetato de celulosa es un ejemplo complicado de otro grupo de compuestos orgánicos, los ésteres, que se pueden elaborar combinando alcoholes con ácidos. Un caso más sencillo es la reacción del etanol con ácido acético para dar acetato de etilo:
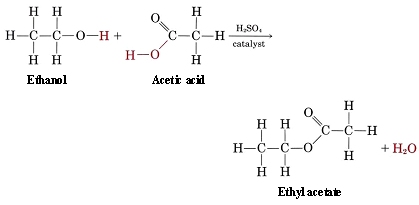
La fórmula general para un éster se puede escribir
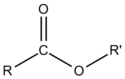
.
En el caso del acetato de etilo, R es CH 3 CH 2 y R′ es CH 3. Cuando se usa esta notación, los ésteres se nombran en función del número de átomos de carbono presentes en los grupos alcohol y ácido carboxílico que ayudaron a formarlo. Al término del alcohol se le da el sufijo “-ilo”, y le sigue el término ácido con el sufijo “-ato”. Como ejemplo, el éster formado por la reacción de condensación entre metanol y ácido butanoico se llamaría “metil butanoato”.
La síntesis de nitroglicerina, también fue un ejemplo de formación de éster, pero en ese caso se combinó un ácido inorgánico, HNO 3, con un alcohol.
La formación de un éster es un ejemplo de una clase importante de reacciones llamadas condensaciones. En una reacción de condensación se unen un par de moléculas, emitiendo una molécula pequeña, muy estable como H 2 O o HCl. Tanto en la síntesis de acetato de etilo como de nitroglicerina, esta molécula pequeña es H 2 O. A menudo se puede deshacer una condensación si se agregan grandes cantidades de las moléculas pequeñas al producto. En el caso de un éster, la adición de grandes cantidades de H 2 O provoca hidrólisis (literalmente, “división por medio de agua “):
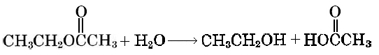
Esto es solo lo contrario de la condensación de acetato de etilo.
Aunque el grupo funcional éster tiene un carbonilo polar, no contiene átomos de hidrógeno adecuados para enlaces de hidrógeno. Por lo tanto, los ésteres tienen puntos de ebullición bajos en relación con la mayoría de las moléculas de En muchos casos, a pesar de que sus moléculas son casi el doble de grandes que las del alcohol y ácido constituyente, se encuentra que un éster tiene un punto de ebullición más bajo que cualquiera de ellos. El acetato de etilo, por ejemplo, hierve a 77.1°C, menor que el etanol (78.5°C) o el ácido acético (117.9°C). A diferencia de los ácidos y alcoholes que tienen olores desagradables y bastante débiles, respectivamente, los ésteres suelen oler bien. Los olores de muchos frutos y flores se deben a los ésteres. El acetato de etilo, por ejemplo, es el factor más importante en el sabor de las piñas.


