13.3: La Constante de Equilibrio
- Page ID
- 75162
La constancia de la relación de la concentración de equilibrio de un isómero a la concentración del otro a una temperatura dada es característica de todos los equilibrios gaseosos entre isómeros, es decir, de todas las reacciones del tipo general
\[\text{A}\text{ }({g})\rightleftharpoons \text{B}\text{ }({g})\label{1} \]
La relación constante de concentraciones se llama constante de equilibrio y se le da el símbolo\(K_c\). Para las reacciones del tipo dado por la Ecuación,\(\ref{1}\) la constante de equilibrio se describe así por la ecuación
\[K_{c}=\frac{[\text{ B }]}{[\text{ A }]}\label{2} \]
donde, por convención, la concentración del producto B aparece en el numerador de la relación. Si, por alguna razón, deseamos mirar a la inversa esta reacción,
\[\text{B}\text{ }({g})\rightleftharpoons \text{A}\text{ }({g}) \nonumber \]
entonces la constante de equilibrio se denota como el recíproco de la constante dada en la Ecuación\(\ref{2}\).
\[K_{c}=\frac{[\text{ A }]}{[\text{ B }]} \nonumber \]
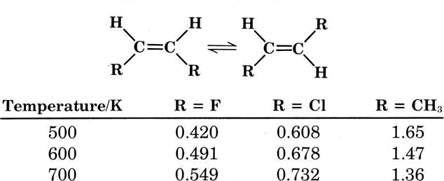
En general la constante de equilibrio\(K_c\) varía con la temperatura y también difiere en función de las sustancias involucradas. Los ejemplos que ilustran este comportamiento se dan en la Tabla\(\PageIndex{1}\) donde las constantes de equilibrio determinadas experimentalmente para diversos equilibrios de isomerización cis-trans se registran a diversas temperaturas. Obsérvese que el equilibrio cambia a medida que cambia la temperatura y la composición de la molécula.
CUADRO\(\PageIndex{1}\) La Constante de Equilibrio Kc para algunas Interconversiones Cis-Trans.
Cuando volvemos nuestra atención hacia reacciones de equilibrio más complejas, encontramos que la relación entre las concentraciones de las diversas especies ya no es una relación simple. Una buena demostración de este hecho es proporcionada por la disociación del tetroxido de dinitrgeno, N 2 O 4. Este compuesto es un gas incoloro, pero incluso a temperatura ambiente se disocia parcialmente en un gas vívido de color marrón rojizo, NO 2, según la ecuación
\[\text{N}_{2}\text{O}_{4}\text{ }({g})\rightleftharpoons \text{2NO}_{2} \text{ }({g})\label{5} \]
Si 1 mol de N 2 O 4 contenido en un matraz de volumen 1 L se calienta a 407.2 K, exactamente la mitad del mismo se disocia en NO 2. Si ahora se incrementa el volumen, la relación de [NO 2] a [N 2 O 4] no permanece constante sino que aumenta a medida que se disocia más. Como se muestra en la Tabla\(\PageIndex{2}\), si aumentamos el volumen aún más, se produce aún más disociación. Para cuando hemos aumentado el volumen a 10 L, la fracción de moléculas de N 2 O 4 disociadas ha aumentado a 0.854 (es decir, a 85.4 por ciento).
Obviamente la situación ahora no es tan sencilla como en el ejemplo anterior. Sin embargo, también existe una relación simple entre las concentraciones de equilibrio del reactivo y el producto en este caso. Encontramos que es la cantidad
\[\frac{[\text{ NO}_{2}]^{2}}{[\text{ N}_{2}\text{O}_{4}]} \nonumber \]
en lugar de la simple relación de concentraciones, que ahora es constante. En consecuencia también llamamos a esta cantidad una constante de equilibrio y le damos el símbolo K c. Así K c para Ecuación\(\ref{5}\) viene dada por la relación
\[K_{c}=\frac{[\text{ NO}_{2}]^{2}}{[\text{ N}_{2}\text{O}_{4}]} \nonumber \]
donde nuevamente por convención el producto aparece en el numerador. Es fácil comprobar que K c en realidad es una cantidad constante con el valor 2.00 mol/L a partir de los datos dados en la Tabla\(\PageIndex{2}\). Así, si tomamos el resultado de la línea d, encontramos que cuando se coloca 1 mol de N 2 O 4 en un matraz de 10 L a 407 K, se disocian 0.854 mol.
|
Cantidad de N 2 O 4 Agregado mol |
Volumen de Frasco L |
Fracción N 2 O 4 Disociado |
Monto N 2 O 4 en Equilibrio mol |
Cantidad NO 2 en Equilibrio mol |
Concentración N 2 O 4 en Equilibrio mol/L |
Concentración NO 2 en Equilibrio mol/L |
Constante de Equilibrio K c mol/L |
|
|---|---|---|---|---|---|---|---|---|
| a | 1 | 1 | 0.500 | 0.500 | 1.000 | 0.500 | 1.000 | 2.000 |
| b | 1 | 2 | 0.618 | 0.382 | 1.236 | 0.191 | 0.618 | 2.000 |
| c | 1 | 5 | 0.766 | 0.234 | 1.532 | 0.0468 | 0.3064 | 2.006 |
| d | 1 | 10 | 0.854 | 0.146 | 1.708 | 0.0146 | 0.1708 | 1.998 |
Dado que a partir de la Ecuación\(\ref{5}\) cada mol que se disocia produce 2 mol NO 2, habrá
\[\text{0.854 mol N}_{2}\text{O}_{4}\times \frac{\text{2 mol NO}_{2}}{\text{1 mol N}_{2}\text{O}_{4}}=\text{1.708 mol NO}_{2} \nonumber \]
presente en el recipiente de reacción. También habrá (1 — 0.854) mol = 0.146 mol N 2 O 4 dejado sin disociar en el matraz. Dado que el volumen total es de 10 L, las concentraciones de equilibrio son
\[[\text{ NO}_{2}]=\frac{\text{1.708 mol}}{\text{10 L}}=\text{0.1708 mol/L} \nonumber \]
y
\[[\text{ N}_{2}\text{O}_{4}]=\frac{\text{0.146 mol}}{\text{10 L}}=\text{0.0146 mol/L} \nonumber \]
En consecuencia
\[K_{c}=\frac{\text{1.708 mol/L}\times \text{ 0.1708 mol/L}}{\text{0.0146 mol/L}}=\text{2.00 mol/L} \nonumber \]
Exactamente de la misma manera, si usamos los datos de la línea a en la Tabla\(\PageIndex{2}\), encontramos
\[K_{c}=\frac{[\text{ NO}_{2}]^{2}}{[\text{ N}_{2}\text{O}_{4}]}=\frac{\text{(1.00 mol/L}\text{)}^{2}}{\text{0.5 mol/L}}=\text{2.00 mol/L} \nonumber \]
Puedes verificar por ti mismo que las líneas b y c también arrojan el mismo valor para K c.
Cuando 2 mol N 2 O 4 gas se calientan a 407 K en un recipiente de volumen 5 dm 3, se encuentra que 0.656 de las moléculas se disocian en NO 2. Demostrar que estos datos están de acuerdo con el valor para K c de 2.00 mol dm —3 dado en el texto.
Solución
Muchos problemas de equilibrio pueden resolverse de una manera bastante estandarizada en tres etapas.
a) Calcular la cantidad de cada sustancia transformada por la reacción a medida que llega al equilibrio, es decir, la cantidad de cada reactivo consumido por la reacción y la cantidad de cada producto producido por la reacción. Las relaciones estequiométricas derivadas de la ecuación siempre deben ser utilizadas en estos cálculos.
En este ejemplo particular observamos que 0.656 del N 2 O 4 original se disocia. Ya que se utilizaron 2 mol, se consume un total de 0.656 × 2 = 1.312 mol N 2 O 4. La cantidad de NO 2 producida es en consecuencia
\(n_{\text{NO}_{2}}=\text{1.312 mol N}_{2}\text{O}_{4}\times \dfrac{\text{2 mol NO}_{2}}{\text{1 mol N}_{2}\text{O}_{4}}=\text{2.624 mol NO}_{2}\)
b) Utilizar las cantidades calculadas en la primera etapa para calcular la cantidad de cada sustancia presente en equilibrio. Dividiendo por el volumen, podemos obtener las concentraciones de equilibrio.
Desde 1.312 mol N 2 O 4 disociado de un original 2 mol, nos queda (2 — 1.312) mol = 0.688 mol N 2 O 4. La concentración de equilibrio de N 2 O 4 es así
\([\text{ N}_{2}\text{O}_{4}] = \dfrac{0.688\text{ mol N}_{2}\text{O}_{4}}{\text{ 5.00 dm}^{3}} = \text{0.1376 mol dm}^{-3}\)
Dado que no estaba presente originalmente NO 2, la cantidad de NO 2 presente en equilibrio es la cantidad producida por la disociación, es decir, 2.624 mol NO 2. Así
\([\text{ NO}_{2}]=\dfrac{\text{2.624 mol NO}_{2}}{\text{5.00 dm}^{3}}=\text{0.525 mol dm}^{-3}\)
Por lo general, vale la pena tabular estos cálculos, particularmente en ejemplos más complejos.
Tenga en cuenta que una cantidad negativa en la columna encabezada Cantidad Producida indica que se ha consumido una sustancia determinada (como N 2 O 4 en este ejemplo). Hay menos de esa sustancia cuando se alcanza el equilibrio de lo que estaba presente inicialmente.
| Sustancia |
Importe Inicial mol |
Cantidad Producida mol |
Cantidad de Equilibrio mol |
Concentración de equilibrio mol dm -3 |
|---|---|---|---|---|
| N 2 O 4 | 2.00 | -1.312 | 0.688 | 0.688/5 |
| NO 2 | 0.00 | 2.624 | 2.624 | 2.624/5 |
c) En la tercera etapa insertamos las concentraciones de equilibrio en una expresión para la constante de equilibrio:
\(K_{c}=\dfrac{[\text{ NO}_{2}]^{2}}{[\text{ N}_{2}\text{O}_{4}]}=\dfrac{\text{0.525 mol dm}^{-3}\times \text{ 0.525 mol dm}^{-3}}{\text{0.1376 mol dm}^{-3}}=\text{2.00 mol dm}^{-3}\)


