13.4: La Ley del Equilibrio Químico
- Page ID
- 75145
Dos ejemplos de una constante de equilibrio tratados en otras secciones, a saber:
\[K_{c}=\frac{[trans\text{-C}_{\text{2}}\text{H}_{\text{2}}\text{F}_{\text{2}}]}{[cis\text{-C}_{\text{2}}\text{H}_{\text{2}}\text{F}_{\text{2}}]} \nonumber \]
para la reacción
\[\text{cis-C}_2\text{H}_2\text{F}_2 \rightleftharpoons \text{trans-C}_2\text{H}_2\text{F}_2 \nonumber \]
En la ecuación anterior, observe que ambos lados tienen la misma fórmula molecular, sin embargo en la imagen de abajo, los elementos involucrados están dispuestos de manera diferente. Estas moléculas se llaman isómeros y para conocer más sobre ellas, echa un vistazo al siguiente sitio: https://www.thoughtco.com/geometric-isomerism-cis-and-trans-608702.
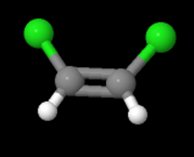
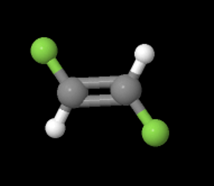
y
\[K_{c}=\frac{[\text{ NO}_{\text{2}}]^{\text{2}}}{[\text{ N}_{\text{2}}\text{O}_{\text{4}}]} \nonumber \]
para la reacción
\[\text{N}_2\text{O}_4 \rightleftharpoons \text{2NO}_2 \nonumber \]
En la ecuación anterior, vemos la descomposición de N 2 O 4 (el gas claro que se muestra a continuación) en NO 2, que es el gas rojo parduzco que se ve a continuación. Como se puede ver en la estructura molecular anterior, esta descomposición de N 2 O 4 ocurre cuando se rompe el enlace medio que mantiene unido a N 2 O 4, dejando dos moléculas de NO 2. Para más información sobre este equilibrio específico, consulta la página sobre El efecto de un cambio en la temperatura.
Tanto la transición trans-cis de C 2 H 2 F 2 como la descomposición de N 2 O 4 son ejemplos particulares de una ley más general que rige el equilibrio químico en gases. Si escribimos una ecuación para un equilibrio gaseoso en general en la forma
\[aA(g) + bB(g) \rightleftharpoons cC(g) + dD(g) \label{1} \]
luego la constante de equilibrio definida por la ecuación
\[K_{c}=\frac{[\text{ C }]^{c}[\text{ D }]^{d}}{[\text{ A }]^{a}[\text{ B }]^{b}} \label{2} \]
se encuentra que es una cantidad constante dependiendo únicamente de la temperatura y la naturaleza de la reacción. Este resultado general se llama la ley del equilibrio químico, o la ley de la acción de masas.
Escriba expresiones para la constante de equilibrio para las siguientes reacciones:
- \[\text{2HI}(g) \rightleftharpoons \text{H}_2(g) + \text{I}_2(g) \nonumber \]
- \[\text{N}_2(g) + \text{3H}_2(g) \rightleftharpoons \text{2NH}_3(g) \nonumber \]
- \[\text{O}_2(g) + \text{4HCl}(g) \rightleftharpoons \text{2H}_2\text{O}(g) + \text{2Cl}_2(g) \nonumber \]
Solución
- \[K_{c}=\frac{[\text{ H}_{\text{2}}]\text{ }[\text{ I}_{\text{2}}]}{[\text{ HI }]^{\text{2}}} \nonumber \]
- \[K_{c}=\frac{[\text{ NH}_{\text{3}}]^{\text{2}}}{[\text{ N}_{\text{2}}]\text{ }[\text{ H}_{\text{2}}]^{3}} \nonumber \]
- \[K_{c}=\frac{[\text{ H}_{\text{2}}\text{O }]^{\text{2}}[\text{ Cl}_{\text{2}}]^{\text{2}}}{[\text{ O}_{\text{2}}]\text{ }[\text{ HCl }]^{\text{4}}} \nonumber \]
Una mezcla que contiene concentraciones iguales de metano y vapor se pasa sobre un catalizador de níquel a 1000 K. El gas emergente tiene la composición [CO] = 0.1027 mol dm —3, [H 2] = 0.3080 mol dm —3, y [CH 4] = [H 2 O] = 0.8973 mol dm —3. Suponiendo que esta mezcla está en equilibrio, calcular la constante de equilibrio Kc para la reacción
\[\text{CH}_4(g) + \text{H}_2\text{O}(g) \rightleftharpoons \text{CO}(g) + \text{3H}_2(g) \nonumber \]
Solución
La constante de equilibrio viene dada por la siguiente ecuación:
\[K_{c}=\frac{[\text{ CO }]\text{ }[\text{ H}_{\text{2}}]^{\text{3}}}{[\text{ CH}_{\text{4}}]\text{ }[\text{ H}_{\text{2}}\text{O }]}=\frac{\text{0}\text{.1027}^{-\text{3}}\times \text{ (0}\text{.3080}^{-\text{3}}\text{)}^{\text{3}}}{\text{0}\text{.8973}^{-\text{3}}\times \text{ 0}\text{.8973}^{-\text{3}}} \nonumber \]
\[=\text{3}\text{.727 }\times \text{ 10}^{-\text{3}} \nonumber \]
Nota: El rendimiento de H 2 a esta temperatura es bastante pobre. En la producción comercial de H 2 a partir de gas natural, la reacción se realiza a una temperatura algo mayor donde el valor K c es mayor.
Como muestra el ejemplo anterior, la constante de equilibrio Kc es una cantidad adimensional. Esta falta de unidades es resultado de la derivación de K c a partir de K eq que utiliza las actividades de los reactivos y productos en el sistema de equilibrio en lugar de sus concentraciones. La actividad de una sustancia es una medida de su concentración efectiva en condiciones especificadas. Si bien una discusión detallada de esta importante cantidad está fuera del alcance de un texto introductorio, es necesario estar al tanto de algunos aspectos importantes:
- Las actividades son cantidades adimensionales (sin unidades) y en esencia son concentraciones “ajustadas”.
- Para soluciones relativamente diluidas, la actividad de una sustancia y su concentración molar son aproximadamente iguales. Sin embargo, para obtener una cantidad sin unidades, cada concentración molar se divide por un estado estándar definido como 1\(\dfrac{mole}{dm^{3}}\). Al utilizar este estado estándar, el valor numérico de la concentración permanece sin cambios, pero las unidades se anulan.
- Las actividades para las fases condensadas puras (sólidos y líquidos) son iguales a 1.
- Las actividades para solventes en soluciones diluidas son iguales a 1.
Así, cuando aplicamos la ley de equilibrio a reacciones que involucran sólidos puros y líquidos puros, encontramos en tales casos que mientras esté presente algún sólido o líquido, la cantidad real no afecta la posición de equilibrio. En consecuencia, solo las concentraciones molares de especies gaseosas se escriben explícitamente en la expresión para la constante de equilibrio. Por ejemplo, la constante de equilibrio para la reacción
\[\text{CaCO}_3(s) \rightleftharpoons \text{CaO}(s) + \text{CO}_2(g) \label{3} \]
Observe a continuación la representación molecular de la reacción anterior, con la estructura iónica de CaCo 3 'rompiéndose' para formar la estructura iónica más simple CaO así como CO 2 gaseoso.
viene dada por la expresión
\[\text{K}_c = [\text{CO}_2] \label{4} \]
en el que sólo aparece explícitamente la concentración del gas porque los dos sólidos tienen cada uno una actividad con un valor igual a 1. \(\ref{4}\)La ecuación sugiere que si calentamos CaCo 3 a una temperatura alta para que parte de él se descomponga, la concentración de CO 2 en equilibrio dependerá solo de la temperatura y no cambiará si se altera la relación de cantidad de CaCo 3 sólido a cantidad de CaO sólido . Experimentalmente esto es lo que se observa.
Escriba expresiones para las constantes de equilibrio para las siguientes reacciones:
- \[\text{C}(s) + \text{H}_2\text{O}(g) \rightleftharpoons \text{CO}(g) + \text{H}_2(g) \nonumber \]
- \[\text{C}(s) + \text{CO}_2(g) \rightleftharpoons \text{2CO}(g) \nonumber \]
- \[\text{Fe}_3\text{O}_4(s) + \text{H}_2(g) \rightleftharpoons \text{3FeO}(s) + \text{H}_2\text{O}(g) \nonumber \]
Solución
Dado que solo se necesitan incluir especies gaseosas, obtenemos
- \[K_{c}=\frac{[\text{ CO }]\text{ }[\text{ H}_{\text{2}}]}{[\text{ H}_{\text{2}}\text{O }]} \nonumber \]
- \[K_{c}=\frac{[\text{ CO }]^{\text{2}}}{[\text{ CO}_{\text{2}}]} \nonumber \]
- \[K_{c}=\frac{[\text{ H}_{\text{2}}\text{O }]}{[\text{ H}_{\text{2}}]} \nonumber \]
Se puede demostrar experimentalmente que la ley de equilibrio se aplica a soluciones líquidas diluidas así como a mezclas de gases, y la expresión constante de equilibrio para una reacción en solución se puede obtener de la misma manera que para una reacción en fase gaseosa.
El ácido acético, por ejemplo, reacciona de la siguiente manera cuando se disuelve en agua:
\[\text{CH}_3\text{COOH}(aq) + \text{H}_2\text{O}(l) \rightleftharpoons \text{CH}_3\text{COO}^{-}(aq) + \text{H}_3\text{O}^{+} (aq)\label{5} \]
Observe en la siguiente figura cómo el hidrógeno blanco unido al oxígeno rojo en la molécula de ácido acético se transfiere al agua, formando acetato (ácido acético menos hidrógeno) y un ion hidronio. Simbólicamente en la ecuación anterior, podemos ver esta misma transferencia, excepto que el hidrógeno se representa como una H en lugar de una bola blanca.
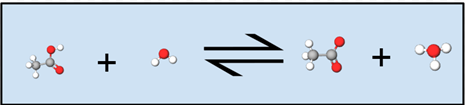
En solución solo las concentraciones de las especies de soluto se muestran explícitamente en la ley de equilibrio. Aunque el disolvente pueda ser un reactivo o producto, siempre y cuando la solución esté diluida, cualquier pequeña cantidad de agua producida o utilizada por la reacción química no cambiará la cantidad de agua en un grado apreciable porque es el disolvente. Como disolvente, al agua se le asigna una actividad igual a 1. Por lo tanto, la actividad del agua convencionalmente no se escribe explícitamente como parte de la ley de equilibrio para una reacción en solución acuosa. Ya que se aplica a un ácido débil, K a se llama constante ácida. (La a significa ácido.) Otras constantes de equilibrio en las que la actividad del agua solvente tiene un valor de 1 y por lo tanto no se incluye explícitamente en la ley de equilibrio son la constante de base, K b, para la ionización de una base débil y la constante de producto de solubilidad, K sp , para la disolución de un compuesto ligeramente soluble.
La actividad del disolvente en una solución diluida tiene un valor definido de 1. Esta actividad es parte de la ley de equilibrio, pero convencionalmente no está escrita en la ley de equilibrio porque su valor numérico de 1 no cambia el valor numérico de la constante de equilibrio.
Es un error común afirmar que la concentración molar del disolvente está de alguna manera involucrada en la ley de equilibrio. Este error es resultado de un malentendido de la termodinámica de solución. Por ejemplo, a menudo se afirma que K c = K eq [H 2 O] para soluciones acuosas. Esta ecuación es incorrecta porque es una interpretación errónea de la ecuación correcta K c = K eq (\(\textit{a}_{H_2O}\)). Porque\(\textit{a}_{H_2O}\) = 1 para una solución diluida, K a = K eq (1), o K a = K eq.
Escriba expresiones para las constantes de equilibrio para los siguientes equilibrios iónicos en solución acuosa diluida:
- \[\text{HF}(aq) + \text{H}_2\text{O} \rightleftharpoons \text{F}^{-}(aq) + \text{H}_3\text{O}^{+}(aq) \nonumber \]
- \[\text{H}_2\text{O} + \text{NH}_3(aq) \rightleftharpoons \text{OH}^{-}(aq) + \text{NH}_4^{+}(aq) \nonumber \]
- \[\text{H}_2\text{O} + \text{CO}_3^{2-}(aq) \rightleftharpoons \text{HCO}_3^{-}(aq) + \text{OH}^{-}(aq) \nonumber \]
- \[\text{BaSO}_4(s) \rightleftharpoons \text{Ba}^{2+}(aq) + \text{SO}_4^{2-}(aq) \nonumber \]
Solución
No incluimos explícitamente la actividad de H 2 O en los tres primeros ejemplos y la actividad de BaSO 4 sólido en el cuarto porque en todos estos casos, la acividad de la especie específica es igual a 1, y por lo tanto no cambiaría el valor numérico de la constante de equilibrio.
- \[\text{K}_a = \text{K}_c = \frac{[\text{ H}_{\text{3}}\text{O}^{\text{+}}]\text{ }[\text{ F}^{-}]}{[\text{ HF }]} \nonumber \]
- \[\text{K}_b = \text{K}_c = \frac{[\text{ NH}_{\text{4}}^{\text{+}}]\text{ }[\text{ OH}^{-}]}{[\text{ NH}_{\text{3}}]} \nonumber \]
- \[\text{K}_b =\text{K}_c = \frac{[\text{ HCO}_{\text{3}}^{-}]\text{ }[\text{ OH}^{-}]}{[\text{ CO}_{\text{3}}^{\text{2}-}]} \nonumber \]
- \[\text{K}_{sp} = \text{K}_c = [\text{Ba}^{2+}][\text{SO}_4^{2-}] \nonumber \]
Las mediciones de las conductividades de las soluciones de ácido acético indican que la fracción de moléculas de ácido acético convertidas en iones acetato e hidronio es
- 0.0296 a una concentración de 0.020 00 mol dm —3
- 0.5385 a una concentración de 2.801 × 10 —5 mol dm —3
Utilice estos datos para calcular la constante de equilibrio para la Ecuación (5) en cada concentración.
Solución
Considera primero 1 dm 3 de solución a. Este originalmente contenía 0.02 mol de CH 3 COOH de los cuales la fracción 0.0296 ha ionizado. Así queda (1 — 0.0296) × 0.02 mol CH 3 COOH no disociado, mientras que 0.0296 × 0.02 mol H 3 O + y CH 3 COO — se han producido. En forma tabular
| Sustancia | Importe Original | Cantidad Producida | Cantidad de Equilibrio | Concentración de equilibrio |
| CH 3 COOH | 0.02 mol | -0.0296×0.02 mol | (0.02-0.000 592) mol | 0.0194 mol dm -3 |
| H 3 + | 0 mol | +0.0296×0.02mol | 0.000 592 mol | 5.92×10 -4 mol dm -3 |
| CH 3 COO - | 0 mol | +0.0296×0.02 mol | 0.000 592 mol | 5.92×10 -4 mol dm -3 |
Sustituir en la expresión por K a da
\[K_{a}=\frac{[\text{ CH}_{\text{3}}\text{COO}^{-}]\text{ }[\text{ H}_{\text{3}}\text{O}^{\text{+}}]}{[\text{ CH}_{\text{3}}\text{COOH }]}=\frac{\text{(5}\text{.92 }\times \text{ 10}^{-\text{4}}\text{)}^{\text{2}}}{\text{0}\text{.0194}}=\text{1}\text{.81 }\times \text{ 10}^{-\text{5}} \nonumber \]
Un cálculo similar sobre los rendimientos de la segunda solución
\[K_{a}=\frac{\text{(1}\text{.5083 }\times \text{ 10}^{-\text{5}}\text{)}^{\text{2}}}{\text{1}\text{.2926 }\times \text{ 10}^{-\text{5}}}=\text{1}\text{.760 }\times \text{ 10}^{-\text{5}} \nonumber \]
Los dos valores de la constante de equilibrio sólo están de acuerdo aproximado. En soluciones más concentradas el acuerdo es peor. Si la concentración es de 1 mol dm —3, por ejemplo, K a tiene el valor 1.41 × 10 —5. Esta es la razón de nuestra afirmación de que la ley de equilibrio se aplica a las soluciones diluidas.
Agradecimientos
molview.org se utilizó para crear las representaciones moleculares que se encuentran en esta página web. Echa un vistazo al sitio en el siguiente enlace: Molview.


