16.13: Incluyendo los Alrededores
- Page ID
- 74926
\[\ce{2Mg(s) + O2(g) → 2MgO(s)} \qquad 1 \text{atm}, \quad 298 \text{K} \label{1} \]
Dado que esta reacción ocurre a la presión estándar y a 298 K, podemos encontrar Δ S a partir de las entropías molares estándar:
\[\begin{align} \Delta S &= \Delta S_{m}^{º}(298\text{K})=2S_{m}^{º}(\text{Mg}) - S_{m}^{º}\text{O}_{2} \\ &=(2 \times 26.8 - 2 \times 32.6 - 205.0) \frac { \text{J}}{\text{mol K}} \\&=-216.6 \frac{\text{J}}{\text{mol K}} \end{align} \nonumber \]
Este resultado sugeriría que la reacción no es espontánea, sino que de hecho lo es. Una vez encendida, una cinta de metal magnesio se quema libremente en el aire para formar óxido de magnesio sólido en forma de un polvo blanco. La reacción es sencillamente espontánea a pesar de que Δ S es negativa. ¿Por qué esto no es una contradicción de la segunda ley?
La respuesta es que no nos hemos dado cuenta de que el cambio de entropía que experimentan los átomos de magnesio y oxígeno como resultado de la reacción no es el único cambio de entropía que se produce. La oxidación del magnesio es una reacción altamente exotérmica, y el calor que se desarrolla fluye hacia el entorno, aumentando su entropía también. Por lo tanto, hay dos cambios de entropía que debemos tener en cuenta para decidir si una reacción será espontánea o no: (1) el cambio en la entropía del sistema que realmente experimenta el cambio químico, que indicaremos con el símbolo Δ S sys; y ( 2) el cambio en la entropía del entorno, Δ S surr, que ocurre a medida que el entorno absorbe la energía térmica liberada por una reacción exotérmica o suministra la energía térmica absorbida por una reacción endotérmica.
De estos dos cambios, el primero se obtiene fácilmente de tablas de valores de entropía. Así, para la oxidación del magnesio, de acuerdo con la Ec. \(\ref{1}\), Δ S sys tiene el valor ya encontrado, es decir, —216.6 J K —1 mol —1.
El segundo cambio de entropía, Δ S surr, también se puede derivar de tablas, como veremos ahora.
Cuando se produce una reacción química a presión atmosférica y su entorno se mantiene a una temperatura constante T, entonces el entorno absorberá una cantidad de calor, q surr igual a la energía térmica que emite la reacción.
\[q_{surr}=- \Delta H \label{4} \]
(El signo negativo antes de Δ H es necesario porque q surr es positivo si el entorno absorbe energía térmica, pero Δ H es negativo si el sistema emite energía térmica para que los absorban). Si ahora alimentamos a la Ec. \(\ref{4}\)en la Ec. (1) en la sección de medición de entropía, obtenemos una expresión para el cambio de entropía del entorno en términos de Δ H:
\[\Delta S_{\text{surr}}=\frac{q_{\text{surr}}}{T}=\frac{-\Delta H}{T} \label{5} \]
Usando esta ecuación ahora es posible encontrar el valor de Δ S surr de la tabla de entalpías estándar de formación. En el caso de la oxidación del magnesio, por ejemplo, encontramos fácilmente que la entalpía cambia para
\[\ce{2Mg(s) + O2(g) -> 2MgO(s)} \qquad 1 \text{atm, 298 K } \nonumber \]
está dado por
\[\Delta H = \Delta H_{m}^{º} (MgO)=2 \times -601.8 \frac{\text{J}}{\text{mol K}}=-1204 \frac{\text{J}}{\text{mol K}} \nonumber \]
Sustituyendo este resultado por la Ec. \(\ref{5}\), luego encontramos
\[\Delta S_{\text{surr}}=\frac{-\Delta H}{T}=\frac{\text{1204 }\times \text{ 10}^{\text{3}}\text{ J mol}^{-\text{1}}}{\text{298 K}}=\text{4040 J K}^{-\text{1}}\text{ mol}^{-\text{1}} \nonumber \]
Si una reacción es espontánea, entonces es el cambio total de entropía Δ S tot, dado por la suma de Δ S surr y Δ S sys, que debe ser positivo para conformarse a la segunda ley. En la oxidación del magnesio, por ejemplo, encontramos que el cambio de entropía total viene dado por
\[\Delta S_{tot} = \Delta S_{surr} + \Delta S_{sys} = (4040 - 216.6) \frac{\text{J}}{\text{ mol K}}=3823 \frac{\text{J}}{\text{mol K}} \nonumber \]
Esta es una cantidad positiva porque el incremento de entropía en el entorno es más que suficiente para compensar la disminución en el propio sistema, y se satisface la segunda ley. En el caso general el cambio de entropía total viene dado por
\[\Delta S_{tot}= \Delta S_{surr} + \Delta S_{sys} = -\frac{\Delta H}{T} + \Delta S_{sys} \nonumber \]
La segunda ley exige que esta suma sea positiva; es decir,
\[\frac{-\Delta H}{T} + \Delta S_{sys}>0\qquad \label{11} \]
Esta simple desigualdad nos da lo que hemos estado buscando: un criterio sencillo para determinar si una reacción es espontánea o no. Dado que tanto Δ H como Δ S se pueden obtener de tablas, y presumiblemente se conoce T, ahora podemos predecir de antemano si una reacción será cuesta arriba o cuesta abajo.
Usando la Tabla de Algunas Entalpías Estándar de Formación a 25°C y la Tabla de Entropias Molares Estándar se encuentran Δ H m° (298 K) y Δ S m° (298 K) para la reacción
\[ \ce{N2 (g) + 3H2 (g) -> 2NH3 (g)} \qquad 1 \text{atm} \nonumber \]
Predecir si la reacción será espontánea o no a una temperatura de (a) 298 K, y (b) 1000 K.
Solución
Encontramos de la Tabla de Algunas entalpías estándar de formación que
\[ \begin{align} \Delta H_{m}^{º} (298 \text{K}) & = \sum \Delta H_{f}^{º} \text{(products)} - \sum \Delta H_{f}^{º} \text{(reactants)} \\ & = 2 \Delta H_{f}^{º} \text{(NH}_3 ) - \Delta H_{f}^{º} ( \text{N}_2 ) - 3 \Delta H_{f}^{º} ( \text{H}_2 ) \\ & = (-2 \times 46.1 - 0.0 - 0.0 ) \text{kJ mol}^{-1} = -92.2 \text{kJ mol}^{-1} \end{align} \nonumber \]
y de la Tabla de Entropias Molares Estándar:
\[ \begin{align}\Delta S_m^{º} (298 \text{K}) & = \sum \Delta S_m^{º} \text{(products)} - \sum \Delta S_m^{º} \text{(reactants)} \\ & = 2 \Delta S_m^º (\text{NH}_3 ) - \Delta S_m^º ( \text{N}_2 ) - 3 \Delta S_m^º ( \text{H}_2 ) \\ & = (2 \times 192.2 – 191.5 – 3 \times 130.6) \text{ J K}^{-1} \text{ mol}^{-1} = –198.9 \text{ J K}^{-1} \text{ mol}^{-1} \end{align} \nonumber \]
a) A 298 K el cambio de entropía total por mol N 2 viene dado por
\[ \begin{align} \Delta S_{tot} & = \frac{-\Delta H_{m}^{ o}}{T} + \Delta S_{sys}^{º} = \frac{\text{92}\text{.2 }\times \text{ 10}^{\text{3}}\text{ J mol}^{-\text{1}}}{\text{298 K}} – 198.9 \text{ J K}^{-1} \text{ mol}^{-1} \\ & = (309.4 – 198.9) \text{ J K}^{-1} \text{ mol}^{-1} = 110.5 \text{ J K}^{-1} \text{ mol}^{-1} \end{align} \nonumber \]
Dado que el cambio de entropía total es positivo, la reacción es espontánea:
b) Dado que las tablas están disponibles solo para 298 K, debemos hacer la suposición aproximada de que ni Δ H ni Δ S varían mucho con la temperatura. En consecuencia asumimos
\[ \begin{align} & \Delta H_m^º (1000 \text{ K} ) = \Delta H_m^º (298 \text{ K} ) = -92.2 \text{kJ mol}^{-1} \\ \text{and} ~~~~~ & \Delta S_m^º (1000 \text{ K} = \Delta S_m^º (298 \text{ K} ) = -198.9 \text{ J K}^{-1} \text{ mol}^{-1}\end{align} \nonumber \]
Δ H m° (1000 K) = Δ H m° (298 K) = —92.2 kJ mol —1
y Δ S m° (1000 K) = Δ S m° (298 K) = — 198.9 J K —1 mol —1 mol —1
Así, para 1 mol N 2 reaccionó,
\[\begin{align} \Delta S_{tot} & = \frac{-\Delta H_{m}^{ o}}{T} + \Delta S_{sys}^ º = \frac{\text{92}\text{.2 }\times \text{ 10}^{\text{3}}\text{ J mol}^{-\text{1}}}{\text{1000 K}} – 198.9 \text{ J K}^{-1} \text{ mol}^{-1} \\ & = (92.2 – 198.9) \text{ J K}^{-1} \text{ mol}^{-1} = –106.7 \text{ J K}^{-1} \text{ mol}^{-1} \end{align} \nonumber \]
Dado que el cambio de entropía total es negativo a esta alta temperatura, concluimos que N 2 y H 2 no reaccionarán para formar NH 3, sino que más bien NH 3 se descompondrá en sus elementos.
Además de permitirnos predecir la dirección de una reacción química a partir de tablas de datos termodinámicos, la desigualdad [Eq. \(\ref{11}\)] muestra que tres factores determinan si una reacción es espontánea o no: el cambio de entalpía Δ H, el cambio de entropía Δ S y la temperatura T. Examinemos cada uno de estos para ver qué efecto tienen y por qué.
El cambio de entalpía, Δ H Como bien sabemos, si Δ H es negativo, se liberará calor por la reacción y se incrementará la entropía del entorno, mientras que si Δ H es positivo, el entorno disminuirá en entropía. A temperatura ambiente generalmente encontramos que este cambio en la entropía del entorno medido por —Δ H/T es el factor principal para determinar la dirección de una reacción ya que Δ S es casi siempre pequeño en comparación. Esto explica por qué a temperatura ambiente la mayoría de las reacciones espontáneas son exotérmicas. A nivel molecular, como vimos en las secciones sobre entalpía, calor y energía, una reacción exotérmica corresponde a un movimiento de una situación de unión más débil a una situación de unión más fuerte. La formación de enlaces más y/o más fuertes es, por lo tanto, un factor importante en la tendencia a hacer una reacción espontánea. El cambio de entropía, ΔS sys Si el propio sistema aumenta en entropía como resultado de la reacción (es decir, si Δ S sys es positivo), esto obviamente contribuirá a que el cambio de entropía total sea positivo y la reacción espontáneo. Como vimos en la sección anterior de este capítulo, las reacciones para las que Δ S es positiva corresponden a la relajación de algunas de las restricciones sobre el movimiento de los átomos y moléculas en el sistema. En particular, las reacciones de disociación y las reacciones en las que aumenta la cantidad de sustancia en la fase gaseosa corresponden a reacciones para las que Δ S es positivo. La temperatura, T Debido a que altera la magnitud de —Δ H/T con relación a Δ S, la temperatura regula la importancia relativa del cambio de entalpía y el cambio de entropía en la determinación de si una reacción será espontáneo o no. A medida que bajamos la temperatura, el efecto de una reacción sobre la entropía de su entorno se vuelve cada vez más pronunciado debido al funcionamiento del efecto “niño en la sala”. A medida que nos acercamos al cero absoluto, el valor de —Δ H/T comienza a ser una cantidad positiva o negativa infinitamente grande, y Δ S se vuelve insignificante en comparación.A una temperatura muy baja, por lo tanto, si la reacción es espontánea o no dependerá del signo de Δ H, es decir, de si la reacción es exotérmica o endotérmica. Por el contrario, a medida que elevamos la temperatura a valores muy altos, el efecto “niño en el dormitorio” toma el relevo y la reacción afecta la entropía de su entorno en una medida cada vez más pequeña hasta que finalmente es solo el valor de Δ S sys el que determina el comportamiento de la reacción. En definitiva, si una reacción es espontánea o no se controla por el signo de Δ H a temperaturas muy bajas y por el signo de Δ S a temperaturas muy altas.
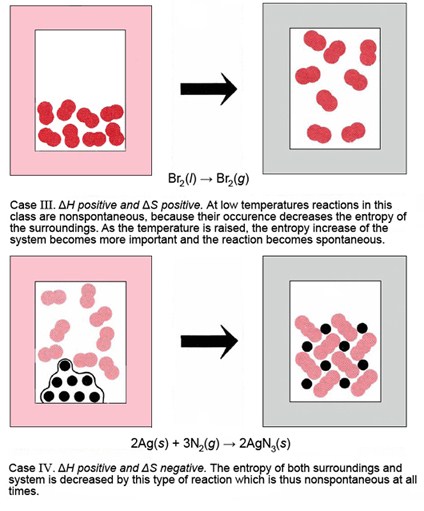
Dado que Δ H puede ser positivo o negativo y así puede Δ S, existen cuatro combinaciones posibles de estos dos factores, cada uno de los cuales exhibe un comportamiento diferente a altas y bajas temperaturas. Los cuatro casos se enumeran y describen en la siguiente tabla, y también se ilustran con ejemplos simples en la Figura\(\PageIndex{1}\). En esta figura los alrededores están indicados por un borde sombreado alrededor del sistema de reacción. Si la reacción es exotérmica, el borde cambia de gris a rosa, lo que indica que los alrededores han absorbido energía térmica y por lo tanto han aumentado en entropía. Cuando el borde cambia de rosa a gris, esto indica una reacción endotérmica y una disminución en la entropía del entorno. En cada caso el cambio en la entropía del sistema debería ser obvio a partir de un aumento o disminución en la libertad de movimiento de las moléculas y/o átomos.
| Caso | Signo de Δ H | Signo de Δ S | Comportamiento |
|---|---|---|---|
| 1 |
|
|
Espontánea a todas las temperaturas |
| 2 |
|
|
Espontáneo solo a bajas temperaturas |
| 3 |
|
|
Espontáneo solo a altas temperaturas |
| 4 |
|
|
Nunca espontáneo |
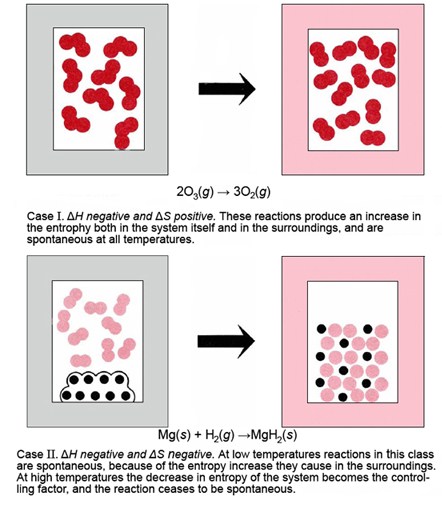
Caso l: La reacción es exotérmica, y ΔS sys es positiva El ejemplo ilustrado en la Figura\(\PageIndex{1}\) I es la descomposición del ozono a oxígeno.
\[\ce{2O3(g)→3O2(g)}\qquad 1 \text{ atm} \nonumber \]
para los cuales Δ H m° (298 K) = —285 kJ mol —1 y Δ S m° (298 K) = +137 J K —1 mol —1. Una reacción de este tipo es siempre espontánea porque la entropía tanto del entorno como del sistema se ve incrementada por su ocurrencia.
Caso 2: La reacción es exotérmica, y es ΔS sys negativa El ejemplo ilustrado en la Figura\(\PageIndex{1}\) (II) es la reacción de magnesio metálico con hidrógeno gaseoso para formar hidruro de magnesio:
\[\ce{Mg(s) + H2(g) → MgH2(g)} \qquad 1 \text{ atm} \nonumber \]
para el cual Δ H m° (298 K) = —76.1 kJ mol —1 y Δ S m° (298 K) = —132.1 J K —1 mol —1. Las reacciones de este tipo pueden ser espontáneas o no espontáneas dependiendo de la temperatura. A bajas temperaturas cuando el efecto sobre el entorno es más importante, la naturaleza exotérmica de la reacción la hace espontánea. A altas temperaturas predomina el efecto de Δ S sys. Dado que Δ S sys es negativo (las moléculas H 2 libres se convierten en iones H — fijos), la reacción debe volverse no espontánea a altas temperaturas. Experimentalmente, el MgH 2 sólido no se formará a partir de sus elementos por encima de 560 K, y cualquiera formado a una temperatura más baja se descompondrá.
Caso 3: La reacción es endotérmica y ΔS sys es positiva El ejemplo ilustrado en la Figura\(\PageIndex{2}\) (III) es la vaporización de bromo líquido:
\[\ce{Br2(l) → Br2(g)}\qquad 1 \text{ atm} \nonumber \]
para lo cual Δ H m° (298 K) = +31.0 kJ mol —1 y Δ S m° (298 K) = 93.1 J K —1 mol —1. Este ejemplo suele clasificarse como un cambio físico más que como químico, pero tales distinciones no son importantes en la termodinámica. Como en el caso anterior esta reacción puede ser espontánea o no espontánea a diferentes temperaturas. A bajas temperaturas, el bromo no hervirá porque el incremento de entropía que ocurre en el bromo a medida que se convierte en vapor no es suficiente para compensar la disminución de la entropía, que el entorno experimenta en el suministro de la energía térmica que se necesita para el cambio de estado. A temperaturas más altas el efecto de entropía en el entorno se vuelve menos pronunciado, y el valor positivo de Δ S sys hace que la reacción sea espontánea. A una presión de 101.3 kPa (1atm), el bromo no hervirá por debajo de 331 K (58°C), pero por encima de esta temperatura lo hará.
Caso 4: La reacción es endotérmica y ΔS sys es negativa El ejemplo ilustrado en la Figura\(\PageIndex{2}\) IV es la reacción entre plata y nitrógeno para formar azida de plata, AgN 3:\[\ce{2Ag(s) + 3N2(g) → 2AgN3(s)} \nonumber \]
para el cual Δ H m° (298 K) = +620.6 kJ mol —1 y Δ S m° (298 K) = —461.5 J K —1 mol —1. Las reacciones de este tipo nunca pueden ser espontáneas. De ocurrir esta reacción, se reduciría la entropía tanto del sistema como del entorno en contradicción con la segunda ley. Dado que la reacción directa es no espontánea, esperamos que la reacción inversa sea espontánea. Esta predicción se confirma experimentalmente. Cuando la azida plateada es golpeada por un martillo, ¡se descompone explosivamente en sus elementos!
Clasificar las siguientes reacciones como uno de los cuatro posibles tipos (casos) recién descritos. De ahí sugerir si la reacción será espontánea a (i) una temperatura muy baja, y (ii) a una temperatura muy alta.
|
Δ H m° (298 K)/ kJ mol —1 |
Δ S m° (298 K)/ J K —1 mol —1 |
|
| a) N 2 (g) + F 2 (g) → 2NF 3 (g) | —249 | —277.8 |
| b) N 2 (g) + 3Cl 2 (g) → 2NCl 3 (g) | +460 | —275 |
| c) N 2 F 4 (g) → 2NF 2 (g) | +93.3 | +198.3 |
| d) C 3 H 8 (g) + 5O 2 (g) → 3CO 2 (g) + 4H 2 O (g) | —2044.7 | +101.3 |
Solución
a) Esta reacción es exotérmica y Δ S es negativa. Pertenece al tipo 2 y será espontáneo a bajas temperaturas pero no espontáneo a altas temperaturas.
b) Dado que esta reacción es endotérmica y Δ S es negativa, pertenece al tipo 4. No puede ser espontáneo a ninguna temperatura.
c) Dado que esta reacción es endotérmica pero Δ S es positiva, pertenece al tipo 3. Será espontáneo a altas temperaturas y no espontáneo a bajas temperaturas. (Todas las reacciones de disociación pertenecen a esta clase.)
d) Esta reacción pertenece al tipo 1 y es espontánea a todas las temperaturas.
| Compuesto |
Δ H f /kJ mol —1 |
Δ H f /kcal m ol —1 |
Compuesto |
Δ H f /kJ mol —1 |
Δ H f /kcal mol —1 |
|---|---|---|---|---|---|
| AgCl (s) | —127.068 | —30.35 | H 2 O (g) | —241.818 | —57.79 |
| AgN 3 (s) | +620.6 | +148.3 | H 2 O (l) | —285.8 | —68.3 |
| Ag 2 O (s) | —31.0 | —7.41 | H 2 O 2 (l) | —187.78 | —44.86 |
| Al 2 O 3 (s) | —1675.7 | —400.40 | H 2 S (g) | —20.63 | —4.93 |
| Br 2 (l) | 0.0 | 0.00 | HgO (s) | —90.83 | —21.70 |
| Br 2 (g) | +30.907 | +7.385 | I 2 (s) | 0.0 | 0.0 |
| C (s), grafito | 0.0 | 0.00 | I 2 (g) | +62.438 | +14.92 |
| C (s), diamante | +1.895 | +0.453 | KCl (s) | —436.747 | —104.36 |
| CH 4 (g) | —74.81 | —17.88 | KBr (s) | —393.798 | —94.097 |
| CO (g) | —110.525 | —26.41 | MgO (s) | —601.7 | —143.77 |
| CO 2 (g) | —393.509 | —94.05 | NH 3 (g) | —46.11 | —11.02 |
| C 2 H 2 (g) | +226.73 | +54.18 | NO (g) | +90.25 | +21.57 |
| C 2 H 4 (g) | +52.26 | +12.49 | NO 2 (g) | +33.18 | +7.93 |
| C 2 H 6 (g) | —84.68 | —20.23 | N 2 O 4 (g) | +9.16 | +2.19 |
| C 6 H 6 (l) | +49.03 | +11.72 | NF 3 (g) | —124.7 | —29.80 |
| CaO (s) | —635.09 | —151.75 | NaBr (s) | —361.062 | —86.28 |
| CaCo 3 (s) | —1206.92 | —288.39 | NaCl (s) | —411.153 | —98.24 |
| CuO (s) | —157.3 | —37.59 | O 3 (g) | +142.7 | +34.11 |
| Fe 2 O 3 (s) | —824.2 | —196.9 | SO 2 (g) | —296.83 | —70.93 |
| HBr (g) | —36.4 | —8.70 | SO 3 (g) | —395.72 | —94.56 |
| HCl (g) | —92.307 | —22.06 | ZnO (s) | —348.28 | —83.22 |
| HI (g) | +26.48 | +6.33 |
Arriba hay una tabla de entalpías estándar de formación a 25°C, es decir, el cambio de entalpía que se produce cuando se forma un compuesto a partir de sus elementos constituyentes. Por ejemplo, el valor de entalpía de formación de Δ H m = —285.8 kJ mol —1 es el cambio de entalpía para la reacción: H 2 (g) + ½O 2 (g) → H 2 O (l). Es importante señalar que la entalpía de formación para un elemento en su estado más estable es 0. Usando estas entalpías de formación y Ley de Hess se puede determinar el cambio de entalpía de cualquier reacción que involucre a los compuestos con una entalpía de formación conocida.
Esta tabla se encuentra en Corechem:Entalpias Estándar de Formación


