Presión de Vapor
- Page ID
- 74974
Habilidades para Desarrollar
- Definir la presión de vapor
Siempre que tengamos un líquido con algún espacio por encima de él, algunas de las moléculas en la superficie del líquido podrían escapar al espacio y volverse gaseosas si tienen suficiente energía cinética. Si el líquido está en una botella cerrada, entonces las moléculas en la fase gaseosa no pueden escapar por completo. Ahí estará el líquido, y por encima de él, un gas de la misma molécula. Las partículas de gas a veces chocan con el líquido, y si tienen una energía cinética lo suficientemente pequeña, podrían permanecer en él. Así, las moléculas pueden ir y venir entre el líquido y el gas. A medida que aumenta la cantidad de gas, es más probable que choque con la superficie y se atasque, por lo que las tasas de convertirse en gas y convertirse en líquido se vuelven las mismas. Se establecerá un equilibrio. La presión parcial de ese gas por encima del líquido en equilibrio dependerá del tipo de molécula y de la temperatura. Si la temperatura del líquido aumenta, más moléculas tendrán suficiente energía cinética para escapar del líquido y ser gas. Si la molécula tiene fuertes fuerzas intermoleculares, tomará más energía cinética para escapar del líquido.
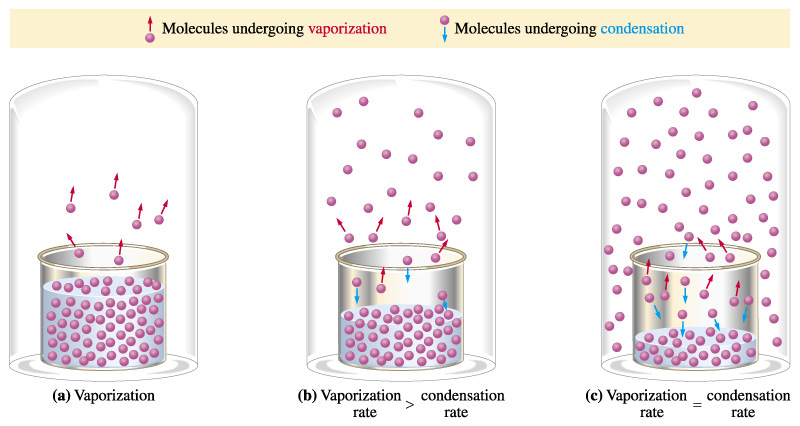
En un recipiente abierto, un líquido como el agua se evaporará por completo eventualmente, incluso a bajas temperaturas (incluso el hielo desaparecerá eventualmente, porque los sólidos también tienen presión de vapor). Esto sucede porque cuando las moléculas se convierten en gas, pueden difundirse lejos en lugar de permanecer cerca de la superficie, y tal vez chocar con ella y volver a atascarse.
La presión de vapor de un líquido no depende de la presión en general (al menos no mucho). La presencia de otras moléculas de gas no afectará realmente las tasas de las moléculas líquidas que salen de la superficie o regresan a ella, porque sus colisiones con el líquido no importan. Cuando recolectamos gases sobre un líquido, como en el método de Hales, debemos incluir una corrección para la presión de vapor del líquido. Esto lo podemos encontrar en una tabla si conocemos la temperatura.
Algunos líquidos tienen una alta presión de vapor y otros tienen baja presión de vapor. Esto depende de las fuerzas intermoleculares, como las fuerzas de dispersión de Londres, las fuerzas dipolo-dipolo y los enlaces de hidrógeno. Si las fuerzas intermoleculares son fuertes, la presión de vapor será baja. Si son débiles, será alto. Los líquidos volátiles tienen alta presión de vapor.
Enlaces externos
Colaboradores y Atribuciones
Emily V Eames (City College of San Francisco)

