Lavoisier
- Page ID
- 74943
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Habilidades para Desarrollar
- Entender por qué a Lavoisier a veces se le llama “el Padre de la Química Moderna”
- Distinguir precisión de precisión
Entonces, ¿qué pasó para convertir la alquimia, que era como la elaboración de pociones mágicas en Harry Potter, en la ciencia de la química? Fue medición. Medición cuidadosa y cuidadosa de cantidades, tales como masas, volúmenes, densidades, temperaturas, presiones.
Uno de los primeros héroes de la medición fue Antoine Lavoisier. Fue uno de los primeros verdaderos científicos químicos. Realizó experimentos cuidadosos, e intentó no sacar conclusiones salvo las requeridas por sus datos. Dijo que el hecho, la idea y la palabra deben estar lo más estrechamente conectados posible: que no puedes mejorar tu idioma sin mejorar tu pensamiento, y no puedes mejorar tu pensamiento sin mejorar tu idioma. Por lo que fue pionero en una nomenclatura química sistemática que es esencialmente la que usamos hoy en día. Sorprendentemente, si lees su texto, escrito en 1789, pretendía introducir la química a los principiantes, gran parte de ella sigue siendo perfectamente comprensible e incluso correcta para los estándares modernos.
.jpg)
Lavoisier describe primero los estados de la materia: gases, líquidos y sólidos. Señala cuando se calienta un material sólido tiende a expandirse, convirtiéndose primero en un líquido, que ocupa un volumen constante, pero se puede verter, a diferencia de un sólido. Más calentamiento, y se convierte en un gas, que describe como elástico porque se expandirá o comprimirá a diferentes volúmenes dependiendo de la presión. A diferencia de los filósofos griegos, entendió que esto es un cambio físico, no un cambio químico, y tiene una buena intuición a escala submicroscópica de lo que está sucediendo: las partículas del material no cambian, simplemente se separan más.
Reconoció como elementos los siguientes: oxígeno, nitrógeno, hidrógeno, azufre, fósforo, cloro y flúor (aunque desconocía sus formas elementales), carbono, hierro, cobre, plata, oro, mercurio, plomo, estaño, antimonio, arsénico, bismuto, cobalto, manganeso, molibdeno, níquel, platino, tungsteno y zinc.
Quemó azufre y fósforo y carbón vegetal (carbono) e hizo cuidadosas observaciones, a menudo usando la campana sobre un cubo de mercurio como se muestra en el dibujo de su libro, Figura 1. Este es un ejemplo de un cambio químico o reacción química, en la que los reactivos químicos se convierten en diferentes productos químicos. Si enciendes el azufre en el platillo etiquetado D debajo de la campana de aire, se quema hasta que se apaga dejando algo de azufre extra. El aire que queda en el frasco ya no es bueno para respirar. Si pones un ratón en el frasco, morirá, tal como lo hizo la llama. Esto demuestra el concepto de reactivo limitante. La reacción o la quema se detuvo cuando se quedó sin oxígeno, dejando principalmente nitrógeno (y algunos otros gases traza) en la jarra. Priestley, otro científico, le mostró cómo preparar gas oxígeno puro, y usó esto para hacer muchos experimentos de quema también.
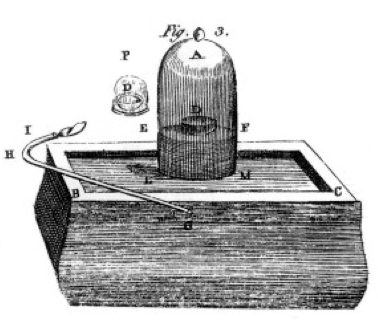
Lavoisier estaba obsesionado con la medición. Desarrolló elaborados aparatos para medir todo. Quemaría fósforo, como se muestra en la Figura 1, y observaría la formación de un producto escamoso blanco. El fósforo (el reactivo en este caso) no era soluble en agua, sino que el producto lo era, por lo que recogió el producto con mucho cuidado, separándolo del fósforo sin reaccionar lavándolo con agua. Después del secado, pudo medir cuánto fósforo se había quemado, cuánto oxígeno se había consumido (porque conocía la densidad del gas oxígeno) y cuánto producto se había formado. Encontró que la masa de producto era la suma de las masas de reactivo consumidas, en cada experimento. Esta es la ley de conservación de la masa (que, en realidad, también habían utilizado algunos alquimistas y químicos anteriores). También observó que el fósforo no tiene sabor, pero el producto, al que llamó ácido fosfórico, es agrio. Sabía por estos experimentos que en muchos casos los elementos se combinan solo en ciertas proporciones, y también que el oxígeno puede combinarse con azufre, fósforo, etc en dos proporciones diferentes. Nos dio la terminología que todavía usamos hoy en día: el ácido sulfúrico está compuesto por azufre y más oxígeno, el ácido sulfuroso está compuesto por azufre y menos oxígeno. -ous significa menos oxígeno; -ic significa más oxígeno. Consulte la página de nomenclatura para más detalles.
Lavoisier prestó mucha atención a la precisión y precisión. Por ejemplo, en el experimento que acabamos de describir, midió el volumen de gas en la campana, antes y después de la reacción, pero señaló que después de la reacción, se debe esperar hasta que la temperatura vuelva a lo que era cuando midió originalmente. Si el gas está caliente al medir su volumen después de la reacción, se habrá expandido y su densidad estándar no se aplicará. Esto introduciría un error sistemático en las mediciones: cada vez que realices el experimento, pensarás que hay más gas sobrante de lo que realmente hay, y tu medición no será precisa. Si el resultado promedio de tu experimento está cerca del valor correcto, es exacto. Sin embargo, si tu experimento da números muy diferentes cada vez, incluso si el promedio es correcto y el experimento es exacto, no es preciso. La precisión es la diferencia entre reunirse “alrededor de las 2 en punto” y reunirse “a las 3 minutos y 27 segundos antes de las 2 de la tarde”. La precisión es lo específico que eres, la cantidad de detalle que usas. Lavoisier también ayudó a desarrollar el sistema de unidades (kg, L, m) que actualmente están en uso en Corea y muchos otros países.

En general, si bien no hizo muchos experimentos originales que nadie más había hecho antes, hizo sus experimentos con mucho cuidado, por lo que fueron lo más precisos y precisos posible, y luego pensó en ellos con claridad y creó palabras para describir los químicos e ideas que ayudaron a que todo fuera más claro. Si lees un libro de texto de química escrito antes de Lavoiser, estarás muy confundido porque los nombres de los químicos estarían basados en la historia (y sonaría como si vinieran de Harry Potter), en lugar de estar basados en lo que son los químicos. Si lees un texto de química escrito después de Lavoiser, reconocerás el lenguaje como similar al que usamos hoy en día.
Resumen
La precisión describe qué tan cerca está un valor medido del valor real. La precisión describe qué tan bien concuerdan un grupo de valores medidos entre sí. La ley de conservación de masas establece que la materia no puede ser creada ni destruida por un proceso químico o físico. Esto da como resultado que la suma de las masas de reactante consumidas en cualquier experimento sea igual a la masa del producto. Los cambios químicos implican cambiar la identidad química de una sustancia de tal manera que se formen nuevas sustancias. Los cambios físicos implican alterar una sustancia sin cambiar su identidad química. La combustión y la oxidación son dos ejemplos de procesos químicos, mientras que la ebullición y la fusión son ejemplos de procesos físicos. Las reacciones químicas implican convertir reactivos, químicos que se consumen en el proceso de cambio químico, en productos, químicos producidos a través del proceso de cambio químico que tienen una composición diferente a la de los reactivos. Un reactivo limitante determina, o limita, la cantidad de producto que se puede producir a partir de una reacción química.
Enlace exterior
Colaboradores y Atribuciones
Emily V Eames (City College of San Francisco)

