Solubilidad y Precipitación
( \newcommand{\kernel}{\mathrm{null}\,}\)
Habilidades para Desarrollar
- Describir lo que ocurre en una reacción de precipitación
La precipitación es el proceso de un compuesto que sale de la solución. Es lo opuesto a la disolución o solvatación. En disolución, las partículas de soluto se separan entre sí y están rodeadas por moléculas de disolvente. En la precipitación, las partículas de soluto se encuentran entre sí y forman un sólido juntas. A este sólido se le llama precipitado o a veces se abrevia “ppt”.
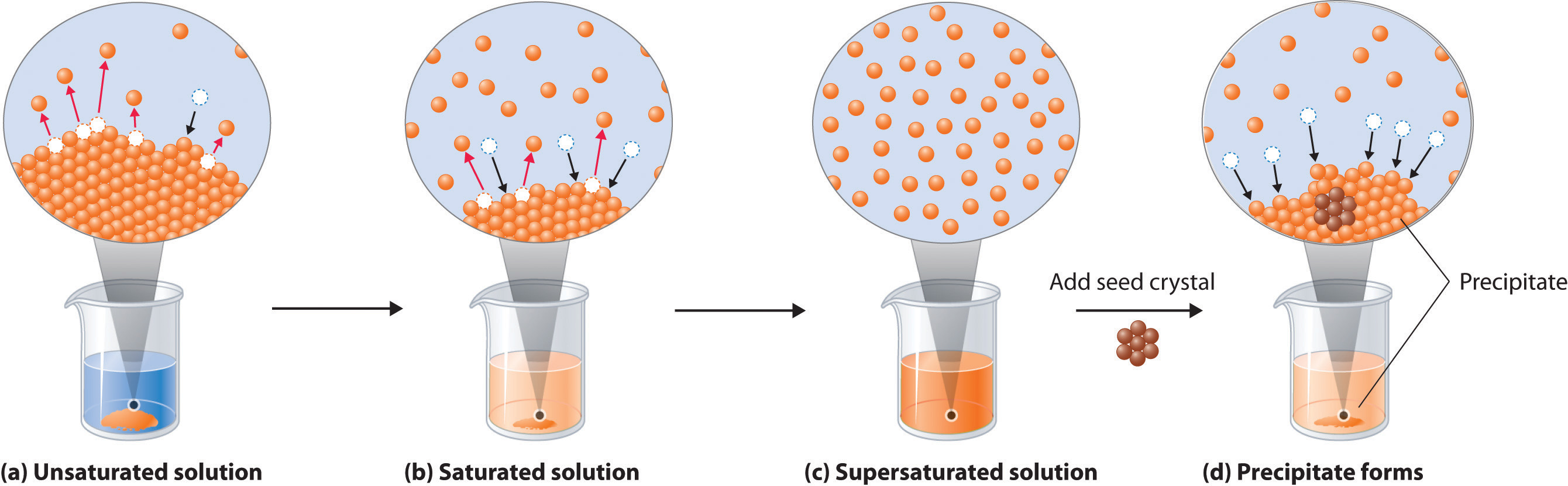
Equilibrios de Solubilidad
La precipitación y disolución son un gran ejemplo de un equilibrio dinámico (también descrito aquí). Cada vez que haya una solución con un poco de soluto sólido en ella, ambos procesos van a estar sucediendo a la vez. Algunas moléculas o iones dejarán el sólido y se solvatarán, y algunas partículas de soluto solvatadas chocarán en el sólido y quedarán atrapadas allí. Las tasas de los 2 procesos determinan el efecto general: si la precipitación ocurre más rápido, entonces una gran cantidad de sólidos puede salir de la solución muy rápidamente. Si la disolución ocurre más rápido, entonces el sólido se disolverá. A medida que la solución se vuelve más concentrada, la velocidad de precipitación aumentará y la velocidad de disolución disminuirá, de manera que eventualmente la concentración dejará de cambiar, y esto es equilibrio. Cuando se alcanza el equilibrio, la solución se satura, y esa concentración define la solubilidad del soluto. La solubilidad es la concentración máxima posible, y se da en M, g/L u otras unidades. La solubilidad cambia con la temperatura, por lo que si buscas datos de solubilidad especificará la temperatura.
Reacciones de precipitación
La precipitación puede ocurrir por diversas razones, como que se enfrió una solución, o se eliminó algún disolvente por evaporación, o ambos. (Esto a menudo se usa como una forma de purificar un compuesto). También puede tener una reacción de precipitación, cuando mezcla dos soluciones juntas y una nueva combinación de iones está sobresaturada en la solución combinada. Por ejemplo, tal vez mezclaste una solución de nitrato de plata (I) y cloruro de sodio. El cloruro de plata (I) es muy insoluble, por lo que precipitará, dejando nitrato de sodio soluble en solución. Las reacciones de precipitación pueden ser una buena manera de preparar una sal que desee a partir de algunas otras sales con el anión y catión adecuados. Las reacciones de precipitación también se pueden utilizar para detectar la presencia de iones particulares en solución. Por ejemplo, podrías probar cloruro, yoduro y bromuro en una solución desconocida agregando iones de plata (I) y buscando precipitación.
Predicción de reacciones de precipitación
Los estudiantes principiantes de química suelen memorizar una lista de reglas de solubilidad. Aquí está (estas reglas serán un poco diferentes en diferentes libros de texto, porque las personas podrían no tener exactamente la misma definición de soluble o insoluble):
- La mayoría de las sales de nitrato y acetato son solubles
- La mayoría de las sales de amonio y cationes alcalinos son solubles
- La mayoría de las sales de cloruro, bromuro y yoduro son solubles, excepto las de Ag (I), Pb (II) y Hg (I)
- La mayoría de las sales de sulfato son solubles, excepto las de bario, calcio y Pb (II)
- La mayoría de las sales de hidróxido son solo ligeramente solubles, excepto las de sodio y potasio
- La mayoría de las sales de sulfuro, carbonato y fosfato son solo ligeramente solubles
Puede usar esta lista para predecir cuándo ocurrirán las reacciones de precipitación. Para ello, no suele tener que preocuparse por si los compuestos son electrolitos fuertes o débiles, se puede pensar en los iones como separados. La razón es que por lo general algunos de los iones estarán separados, y una vez que esos precipiten con una nueva pareja, más de los iones compuestos originales se separarán entre sí, y el proceso continuará.
Escribir ecuaciones para reacciones de precipitación
Los químicos pueden escribir ecuaciones de diferentes maneras para enfatizar las partes importantes. Por ejemplo, podríamos escribir una ecuación como esta, que describe mezclar 2 soluciones de diferentes sales solubles y obtener un precipitado:
AgNo3(aq)+NaCl(aq) rightarrowAgCl(s)+NaNO3(aq)
Como alternativa, podríamos escribir la misma reacción solo enfocándonos en la parte que forma el precipitado, y dejando fuera los iones del espectador que realmente no hacen nada, solo quédate en solución:
Ag+(aq)+Cl—(aq) rightarrowAgCl(s) A los estudiantes de
química a veces se les pide que demuestren su comprensión de la disociación escribiendo todos los iones por separado, así:
Ag+(aq)+NO–3(aq)+Cl–(aq)+Na+→AgCl(s)+Na++NO–3(aq)
Ningún químico real sería probable que hiciera esto porque es una molestia. (También es un poco gracioso porque muchas sales no son electrolitos fuertes, por lo que los maestros podrían estar diciendo a sus alumnos que escriban una ecuación que no muestre lo que realmente está sucediendo). No obstante, sí ayuda a mostrar lo que significa ser un ion espectador, ya que son iguales en ambos lados cuando lo escribes así.
¿Qué determina la solubilidad?
La solubilidad depende de la estabilidad relativa de los estados sólido y solvatado para un compuesto en particular. Por ejemplo, si tiene interacciones muy fuertes entre moléculas o iones en estado sólido, entonces no será muy soluble a menos que las interaciones de solvatación también sean muy fuertes. (Las sales iónicas son un buen ejemplo: generalmente tienen interacciones fuertes en los estados sólido y solvatado). Si las interacciones en el sólido son débiles, el compuesto aún puede ser insoluble en disolventes polares si las interacciones con el disolvente son más débiles que las interacciones de Coulomb de las moléculas de disolvente con otras moléculas de disolvente. (Es por esto que la cera es insoluble en agua: es no polar, por lo que las interacciones cera-cera son débiles, pero las interacciones cera-agua son más débiles que las interacciones agua-agua). No podemos explicar qué hace que estas interacciones sean fuertes o débiles bien hasta después de estudiar el enlace químico, pero en general los compuestos iónicos con cargas más grandes en los iones y los iones más pequeños son menos solubles, ya que pueden tener interacciones de Coulomb más fuertes en el sólido.
Enlaces externos
- Solubilidad explicada (13 min)
- CrashCourse Química: Precipitación (12 min)
Colaboradores y Atribuciones
Emily V Eames (City College of San Francisco)

