4.3: Bonos Dobles y Triples
- Page ID
- 76648
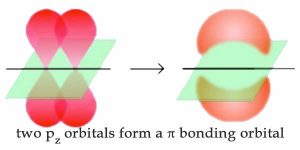
Hasta el momento, hemos considerado lo que se conoce como enlaces simples; es decir, todos los\(\mathrm{C–H}\) enlaces\(\mathrm{C–C}\) y en alcanos, y todos los enlaces en diamante. Cada enlace sencillo involucra dos (y solo dos) electrones que son descritos por un orbital molecular de enlace. En tal orbital de enlace, la mayor parte de la densidad de electrones se localiza entre los dos átomos unidos en un enlace lineal sigma (\(\sigma\)). Sin embargo, ya hemos discutido, aunque brevemente, enlaces que involucran a más de un par de electrones, es decir, los que se encuentran en el grafito. Recordemos que para el grafito y el grafeno los enlaces entre los átomos de carbono en el plano laminar involucran orbitales hibridados que son mezclas de los orbitales\(2\mathrm{s}^{2}\) \(2\mathrm{p}_{x}\)y y\(2\mathrm{p}_{y}\) (es decir,\(\mathrm{sp}^{2}\) híbridos) dejando un\(2\mathrm{p}_{z}\) orbital no hibridado. En la unión, estos\(2\mathrm{p}_{z}\) orbitales no hibridados se reorganizan para formar lo que se conoce como orbital de unión pi (\(\pi\)). En\(\pi\) los orbitales, la densidad de electrones se encuentra por encima y por debajo del eje que conecta los átomos unidos. La combinación\(\simga\) y\(\pi\) unión de orbitales produce un doble enlace. Los dobles enlaces están indicados por dos líneas, por ejemplo como en\(\mathrm{CH}_{2}\mathrm{=CH}_{2}\) (eteno).
Formas de Moléculas con Doble (y Triple) Enlace


Podemos aplicar el mismo pensamiento sobre la disposición de los enlaces alrededor de los átomos\(\mathrm{CH}_{2}\mathrm{=CH}_{2}\) de carbono de la misma manera que hicimos para\(\mathrm{CH}_{3}\mathrm{-CH}_{3}\). En eteno cada átomo de carbono está rodeado por tres centros de densidad electrónica, dos\(\mathrm{H}\) s y uno\(\mathrm{C}\). Tenga en cuenta que el doble enlace cuenta como un solo centro de densidad electrónica (\(\rightarrow\)). Hay una serie de puntos importantes a tener en cuenta al considerar los efectos de los dobles enlaces sobre una molécula y sus propiedades. Primero, un\(\mathrm{C=C}\) doble enlace es típicamente menos estable (es decir, más reactivo) que dos enlaces simples separados. Cuando llegamos a pensar en reacciones encontraremos que reemplazar un doble enlace por dos enlaces simples típicamente produce un sistema más estable. En segundo lugar, aunque hay más o menos rotación libre alrededor del eje de un enlace sencillo a temperatura ambiente, la rotación está bloqueada por la presencia de un doble enlace. Para que ocurra una rotación, el enlace π (en el que hay densidad de electrones por encima y por debajo del eje entre los dos átomos de carbono) debe romperse y luego reformarse. La presencia de un doble enlace tiene distintos efectos sobre la forma molecular. La disposición de energía mínima para tres centros es una disposición bidimensional en la que los grupos están orientados aproximadamente\(120^{\circ}\) entre sí; una disposición conocida como geometría plana trigonal.
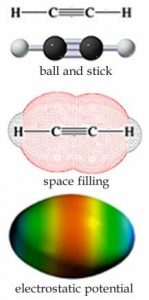
Hay un tipo más común de enlace que puede formar el carbono, que es un triple enlace. Por ejemplo, cada carbono en\(\mathrm{C}_{2}\mathrm{H}_{2}\) (etino) está rodeado por solo dos centros de densidad electrónica: un único híbrido sp enlaces orbitales entre un átomo de carbono y un átomo de hidrógeno y un triple enlace, que puede considerarse como un\(\sigma\) enlace y dos\(\pi\) enlaces entre los carbonos, mostrados en la figura ( \(\rightarrow\)). La disposición de energía más baja alrededor de cada carbono es una línea en la que se encuentra el ángulo entre los enlaces\(180^{\circ}\). Como antes, un triple enlace es menos estable que tres enlaces simples, ¡y se pueden esperar reacciones!
Vemos que en la mayoría de las condiciones, un átomo de carbono puede participar en un máximo de cuatro enlaces; ya sea cuatro enlaces sencillos, dos enlaces sencillos y un doble enlace, o un enlace sencillo y un triple enlace.
Preguntas para responder
- Dado un hidrocarburo en particular, ¿qué factores influirían en su predicción de sus puntos de fusión y ebullición? ¿Se pueden generar algunas reglas tentativas?
- ¿Cómo influye la presencia de un doble enlace en la estructura de un hidrocarburo?
- ¿En qué se diferencia la presencia de un triple enlace de la de un doble enlace?
- ¿Por qué crees que no hay tetrabondeado de carbono (es decir\(\mathrm{C}\) cuatro enlaces\(\mathrm{C}\)).
Preguntas para reflexionar
- ¿Qué limita el tamaño y la forma de un hidrocarburo?


