4.4: Vinculación en Nitrógeno, Oxígeno y Flúor
- Page ID
- 76649
Aunque la unión de átomos de hidrógeno y carbono puede generar una notable variedad de moléculas, los hidrocarburos son realmente bastante aburridos (químicamente). Participan en una gama bastante limitada de reacciones y no se esperaría, por sí solas, que produjeran nada como la vida. Por supuesto que hay muchos otros elementos, y sus propiedades agregan complejidad química al comportamiento molecular. Desde la perspectiva de los sistemas vivos dos de los elementos más interesantes son el nitrógeno y el oxígeno. El carbono tiene seis electrones (dos núcleos y cuatro valencia) y puede formar cuatro enlaces con átomos vecinos. El nitrógeno tiene siete electrones: dos núcleos y cinco valencia:\(1 \mathrm{s}^{2}, 2 \mathrm{s}^{2}, 2 \mathrm{p}_{\mathrm{x}} {}^{1}, 2 \mathrm{p}_{\mathrm{y}} {}^{1}, 2 \mathrm{p}_{\mathrm{z}} {}^{1}\). Entonces, si estás siguiendo las reglas, bien podrías suponer que el nitrógeno podría formar cinco enlaces (después de todo, tiene cinco electrones de valencia). Pero cuando miramos cuidadosamente, nunca vemos un átomo de nitrógeno haciendo cinco enlaces, y en todos los compuestos estables solo hace tres enlaces. Podemos explicar esta observación de varias maneras. Un factor es que los átomos de nitrógeno son demasiado pequeños para soportar cinco centros de densidad electrónica alrededor de sí mismos porque los enlaces comienzan a solaparse, lo cual es desestabilizante, tal como vimos con grupos voluminosos alrededor de un carbono. Otro factor es que sólo hay cuatro orbitales disponibles en nitrógeno en la segunda capa cuántica. Si el nitrógeno formara cinco enlaces tendría que usar orbitales de la siguiente capa cuántica (3), pero estos orbitales son tan altos en energía que la energía requerida no sería compensada por la energía liberada en la formación del enlace. Juntos, estos factores significan que el nitrógeno, y de hecho todos los elementos de la segunda fila de la tabla periódica, se limitan a arreglos de unión con no más de cuatro centros de densidad electrónica. Como veremos más adelante, los elementos de la siguiente fila, como el fósforo (\(\mathrm{P}\)) y el azufre (\(\mathrm{S}\)), son más grandes y tienen más orbitales disponibles para la unión. Estos elementos pueden formar hasta seis centros de densidad electrónica.
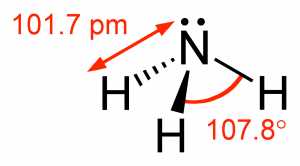
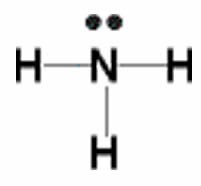
El compuesto más simple de nitrógeno es el nitrógeno molecular,\(\mathrm{N}_{2}\). Los dos átomos de nitrógeno están unidos entre sí por un triple enlace, que consiste en\(\pi\) enlaces a\(\sigma\) y dos. Nitrógeno molecular,\(\mathrm{N}_{2}\) [8] Una molécula común que contiene nitrógeno es el amoníaco (\(\mathrm{NH}_{3}\)), que es análogo al metano (\(\mathrm{CH}_{3}\)). En amoníaco el átomo de nitrógeno está unido a tres átomos de hidrógeno. Estos tres enlaces involucran tres de los electrones de valencia del nitrógeno; los dos electrones de valencia restantes ocupan un orbital no enlazante y se conocen como un par solitario. Dado el modelo orbital de hibridación molecular que estamos utilizando, esto implica que se forman cuatro\(\mathrm{sp}^{3}\) orbitales a partir de los átomos de nitrógeno\(2\mathrm{s}\) y\(2\mathrm{s}\) orbitales que conducen a cuatro centros de densidad de electrones alrededor del nitrógeno. La figura muestra tres representaciones de amoníaco. El primero indica los\(\mathrm{N–H}\) enlaces pero no logra mostrar el par solitario orbital. El segundo utiliza la convención de cuña y guión y puntos para ilustrar la geometría de ambos enlaces y el par solitario. La forma real de la molécula está determinada por las disposiciones de las nubes de electrones y los átomos unidos. En\(\mathrm{NH}_{3}\) los tres enlaces son equivalentes (\(\mathrm{N–H}\)) y así deben ser simétricos, pero el par solitario orbital es diferente porque ocupa más espacio que los pares de unión, ¿te imaginas por qué? Esto tiene un efecto sutil en la forma de la molécula. Los ángulos entre los\(\mathrm{C–H}\) enlaces en\(\mathrm{CH}_{3}\) son iguales y\(109^{\circ}\) mientras que los ángulos entre los\(\mathrm{N–H}\) enlaces en\(\mathrm{NH}_{3}\) son ligeramente más pequeños,\(107.8^{\circ}\). La forma de la molécula en sí (como se describe por los átomos) es una pirámide basada en triángulos en lugar de un tetraedro. Finalmente, la estructura de Lewis (la representación más abstracta), indica los enlaces y electrones de pares solitarios pero da una representación poco realista de la geometría de la molécula. Depende del lector suministrar la información implícita contenida en la estructura sobre los ángulos de unión y la forma general.
Unión de Oxígeno y Flúor
Consideremos ahora el oxígeno (\(\mathrm{O}\)) which has eight electrons, two in the core and six valence (\(1 \mathrm{s}^{2}, 2 \mathrm{s}^{2}, 2 \mathrm{p}_{\mathrm{x}} {}^{1}, 2 \mathrm{p}_{\mathrm{y}} {}^{1}, 2 \mathrm{p}_{\mathrm{z}} {}^{1}\)). Al igual que con el nitrógeno, el oxígeno no utiliza todos sus electrones para formar seis enlaces porque es demasiado pequeño y los orbitales que necesitarían usarse para hacer seis enlaces son demasiado altos en energía para ser energéticamente accesibles; es decir, no se liberaría suficiente energía al formarse el enlace para “pagar” esa energía.
La molécula que contiene oxígeno más simple es el oxígeno molecular,\(\mathrm{O}_{2}\). En nuestro modelo de enlace covalente simple los dos átomos de oxígeno están conectados por un\(\pi\) enlace\(\sigma\) y uno, formando un doble enlace. [9] El siguiente compuesto de oxígeno más simple, estable, más común y, con mucho, el más importante, al menos desde la perspectiva de los organismos vivos, es el agua (\(\mathrm{H}_{2}\mathrm{O}\)). En el agua hay dos\(\mathrm{O-H}\) enlaces y dos orbitales no vinculantes de par solitario. Como en el caso del nitrógeno, los orbitales son\(\mathrm{sp}^{3}\) híbridos y el átomo de oxígeno está rodeado por cuatro centros de densidad electrónica (ver un patrón aquí?) , dos bonos y dos pares solitarios. Nuevamente, los orbitales de pares solitarios son más grandes que los orbitales de\(\mathrm{O-H}\) unión, lo que distorsiona la simetría tetraédrica de la molécula. En lugar de ángulos iguales de\(109^{\circ}\) entre los orbitales, el ángulo entre los\(\mathrm{O-H}\) enlaces es\(104.5^{\circ}\). Cuando usamos una estructura de Lewis para representar la estructura de\(\mathrm{H}_{2}\mathrm{O}\), es crítico incluir todos los electrones de la capa de valencia.
Continuando a través de la tabla periódica vemos que el flúor es el siguiente elemento después del oxígeno. Tiene nueve electrones: dos núcleos y siete valencia. En lugar de formar siete enlaces, el flúor solo forma un enlace sencillo básicamente por las mismas razones que el oxígeno solo forma dos enlaces. El fluoruro de hidrógeno\(\mathrm{HF}\),, tiene un enlace, pero cuatro centros de densidad electrónica alrededor del flúor. Debido a que\(\mathrm{HF}\) tiene sólo dos átomos, deben por definición estar en una línea y por lo tanto no necesitamos discutir su forma.
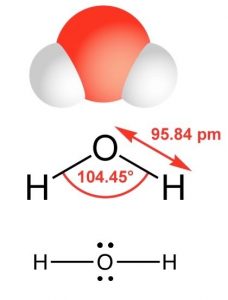
| Compuesto | Masa molar
(g/mol) |
Punto de ebullición | Tipo de enlace | Longitud del enlace (pm) | Radio atómico
(pm) |
| \(\mathrm{CH}_{4}\) | \(16\) | \(–161^{\circ}\mathrm{C}\) | \(\mathrm{C–H}\)(en\(\mathrm{CH}_{4}\)) | \(109\) | \(\mathrm{C} – 70\) |
| \(\mathrm{NH}_{3}\) | \(17\) | \(–33^{\circ}\mathrm{C}\) | \(\mathrm{N–H}\)en (\(\mathrm{NH}_{3}\)) | \(101\) | \(\mathrm{N} – 65\) |
| \(\mathrm{H}_{2}\mathrm{O}\) | \(18\) | \(100^{\circ}\mathrm{C}\) | \(\mathrm{O–H}\)(en\(\mathrm{H}_{2}\mathrm{O}\)) | \(96\) | \(\mathrm{O} – 60\) |
| \(\mathrm{HF}\) | \(20\) | \(19.5^{\circ}\mathrm{C}\) | \(\mathrm{F–H}\)en (\(\mathrm{HF}\)) | \(92\) | \(\mathrm{F} – 50\) |
| \(\mathrm{Ne}\) | \(20\) | \(–246.08^{\circ}\mathrm{C}\) | no aplica | no aplica | \(\mathrm{Ne} – 38\) |
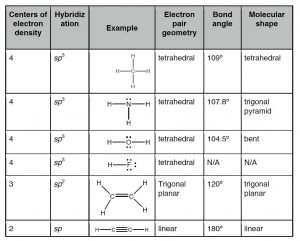
Como veremos, una estructura de Lewis válida permite extrapolar una cantidad significativa de información sobre las propiedades químicas y físicas de una molécula. Un punto confuso es que la estructura de Lewis se puede escribir de varias maneras aparentemente diferentes, que en realidad son equivalentes. La clave para recordar es que la estructura de Lewis no intenta representar la estructura tridimensional real de una molécula. Se trata de una taquigrafía (una “caricatura” si quieres) que supone que ya conoces la disposición de los orbitales. No importa cómo se dibuje, la estructura real de una\(\mathrm{H}_{2}\mathrm{O}\) molécula es la misma con un ángulo de\(104.5^{\circ}\) enlace entre los\(\mathrm{O–H}\) enlaces
| \(\mathrm{CH}_{4}\) | \(\mathrm{NH}_{3}\) | \(\mathrm{H}_{2}\mathrm{O}\) | \(\mathrm{HF}\) | \(\mathrm{Ne}\) |
| \(-258.7^{\circ} \mathrm{F}\left(-161.5^{\circ} \mathrm{C}\right)\) | \(-28.01^{\circ} \mathrm{F}\left(-33.34^{\circ} \mathrm{C}\right)\) | \(212^{\circ} \mathrm{F}\left(100^{\circ} \mathrm{C}\right)\) | \(67.1^{\circ} \mathrm{F}\left(19.5^{\circ} \mathrm{C}\right)\) | \(-410.9^{\circ} \mathrm{F}\left(-246.1^{\circ} \mathrm{C}\right)\) |
La tendencia a formar cuatro centros (enlaces o pares no enlazantes) ha llevado a la “regla del octeto” bastante engañosa, que establece que algunos elementos tienden a formar moléculas que tienen ocho electrones alrededor de cualquier átomo (excepto hidrógeno). Desafortunadamente, la regla del octeto está lejos de ser una regla porque hay muchas excepciones, como veremos más adelante. Por ejemplo, muchos de los elementos que han pasado la segunda fila de la tabla periódica son capaces de unirse a más de cuatro átomos más y algunos elementos forman compuestos estables con menos de ocho electrones. Es importante recordar que la regla del octeto no es la razón por la que los átomos se unen entre sí, sino que es una heurística útil a la hora de construir estructuras de Lewis para los elementos de la segunda fila (\(\mathrm{C}\)\(\mathrm{N}\),,\(\mathrm{O}\),\(\mathrm{F}\)).
Bonds Polarizados y Electronegatividad
Anteriormente vimos que los puntos de ebullición de los hidrocarburos tienden a aumentar a medida que aumenta el número de carbonos en el compuesto y que las moléculas con pesos moleculares similares tienen puntos de ebullición similares pero no idénticos, teniendo las formas de las moléculas un efecto, aunque relativamente pequeño. Las atracciones entre los hidrocarburos se deben a las fuerzas de dispersión de Londres que dependen del tamaño, superficie y forma de la molécula. Cuanto mayores sean estas fuerzas, más fuertemente se pegarán las moléculas y más energía (mayor temperatura) se necesitará para superar estas atracciones.
Consideremos los puntos de ebullición de algunos compuestos comunes de la segunda fila que involucran enlaces con hidrógeno\(\mathrm{CH}_{4}\)\(\mathrm{NH}_{3}\), es decir\(\mathrm{HF}\),,\(\mathrm{H}_{2}\mathrm{O}\) y, y neón (\(\mathrm{Ne}\)), que no forma enlaces con hidrógeno (los compuestos de litio, berilio y boro con hidrógeno son mucho menos común.) Todos estos compuestos tienen aproximadamente el mismo peso molecular pero diferentes formas. Con base en nuestras experiencias con los hidrocarburos, estaríamos bien justificados al predecir que tendrían puntos de ebullición algo similares. Desafortunadamente, esta predicción no está respaldada por evidencia experimental (ver Tabla). No hay una tendencia clara, así que está pasando algo que aún no hemos considerado. Para explicar estos datos tenemos que volver a una idea que discutimos en Capítulo\(3\), es decir, que el tamaño de los átomos disminuye a medida que vas atravesando una fila de la tabla periódica. No solo disminuye el tamaño (radio) de los átomos (desde\(70 \mathrm{~pm}\) para el carbono hasta\(38 \mathrm{~pm}\) el neón) sino que también lo hace la longitud de los enlaces entre los átomos y el hidrógeno (de\(109 \mathrm{~pm}\) a\(92 \mathrm{~pm}\)). Esto es a la vez sorprendente y contrario a la intuición (¡por eso te lo estamos recordando!)
\(4.4.1\)Electronegatividades de Mesa de Elementos Seleccionados
| \(\mathrm{H}\) | \(\mathrm{C}\) | \(\mathrm{N}\) | \(\mathrm{O}\) | \(\mathrm{F}\) |
| \(2.2\) | \(2.55\) | \(3.04\) | \(3.44\) | \(3.98\) |
Recuerde que el tamaño del átomo se basa en un equilibrio entre la atracción entre los electrones cargados negativamente a los protones cargados positivamente en el núcleo, las repulsiones entre los electrones a medida que se acercan entre sí, y por supuesto las reglas arcanas, pero altamente precisas de la mecánica cuántica. La razón por la que el tamaño del átomo disminuye a medida que aumenta el número de protones es que cada electrón en la capa de valencia es atraído por un número creciente de protones en el núcleo. Cuantos más protones, mayor sea esta fuerza atractiva. Al mismo tiempo, los electrones en el mismo caparazón de valencia no tienden a repelerse entre sí tanto como se podría sospechar porque están en diferentes orbitales. Por lo tanto, la carga nuclear efectiva aumenta de izquierda a derecha a través de la tabla periódica. Este incremento en la carga nuclear efectiva no solo afecta a los electrones en átomos aislados; también afecta a los electrones en enlaces. La capacidad de atraer los electrones en enlaces se llama electronegatividad, y debido a que deriva del mismo efecto que el que determina la carga nuclear efectiva y el radio atómico, la electronegatividad también tiende a aumentar de izquierda a derecha a través de una fila en la tabla periódica. También disminuye de arriba a abajo en un grupo de la tabla periódica. Esto tiene sentido porque cuantos más electrones estén del núcleo, menos serán atraídos por él. Las excepciones a esta regla son los gases nobles (helio, neón, argón, etc.); debido a que no forman enlaces con otros elementos (en circunstancias normales) sus electronegatividades generalmente no se reportan.
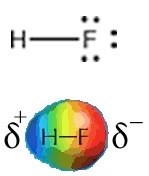
El flúor es el elemento más electronegativo y la estructura de Lewis\(\mathrm{HF}\) muestra un\(\mathrm{H–F}\) enlace y tres pares solitarios. El flúor atrae electrones con mucha fuerza, incluso los que están en el\(\mathrm{H–F}\) enlace para que el átomo de flúor termine con más de su parte justa de electrones y el átomo de hidrógeno termine con menos. Una forma de pensar sobre esto es que la densidad electrónica en el\(\mathrm{H–F}\) enlace se desplaza más cerca del átomo de flúor y alejándose del átomo de hidrógeno (\(\rightarrow\)). El resultado de esto es que el átomo de flúor tiene más carga negativa que carga positiva y el átomo de hidrógeno tiene más carga positiva que negativa. Esto lo indicamos escribiendo una\(\delta –\) carga en el átomo de flúor y una\(\delta +\) carga en el átomo de hidrógeno (a menudo\(\delta\) se usa para denotar un pequeño incremento, es decir, menor que 1). Eso quiere decir que hay una distribución desigual de la carga en la molécula. La\(\mathrm{HF}\) molécula tiene un dipolo permanente, es decir, una separación de carga; se dice que el\(\mathrm{H–F}\) enlace está polarizado y la molécula se considera polar. Los dipolos permanentes son diferentes de los dipolos transitorios asociados con las fuerzas de dispersión de Londres. Debido a sus dipolos permanentes, las moléculas\(\mathrm{HF}\) interactúan entre sí tanto de manera atractiva como repulsiva, más fuertemente en algunas orientaciones que en otras. \(\mathrm{HF}\)las moléculas son atraídas entre sí mucho más fuertemente que los átomos de neón, por ejemplo, debido a la presencia de estos dipolos permanentes. Esto da como resultado un punto de ebullición mucho\(\mathrm{HF}\) mayor para que para el neón (ver arriba). Es decir, se tiene que suministrar mucha más energía al sistema para superar la fuerza de atracción y separar\(\mathrm{HF}\) las moléculas entre sí de la que se necesita para separar los átomos de neón. Un punto importante a tener en cuenta es que la HF solo tiene un enlace, y la polaridad del enlace es la misma que la polaridad de toda la molécula. Como veremos, este no es el caso en moléculas con estructuras más complejas.
Es relativamente fácil predecir si un enlace particular es polar observando las diferencias de electronegatividad entre los átomos en ese enlace. Por lo general, los elementos en el lado izquierdo de la tabla periódica (metales) tienen electronegatividades bastante bajas y los elementos hacia el lado derecho (no metales) tienen electronegatividades más altas. Existen varias formas de calcular las electronegatividades pero en general no es muy útil memorizar números específicos. Sin embargo, es útil comprender las tendencias y poder predecir las polaridades de los enlaces. Debido a que el flúor es el elemento más electronegativo se puede esperar que forme los enlaces más polarizados con hidrógeno. [10] Así que llevemos esta lógica un poco más allá. Si el HF tiene los enlaces más polares, entonces las moléculas de HF deben pegarse con las atracciones más fuertes y el HF debe tener el punto de ebullición más alto. Pero ¡oh no! El punto de ebullición del agua es significativamente mayor (\(100 { }^{\circ}\mathrm{C}\)en comparación con\(19 { }^{\circ}\mathrm{C}\) for\(\mathrm{HF}\)). ¿Qué está pasando? El oxígeno no es tan electronegativo como el flúor y así el\(\mathrm{O-H}\) enlace no es tan polar como el\(\mathrm{H–F}\) enlace. ¿Por qué entonces el punto de ebullición es\(\mathrm{H}_{2}\mathrm{O}\)\(81 { }^{\circ}\mathrm{C}\) mayor que\(\mathrm{HF}\)? Para responder a esta pregunta necesitamos considerar otro factor que afecta la polaridad de una molécula —y que es la forma molecular.
Preguntas para responder
- ¿Por qué cree que las tendencias en carga nuclear efectiva, energía de ionización y electronegatividad están correlacionadas?
- ¿Qué significa correlated?
- ¿Se puede dibujar una imagen de (digamos) cuatro\(\mathrm{H-F}\) moléculas pegadas entre sí?
- ¿Hay algún arreglo que puedan tomar o se quedarían unidos de una manera totalmente aleatoria?
Preguntas para reflexionar
- ¿Por qué no esperarías oxígeno polimérico, es decir moléculas similares a las cadenas de hidrocarburos (o quizás lo harías)?


