4.5: Formas Moleculares, Polaridad e Interacciones Moleculares
- Page ID
- 76660
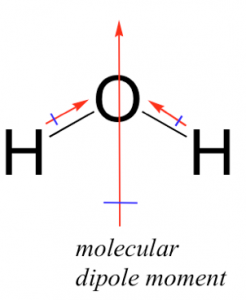
Ahora realmente tenemos que comenzar a usar nuestro pensamiento 3D y considerar varios factores adicionales: la forma de las moléculas y cómo interactúan. Gran parte de este pensamiento se hace mejor en la práctica con modelos moleculares, pero esbozaremos la lógica involucrada aquí. La molécula de HF tiene una forma simple; es lineal con extremos cargados (parcialmente) positivamente y (parcialmente) negativamente. En contraste, la\(\mathrm{H}_{2}\mathrm{O}\) molécula tiene una forma más compleja; tiene dos\(\mathrm{O–H}\) enlaces polares. Para entender cómo esto afecta la polaridad de la molécula tenemos que tener en cuenta el número de enlaces, su polarización y la forma general de la molécula. La polaridad del enlace es una cantidad vectorial, lo que significa que tiene tanto una magnitud como una dirección. Aquí es donde la comprensión de la estructura 3D de la molécula se vuelve crítica. Cada\(\mathrm{O–H}\) enlace está polarizado y la polaridad global de la molécula está determinada por la suma vectorial de estas polaridades de enlace (es decir hay que tener en cuenta tanto la magnitud como la dirección de los dipolos de enlace). Esto puede sonar un poco complicado pero en la práctica es relativamente fácil predecir cualitativamente cuál es la polaridad general de la molécula siempre y cuando se tenga en cuenta su estructura 3D. En el agua\(\mathrm{O–H}\) los dos enlaces están en un ángulo de aproximadamente\(107^{\circ}\) entre sí (\(\rightarrow\)). Si sumamos el dipolo de enlace momentos arriba se puede ver que la dirección general del dipolo para la molécula biseca ese ángulo, como se muestra en la figura. Ahora se podría pensar que este ejercicio es una pérdida de tiempo, seguramente tendría sentido que si una molécula tiene enlaces polares, entonces la molécula misma debería ser polar. No obstante, como veremos en breve no siempre es así.
Si aplicamos un análisis similar al amoníaco (\(\mathrm{CH}_{4}\)) vemos que el\(\mathrm{N–H}\) enlace es polar con a\(\delta +\) s en los átomos de hidrógeno y a\(\delta –\) en el átomo de nitrógeno. Recordando que la forma real de\(\mathrm{NH}_{3}\) es una pirámide de base triangular, con un ángulo de\(\mathrm{H-N-H}\) unión de\(\sim 105^{\circ}\), podemos ver que hay un momento dipolo general en amoníaco. Por lo tanto, el amoníaco es una molécula polar.
Sin embargo, si contrastamos esto con el metano, vemos dos diferencias. La primera es que el carbono no es tan electronegativo como el nitrógeno, el oxígeno o el flúor, por lo que el\(\mathrm{C–H}\) enlace no es tan polar. Dicho esto, hay una diferencia de electronegatividad y así la densidad electrónica en el\(\mathrm{C–H}\) enlace se distorsiona hacia el átomo de carbono (porque es un poco más electronegativo que el átomo de hidrógeno). Al mismo tiempo,\(\mathrm{CH}_{4}\) es simétrico (tetraédrico.) Si sumamos todos los dipolos de enlace se cancelan entre sí dando un momento dipolar molecular de cero. ¡Incluso si tuviéramos que reemplazar los átomos de hidrógeno en el metano con átomos de flúor para dar\(\mathrm{CF}_{4}\) (tetrafluoruro de carbono) la molécula resultante seguiría siendo no polar, a pesar de que la diferencia de electronegatividad entre carbono y flúor es mayor que la que existe entre hidrógeno y oxígeno! Este es otro ejemplo de algo contradictorio: algo formado por partes polares que no es polar.
El famoso “enlace” de hidrógeno
Ahora que tenemos una mejor idea de cómo la forma y los tipos de enlaces en una molécula pueden afectar su polaridad, veamos un poco más de cerca cómo las moléculas interactúan entre sí. Lo primero a tener en cuenta es que globalmente las moléculas no polares interactúan únicamente a través de las fuerzas de dispersión de Londres al igual que los átomos de neón o helio El punto de ebullición del neón es\(–246 { }^{\circ}\mathrm{C}\) mientras que el punto de ebullición de\(\mathrm{CH}_{4}\) es\(–161 { }^{\circ}\mathrm{C}\). Esto significa que las moléculas de metano se atraen más fuertemente entre sí que los átomos de neón. Podemos explicar esto con base en el hecho de que una molécula de metano es mayor que un átomo de neón. Debido a que los electrones en las moléculas de metano se dispersan sobre un área mayor y su distribución (en el espacio) es más fácil de distorsionar, decimos que las moléculas de metano son más polarizables. Al mismo tiempo debido a que las moléculas de metano son no polares, el punto de ebullición del metano es mucho menor que el de sustancias hechas de moléculas polares de tamaño similar. [11]
Consideremos tres moléculas de este tipo:\(\mathrm{HF}\) (bp\(19.5 { }^{\circ}\mathrm{C}\)),\(\mathrm{H}_{2}\mathrm{O}\) (bp\(100 { }^{\circ}\mathrm{C}\)) y\(\mathrm{NH}_{3}\) (bp\(-33 { }^{\circ}\mathrm{C}\)). Los tres son polares así que se mantienen unidos pero ¿por qué hay diferencias tan grandes en sus puntos de ebullición? La respuesta radica en el hecho de que las moléculas interactúan entre sí de múltiples maneras. Todos interactúan a través de las fuerzas de dispersión de Londres y las interacciones dipolo-dipolo. Además, también es posible un nuevo tipo de interacción, conocido como enlace de hidrógeno (o\(\mathrm{H}\) enlace). El término\(\mathrm{H}\) -enlace es algo engañoso porque estos son mucho más débiles que los enlaces covalentes y no involucran electrones compartidos; la energía requerida para romper un enlace de hidrógeno típico está entre\(5\) y\(30 \mathrm{~kJ/mole\), mientras que requiere más\(400 \mathrm{~kJ/mole\) para romper un\(\mathrm{C–C}\) enlace. [12] En los sistemas biológicos y en el agua líquida,\(\mathrm{H}\) los enlaces se rompen y reforman continuamente. Los enlaces de hidrógeno se forman entre dos moléculas separadas. [13] A diferencia de las fuerzas de dispersión de Londres, pero al igual que los\(\mathrm{H}\) enlaces covalentes, los enlaces tienen una dirección; se forman cuando el hidrógeno de una molécula, que está unida covalentemente a un\(\mathrm{O}\)\(\mathrm{F}\),\(\mathrm{N}\) o, es atraído por el par solitario en un\(\mathrm{O}\), \(\mathrm{N}\)\(\mathrm{F}\)de una molécula vecina.
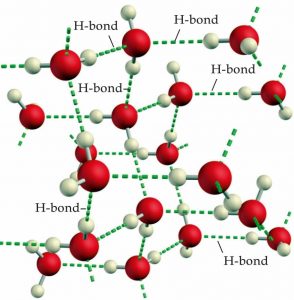
\(\mathrm{H}\)-enlaces son un caso especial de una interacción electrostática que involucra un átomo de hidrógeno que está unido a un átomo muy electronegativo (típicamente oxígeno o flúor) y un átomo electronegativo que tiene pares solitarios de electrones. Cuando un hidrógeno se une de esta manera la mayor parte de la densidad electrónica se mueve hacia el átomo electronegativo, dejando un relativamente grande\(\delta +\) en el hidrógeno. El agua es un ejemplo particularmente importante de una molécula capaz de enganchar enlaces de hidrógeno, ya que cada molécula de agua tiene la posibilidad de formar cuatro\(\mathrm{H}\) enlaces (\(\rightarrow\)). Cada uno de los átomos de hidrógeno dentro de una molécula de agua puede enlazarse a otra molécula de agua, mientras que cada átomo de oxígeno tiene dos pares solitarios que pueden interactuar con los átomos de hidrógeno deficientes en electrones de dos moléculas de agua vecinas diferentes, que se muestran en la figura. La capacidad de formar grandes números y redes de enlaces de hidrógeno es responsable de muchas de las propiedades únicas del agua, incluyendo su punto de fusión relativamente alto, punto de ebullición, capacidad calorífica, viscosidad y baja presión de vapor. En contraste,\(\mathrm{HF}\) y\(\mathrm{NH}_{3}\) puede formar, en promedio, sólo dos\(\mathrm{H}\) enlaces por molécula. ¿Puedes averiguar por qué esto es así? Debido a que hay menos\(\mathrm{H}\) enlaces que romper, tienen puntos de ebullición más bajos. \(\mathrm{HF}\)tiene un punto de ebullición más alto que\(\mathrm{NH}_{3}\) porque los\(\mathrm{H}\) enlaces en\(\mathrm{HF}\) son más fuertes que los de\(\mathrm{NH}_{3}\). (¿Puedes averiguar por qué?) Además de su papel en las propiedades a granel de sustancias como el agua, veremos que\(\mathrm{H}\) los enlaces juegan un papel crítico en la organización de los sistemas biológicos, desde la estructura del ADN y las proteínas, hasta la organización de membranas lipídicas y mecanismos catalíticos (pero más sobre eso más adelante).
Otros enlaces polares
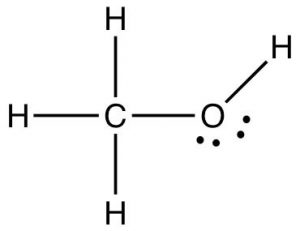
Hemos visto que cuando el hidrógeno está unido covalentemente al oxígeno, nitrógeno o flúor, el resultado es que el enlace covalente está altamente polarizado y la mayor parte de la densidad electrónica se localiza en el átomo más electronegativo. Esto significa que el átomo de hidrógeno tiene muy poca densidad de electrones que queda a su alrededor. Debido a que el hidrógeno es un átomo tan pequeño, la densidad de carga positiva resultante en el átomo de hidrógeno es alta. Esto conduce a atracciones inusualmente fuertes (\(\mathrm{H}\)-enlaces) con átomos que tienen pares solitarios con los que el átomo de hidrógeno cargado positivamente puede interactuar. El enlace H es único para las moléculas en las que un átomo de hidrógeno está unido covalentemente a un átomo de oxígeno, nitrógeno o flúor. Sin embargo, hay distribuciones de carga desiguales posibles siempre que dos átomos con electronegatividades diferentes forman un enlace. Considera, por ejemplo, el metanol (\(\mathrm{CH}_{3}\mathrm{OH}\)). Cuenta con varios tipos diferentes de bonos con diferentes distribuciones de carga en ellos. El\(\mathrm{O-H}\) enlace familiar en el metanol es muy parecido al\(\mathrm{O-H}\) enlace que se encuentra en el agua. Es decir, está altamente polarizado y el átomo de hidrógeno es una región pequeña y densa de carga altamente positiva que puede atraer y será atraída hacia regiones de alta densidad de electrones como los pares solitarios sobre el oxígeno. La molécula de metanol también tiene un\(\mathrm{C-O}\) enlace y tres\(\mathrm{C-H}\) enlaces. Si consideramos las diferencias en la electronegatividad podemos predecir la polarización de estos enlaces. Recuerde que el carbono y el hidrógeno tienen electronegatividades bastante similares, por lo que el\(\mathrm{C-H}\) enlace no está muy polarizado. El carbono y el oxígeno, en contraste, son bastante diferentes en sus electronegatividades y el resultado es que el\(\mathrm{C-O}\) enlace está fuertemente polarizado, con el\(\delta +\) localizado en el átomo de carbono y el extremo negativo del dipolo de enlace en el átomo de oxígeno. Como veremos más adelante esto tiene implicaciones sobre cómo el metanol (y todos los compuestos\(\mathrm{C-O}\) que contienen) interactúan (y reaccionan) con otras sustancias.
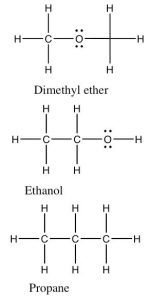
Una inspección de la estructura de Lewis puede revelar (¡a la mente entrenada!) una cantidad enorme sobre la estructura y polaridad de una molécula y llevando eso un paso más allá podemos hacer predicciones sobre las propiedades del compuesto. Por ejemplo si comparamos los puntos de ebullición relativos del metanol (\(\mathrm{CH}_{3}\mathrm{OH}\), pb\(65 { }^{\circ}\mathrm{C}\)) y etano (\(\mathrm{CH}_{3}\mathrm{CH}_{3}\), pb\(-88.6 { }^{\circ}\mathrm{C}\)) vemos (tal como ya predijo sin duda) que el metanol tiene un punto de ebullición mucho mayor porque se necesita más energía para separar las moléculas de metanol. Surge la pregunta: ¿es esto porque el metanol puede formar un\(\mathrm{H}\) enlace consigo mismo? ¿Se puede hacer una idea de cómo sucede esto? ¿O es por el\(\mathrm{C-O}\) dipolo? Podemos ver esta idea un poco más de cerca comparando los puntos de ebullición de tres compuestos que tienen pesos moleculares similares (para que experimenten fuerzas de dispersión similares en Londres), pero diferentes tipos de enlaces en ellos.
Si clasificamos los tipos de enlaces como antes vemos que el éter dimetílico tiene\(\mathrm{C-H}\) enlaces no polares y\(\mathrm{C-O}\) enlaces polares. El ángulo de\(\mathrm{C-O-C}\) unión es aproximadamente\(104^{\circ}\). Debido a que cada átomo (a excepción de\(\mathrm{H}\)) está rodeado por cuatro centros de densidad electrónica, la molécula no es lineal como se muestra en la imagen. (¿Por qué no?) La molécula en su conjunto es polar pero no puede formar enlaces de hidrógeno consigo misma porque ninguno de los átomos de hidrógeno tiene un significado\(\delta +\) como lo harían si estuvieran unidos a un átomo de oxígeno. Llamamos al tipo de fuerzas entre las moléculas de éter dimetílico, fuerzas dipolo-dipolo. Por otro lado, una molécula de etanol, que tiene exactamente el mismo peso molecular y fórmula, puede formar enlaces de hidrógeno consigo misma porque tiene un\(\mathrm{O-H}\) enlace y, por lo tanto, tiene un pequeño átomo de hidrógeno parcialmente cargado positivamente. Esta diferencia menor tiene un efecto enorme en el punto de ebullición: el etanol hierve en\(78 { }^{\circ}\mathrm{C}\) mientras que el éter dimetílico hierve en\(-23 { }^{\circ}\mathrm{C}\). Ambos son considerablemente más altos que el propano en\(-44 { }^{\circ}\mathrm{C}\) (recordando que el cero absoluto es\(-273.15 { }^{\circ}\mathrm{C}\)). Al comparar estos tres compuestos similares podemos ver que una simple atracción dipolo-dipolo aumenta el punto de ebullición en\(21 { }^{\circ}\mathrm{C}\), y encima de eso la atracción de\(\mathrm{H}\) unión en etanol vale otra\(99 { }^{\circ}\mathrm{C}\), llevando el punto de ebullición del etanol a\(78 { }^{\circ}\mathrm{C}\).
Fuerzas intermoleculares
En conjunto, las fuerzas de dispersión de Londres, las interacciones dipolo-dipolo y los enlaces de hidrógeno comprenden un conjunto de fuerzas atractivas que hacen que las moléculas separadas se peguen entre sí. Estas se denominan colectivamente fuerzas intermoleculares, IMF. Estas fuerzas son causadas por distorsiones permanentes o temporales de la nube de electrones en una molécula, lo que conduce a atracciones electrostáticas entre moléculas separadas. Para moléculas pequeñas, el orden típico para las fortalezas de los IMF es:
\(\mathrm{H}\) -unión (cuando esté disponible) > interacciones dipolo-dipolo > fuerzas de dispersión de Londres. Al mismo tiempo, debido a que las fuerzas de dispersión de Londres aumentan con el tamaño molecular y la extensión de las interacciones superficie-superficie, suelen ser la fuerza intermolecular predominante entre grandes macromoléculas biológicas.
La importancia de la forma
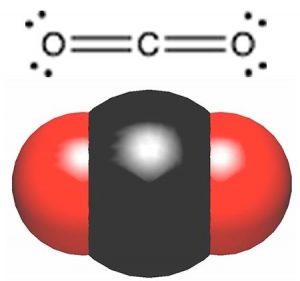
Si bien estamos en el tema de los compuestos que contienen carbono y oxígeno, echemos un vistazo a uno de los compuestos más comunes de carbono y oxígeno, el dióxido de carbono. Se puede dibujar la estructura de\(\mathrm{CO}_{2}\) con el átomo de carbono en el medio, doble enlazado a cada uno de los átomos de oxígeno. Es decir,\(\mathrm{CO}_{2}\) tiene dos enlaces bastante polares en él, y así podríamos predecir razonablemente que su punto de ebullición podría estar en algún lugar entre el éter dimetílico y el etanol. Pero, como probablemente ya sabrás, este no es el caso. \(\mathrm{CO}_{2}\)existe como gas a temperatura ambiente. De hecho\(\mathrm{CO}_{2}\) no tiene una fase líquida a presión atmosférica estándar; cambia directamente de un sólido a un gas, un proceso llamado sublimación, a\(-78 { }^{\circ}\mathrm{C}\). ¿Cómo se entiende ese comportamiento, particularmente dado que\(\mathrm{CO}_{2}\) tiene aproximadamente la misma masa molar que el etanol (\(\mathrm{CH}_{3}\mathrm{CH}_{2}\mathrm{OH}\)), que es un líquido a temperatura ambiente? Una vez más tenemos que asegurarnos de que hemos considerado todos los factores que afectan la polaridad molecular incluyendo la polaridad y la forma del enlace. Si reflexionas de nuevo a las ideas sobre la polaridad y estructura de los enlaces verás que tenemos otro caso aquí de una molécula con enlaces polares, pero sin polaridad general. \(\mathrm{CO}_{2}\)tiene una estructura lineal por lo que las polaridades de enlace se cancelan entre sí (están en una\(180^{\circ}\) de la otra) (\(\rightarrow\)). \(\mathrm{CO}_{2}\)no tiene polaridad molecular global, a pesar de que tiene enlaces polares. Por lo tanto las moléculas no se pegan muy bien y es un gas a temperatura ambiente.
Preguntas para responder
- ¿Cuál es la dirección del momento dipolo molecular en amoníaco? Dibuja un cuadro que muestre cómo se te ocurrió la respuesta. ¿Importa de qué manera dibujas la molécula? ¿Y si lo dibujas al revés? ¿Afectará eso la dirección del dipolo (en el mundo real)?
- ¿Por qué las interacciones entre\(\mathrm{H}_{2}\mathrm{O}\) moléculas son más fuertes que las que existen entre las moléculas de HF a pesar de que la polaridad del\(\mathrm{HF}\) enlace es mayor que la polaridad del\(\mathrm{OH}\) enlace?
- ¿Por qué no interactúan más de cuatro moléculas de agua con una molécula central de agua?
- ¿Cuáles predeciría que serían los puntos de ebullición relativos del metanol (\(\mathrm{CH}_{3}\mathrm{OH}\)) y el etano (\(\mathrm{CH}_{3}\mathrm{CH}_{3}\)), que tienen pesos moleculares similares?
- ¿Cuáles predeciría que serían los puntos de ebullición relativos del metanol (\(\mathrm{CH}_{3}\mathrm{OH}\)) y el etanol (\(\mathrm{CH}_{3}\mathrm{CH}_{2}\mathrm{OH}\))?
- ¿Qué tipo de compuesto (o qué característica estructural) esperaría que pudiera ser atraído por el\(\delta +\) ubicado en el átomo de carbono en el metanol?
Preguntas para reflexionar
- ¿Cuáles serían las consecuencias (para la vida, el universo y todo) si las moléculas de agua fueran lineales?


