4.6: Unión Iónica
- Page ID
- 76668
Nuestra discusión hasta ahora se ha centrado en tipos de enlaces que involucran electrones de valencia que se comparten entre (o más correctamente se pelean por ellos, atraídos por los núcleos opuestos) diferentes átomos. Hemos visto que podemos considerar que la densidad electrónica está igualmente distribuida entre los átomos de enlace, o que puede distorsionarse al ser atraída por el átomo más electronegativo. Lo que aún no hemos mirado es el caso extremo de este tipo de distorsión, en la que los electrones de valencia son tanto atraídos por el átomo electronegativo que son transferidos por completo. Este tipo de unión se llama unión iónica (como es casi seguro que ya eres consciente).
Echemos un vistazo a algunos compuestos iónicos comunes y veamos si podemos dar algún sentido a sus propiedades a partir de una consideración de su estructura atómica-molecular. En aras de la simplicidad nos limitaremos (por el momento) a compuestos binarios (compuestos con solo dos elementos en ellos). El más familiar de estos compuestos es el cloruro de sodio (\(\mathrm{NaCl}\)), sal de mesa común. \(\mathrm{NaCl}\)es un compuesto continuo que se extiende en una matriz tridimensional muy parecida al diamante (ver Capítulo\(3\).) \(\mathrm{NaCl}\)es un sólido a temperatura ambiente, con un punto de fusión muy alto (\(801 { }^{\circ}\mathrm{C}\)), similar a los puntos de fusión de la plata (\(961.78 { }^{\circ}\mathrm{C}\)) y el oro (\(1064.18 { }^{\circ}\mathrm{C}\)), aunque muy inferior a la temperatura de descomposición del diamante (\(3550 { }^{\circ}\mathrm{C}\)). Una diferencia interesante entre el diamante y el cloruro de sodio ocurre al calentar. Recuerda que el diamante no se derrite; se descompone una vez que se agrega suficiente energía al sistema para romper los\(\mathrm{C–C}\) enlaces. En circunstancias normales, los átomos de carbono reaccionan con el oxígeno (\(\mathrm{O}_{2}\)) en el aire para formar dióxido de carbono, un proceso que requiere la adición de mucha energía para revertir (como veremos más adelante). Por otro lado\(\mathrm{NaCl}\) se funde (sólido\(\rightarrow\) líquido) y se congela (\(\rightarrow\)sólido líquido) a\(801 { }^{\circ}\mathrm{C}\), al igual que el agua, justo a una temperatura más alta. Con base en esta diferencia, podríamos tener la tentación de concluir que los enlaces covalentes no se rompen cuando la sal se derrite sino que algo más fuerte que los\(\mathrm{H}\) enlaces que mantienen unidas a las moléculas de agua se rompen. ¿Qué podría ser eso?
Un indicio proviene de estudios realizados por primera vez por el químico inglés Humphrey Davy. [14] Davy utilizó una pila voltaica para estudiar los efectos del paso de electricidad a través de una variedad de sustancias. [15] La sal de mesa sólida no conducía electricidad, pero la sal líquida (fundida) sí. No sólo conducía electricidad, sino que cuando la electricidad (electrones) pasaba a través de ella, se descompuso para producir glóbulos de un metal brillante y altamente reactivo (sodio,\(\mathrm{Na}\)) y un gas verde pálido (cloro,\(\mathrm{Cl}_{2}\)). Davy correctamente (como resultó) dedujo que los elementos en la sal de mesa (lo que ahora conocemos como sodio y cloro) se mantienen unidos por lo que él denominó fuerzas eléctricas. Justo lo que causó esas fuerzas eléctricas no se descubrió hasta que la naturaleza atómica de la materia fue dilucidada más de 100 años después.
Se necesita una gran cantidad de energía para cambiar la sal de mesa en sus elementos constituyentes. Primero se tiene que calentar la sal hasta su punto de fusión, y luego se debe agregar energía eléctrica para liberar los elementos sodio y cloro. La reacción inversa, combinando los elementos sodio y cloro (no hacer esto en casa), produce cloruro de sodio y libera una gran cantidad de energía (\(411 \mathrm{~kJ/mol}\)). Ante la liberación de energía, sospechamos que se están formando enlaces durante esta reacción.
Uno de los principios importantes de la química es que la estructura a nivel atómico-molecular se refleja en el comportamiento de los materiales en el mundo real. Entonces, revisemos algunas de las propiedades del cloruro de sodio en el mundo real:
- Forma cristales incoloros que a menudo son de forma cúbica y son duros y quebradizos.
- Tiene un alto punto de fusión y conduce la electricidad cuando se funde, pero no en estado sólido.
Con base en estas propiedades, y lo que sabemos sobre interacciones, enlaces y electricidad, podemos comenzar a hacer hipótesis sobre cómo se organizan los átomos en\(\mathrm{NaCl}\). Por ejemplo, el hecho de que\(\mathrm{NaCl}\) sea un sólido estable y cristalino a temperatura ambiente y que se derrita a alta temperatura implica que las fuerzas que mantienen unidos a los átomos son fuertes. La forma regular de los cristales de sal implica que los enlaces que mantienen unidos a los átomos se extienden en tres dimensiones con algún patrón regular. Si tomas un cristal de sal grande y le das un golpe fuerte, se rompe limpiamente a lo largo de una superficie plana. Diamond también se comporta de esta manera. La capacidad de la sal fundida, pero no sólida, para conducir electricidad sugiere que la fusión conduce a la aparición de partículas móviles cargadas eléctricamente. La interpretación actual de todas estas observaciones y experimentos es que en estado sólido la sal (\(\mathrm{NaCl}\)) se mantiene unida por las atracciones culómbicas (eléctricas) entre los iones sodio (\(\mathrm{Na}^{+}\)) y cloruro (\(\mathrm{Cl}^{-}\)). Entonces, cuando el sodio metal (\(\mathrm{Na}\)) reacciona con cloro (\(\mathrm{Cl}_{2}\)) gas, se producen iones de sodio y cloruro. En estado sólido, estos iones son fuertemente atraídos entre sí y no pueden moverse, pero pueden moverse en estado fundido (líquido), y su movimiento es lo que conduce la electricidad (electrones).
Una forma de pensar en el enlace iónico es que es el límite extremo de un enlace covalente polar. Por lo general, los compuestos iónicos simples se forman a partir de elementos en el lado izquierdo de la tabla periódica (metales, como el sodio) y elementos en el lado derecho (no metales, como el cloro). Los no metales tienden a tener una alta electronegatividad como resultado de su alta carga nuclear efectiva, mientras que los metales tienen baja electronegatividad porque sus electrones de valencia no son muy fuertemente atraídos por sus núcleos. Cuando un átomo de metal se encuentra con un átomo no metálico, el no metal atrae los electrones de valencia del metal, de manera que a todos los efectos los electrones se mueven del átomo metálico (que luego tiene una carga positiva neta) al átomo no metálico (que ahora tiene una carga negativa neta). Este efecto, sin embargo, se aplica solo a los electrones en las conchas de valencia sin llenar. Los electrones en los orbitales centrales llenos de un átomo metálico requieren mucha más energía para eliminarlos. ¿Por qué? Porque están más cerca del núcleo cargado positivamente (recordar el salto en la energía de ionización cuando se elimina un electrón del núcleo). Si hay un solo electrón de capa externa (como es el caso con\(\mathrm{Na}\) y otros metales del Grupo I) ese electrón a menudo se pierde, y el átomo resultante (ahora llamado ion) tiene una sola carga positiva (por ejemplo,\(\mathrm{Na}^{+}\)). Si hay dos electrones de capa externa, como en el caso de los metales del Grupo II, como el calcio y el magnesio, ambos pueden perderse para producir iones doblemente cargados, como\(\mathrm{Ca}^{++}\) y\(\mathrm{Mg}^{++}\) (generalmente escritos como\(\mathrm{Ca}^{2+}\) y\(\mathrm{Mg}^{2+}\)). Al otro lado de la tabla periódica, los no metales muestran exactamente el patrón opuesto, ganando electrones para convertirse en iones cargados negativamente. [16]
Preguntas para responder
- El punto de fusión de la sal de mesa ha terminado\(800 { }^{\circ}\mathrm{C}\). ¿Por qué es tan alto?
- ¿Qué propiedades asocia con un sólido?
- ¿Qué sucede a nivel atómico-molecular cuando un sólido se funde?
- ¿Por qué los metales no tienden a ganar electrones? ¿Por qué los no metales no pierden electrones?
- ¿Qué sucede con el tamaño de un átomo de sodio cuando pierde un electrón para convertirse\(\mathrm{Na}^{+}\)?
- ¿Qué sucede con el tamaño de un átomo de cloro cuando gana un electrón y se vuelve\(\mathrm{Cl}^{-}\)?
Preguntas para reflexionar
- ¿Por qué la sal de mesa sólida no conduce la electricidad?
- ¿Por qué la sal de mesa fundida conduce la electricidad?
Volver a Cloruro de Sodio
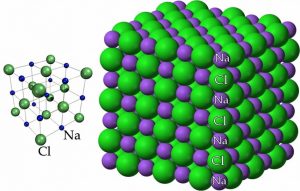
En este punto, hemos llegado a la conclusión de que\(\mathrm{NaCl}\) está compuesto por\(\mathrm{Na}^{+}\) iones (cationes) e\(\mathrm{Cl}^{-}\) iones (aniones), pero aún no hemos discutido cómo estos iones están dispuestos unos con respecto a otros en el espacio. Como habrás llegado a esperar, por lo general hay más de una forma de representar una estructura química. Diferentes modelos enfatizan diferentes características de una sustancia pero ninguno de ellos es real en el sentido de que si pudiéramos mirar la estructura a nivel molecular, estos modelos no son lo que veríamos. Al mismo tiempo, los cubos visibles de cristales de sal proporcionan una pista sobre la estructura atómica-molecular. Si seguimos la estructura desde lo macroscópico a lo molecular, se conserva esta estructura cúbica/rectangular. Un diagrama de cloruro de sodio que muestra las posiciones relativas de los iones, que se muestra aquí, ilustra esta organización cúbica.
Otra forma de ver\(\mathrm{NaCl}\) es pensar que cada\(\mathrm{Na}^{+}\) ion está rodeado por seis\(\mathrm{Cl}^{-}\) iones, y cada\(\mathrm{Cl}^{-}\) ion está rodeado por seis\(\mathrm{Na}^{+}\) iones. Tal disposición es posible debido a los tamaños relativos de los iones sodio y cloruro; los\(\mathrm{Na}^{+}\) iones más pequeños pueden asentarse en los agujeros entre los\(\mathrm{Cl}^{-}\) iones más grandes (¿por qué los iones cloruro son más grandes que los iones de sodio?). Una consecuencia de esta disposición es que no existe un enlace “iónico” que sea análogo a un enlace covalente. Nuestro modelo de unión aquí se entiende mejor como esta red tridimensional de iones que interactúan. La red alterna de iones positivos y negativos crea una estructura muy estable que es difícil de romper. ¿La implicación? Se requiere mucha energía para romper estas interacciones y permitir que los iones se muevan uno con respecto al otro. Muchos compuestos iónicos están organizados en tipos similares de estructuras cristalinas. Una complejidad (a la que volveremos en Capítulo\(6\)) is that many ionic compounds, including \(\mathrm{NaCl}\), son altamente solubles en agua, lo que significa que interactúan fuertemente con las moléculas de agua. A menudo las sales cristalizan junto con las moléculas de agua y forman formas hidratadas (con agua), a diferencia de las formas anhidras (sin agua).
Cómo la unión iónica explica las propiedades de los compuestos iónicos
Volvamos a las propiedades de los compuestos iónicos y veamos cómo este modelo de unión a nivel molecular (microscópico) explica sus propiedades. Primero, sus altos puntos de fusión surgen del hecho de que se debe suministrar suficiente energía para que se superen múltiples interacciones culómbicas (fuertes) (recordar que cada catión está rodeado por seis aniones y viceversa) entre los iones. En contraste con el agua, son solo las fuerzas intermoleculares entre las moléculas las que deben superarse para derretir el hielo; los IMF son significativamente más débiles que las interacciones iónicas completas. De igual manera se necesita aún más energía para vaporizar (\(\rightarrow\)gas líquido)\(\mathrm{NaCl}\).
Ahora predigamos los puntos de fusión de diferentes compuestos iónicos. Recuerda que la fuerza entre los iones es una atracción coulómbica:\(F_{\alpha} = \frac{q^{+} \times q^{-}}{r^{2}}\), dónde\(q^{+}\) y\(q^{-}\) están las cargas sobre los iones, y\(r\) es la distancia entre ellos. Esta ecuación nos dice que a medida que aumenta la carga sobre los iones, también lo hace la fuerza de atracción, pero a medida que aumenta la distancia entre ellos, la fuerza de atracción disminuye. Es decir, la atracción coulómbica debería ser mayor para los iones pequeños y altamente cargados, y esto debería reflejarse en los puntos de fusión de los compuestos iónicos. Incluso cuando no factorizamos el tamaño de los iones,\(q_{1} \times q_{2} = 4\) lo que significa que las fuerzas atractivas para\(\mathrm{CaO}\) deben ser del orden de 4 veces las de\(\mathrm{NaCl}\). En efecto, el punto de fusión del óxido de calcio (\(\mathrm{CaO}\)) que tiene\(q_{1} = 2^{+}\) y\(q_{2} = 2^{-}\) es\(2,572^{\circ}\mathrm{C}\).
Preguntas para responder
-
- Dibuje una imagen a nivel molecular del agua líquida y una imagen del nivel molecular del cloruro de sodio líquido. Usa esta imagen para explicar por qué se necesita más energía para derretir la sal sólida que para derretir el agua sólida.
- Organizar estos compuestos iónicos en orden de aumentar el punto de fusión:\(\mathrm{NaCl}\),\(\mathrm{KBr}\),\(\mathrm{CaO}\),\(\mathrm{Al}_{2}\mathrm{O}_{3}\). Busque sus respuestas y vea si sus predicciones fueron correctas.
- Disponer estos materiales en orden de aumentar el punto de fusión:\(\mathrm{CH}_{4}\)\(\mathrm{MgBr}_{2}\),\(\mathrm{HF}\),,\(\mathrm{C}\) (diamante). Busque sus respuestas y vea si sus predicciones fueron correctas.
- ¿Qué crees que pasa con el tamaño de la partícula cuando un átomo de cloro gana un electrón para convertirse en un ion cloruro? (pista recordar que el tamaño de un átomo depende del equilibrio entre las atracciones entre los electrones y el núcleo, y las repulsiones entre los electrones)
- ¿Qué crees que pasa con el tamaño de la partícula cuando un átomo de sodio pierde un electrón para convertirse en un ion de sodio?


