5.1: Conceptos básicos de energía
- Page ID
- 75794
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)- Definir energía, distinguir tipos de energía y describir la naturaleza de los cambios energéticos que acompañan a los cambios químicos y físicos
- Distinguir las propiedades relacionadas del calor, la energía térmica y la temperatura
- Definir y distinguir el calor específico y la capacidad calorífica, y describir las implicaciones físicas de ambos
- Realizar cálculos que involucren calor, calor específico y cambio de temperatura
Los cambios químicos y los cambios que los acompañan en la energía son partes importantes de nuestro mundo cotidiano (Figura\(\PageIndex{1}\)). Los macronutrientes en los alimentos (proteínas, grasas e hidratos de carbono) sufren reacciones metabólicas que proporcionan la energía para mantener nuestro cuerpo funcionando. Quemamos una variedad de combustibles (gasolina, gas natural, carbón) para producir energía para el transporte, la calefacción y la generación de electricidad. Las reacciones químicas industriales utilizan enormes cantidades de energía para producir materias primas (como el hierro y el aluminio). La energía se utiliza entonces para fabricar esas materias primas en productos útiles, como automóviles, rascacielos y puentes.

Más del 90% de la energía que utilizamos proviene originalmente del sol. Todos los días, el sol proporciona a la tierra casi 10,000 veces la cantidad de energía necesaria para satisfacer todas las necesidades energéticas del mundo para ese día. Nuestro desafío es encontrar formas de convertir y almacenar la energía solar entrante para que pueda ser utilizada en reacciones o procesos químicos que sean convenientes y no contaminantes. Las plantas y muchas bacterias capturan la energía solar a través de la fotosíntesis. Liberamos la energía almacenada en las plantas cuando quemamos madera o productos vegetales como el etanol. También utilizamos esta energía para alimentar nuestros cuerpos al comer alimentos que provienen directamente de las plantas o de los animales que obtuvieron su energía al comer plantas. La quema de carbón y petróleo también libera energía solar almacenada: Estos combustibles son materia vegetal y animal fosilizada.
Este capítulo presentará las ideas básicas de un área importante de la ciencia que se ocupa de la cantidad de calor absorbido o liberado durante los cambios químicos y físicos, un área llamada termoquímica. Los conceptos introducidos en este capítulo son ampliamente utilizados en casi todos los campos científicos y técnicos. Los científicos de alimentos los utilizan para determinar el contenido energético de los alimentos. Los biólogos estudian la energía de los organismos vivos, como la combustión metabólica del azúcar en dióxido de carbono y agua. Las industrias de petróleo, gas y transporte, proveedores de energía renovable y muchas otras se empeñan en encontrar mejores métodos para producir energía para nuestras necesidades comerciales y personales. Los ingenieros se esfuerzan por mejorar la eficiencia energética, encontrar mejores formas de calentar y enfriar nuestros hogares, refrigerar nuestros alimentos y bebidas, y satisfacer las necesidades de energía y refrigeración de computadoras y electrónica, entre otras aplicaciones. Comprender los principios termoquímicos es esencial para químicos, físicos, biólogos, geólogos, todo tipo de ingenieros y casi cualquier persona que estudie o haga cualquier tipo de ciencia.
Energía
La energía puede definirse como la capacidad de suministrar calor o hacer trabajo. Un tipo de trabajo (w) es el proceso de hacer que la materia se mueva contra una fuerza opuesta. Por ejemplo, trabajamos cuando inflamos una llanta de bicicleta: movemos la materia (el aire en la bomba) contra la fuerza opuesta del aire que rodea la llanta.
Al igual que la materia, la energía viene en diferentes tipos. Un esquema clasifica la energía en dos tipos: la energía potencial, la energía que tiene un objeto por su posición relativa, composición o condición, y la energía cinética, la energía que un objeto posee debido a su movimiento. El agua en la parte superior de una cascada o presa tiene energía potencial debido a su posición; cuando fluye hacia abajo a través de generadores, tiene energía cinética que puede ser utilizada para hacer trabajos y producir electricidad en una planta hidroeléctrica (Figura\(\PageIndex{2}\)). Una batería tiene energía potencial porque los químicos dentro de ella pueden producir electricidad que puede funcionar.

La energía se puede convertir de una forma a otra, pero toda la energía presente antes de que ocurra un cambio siempre existe de alguna forma después de que se complete el cambio. Esta observación se expresa en la ley de conservación de la energía: durante un cambio químico o físico, la energía no puede crearse ni destruirse, aunque se puede cambiar de forma. (Esta es también una versión de la primera ley de la termodinámica, como aprenderás más adelante.)
Cuando una sustancia se convierte en otra, siempre hay una conversión asociada de una forma de energía en otra. El calor suele ser liberado o absorbido, pero a veces la conversión involucra luz, energía eléctrica o alguna otra forma de energía. Por ejemplo, la energía química (un tipo de energía potencial) se almacena en las moléculas que componen la gasolina. Cuando la gasolina se quema dentro de los cilindros del motor de un automóvil, los productos gaseosos de rápida expansión de esta reacción química generan energía mecánica (un tipo de energía cinética) cuando mueven los pistones de los cilindros.
De acuerdo con la ley de conservación de la materia (vista en un capítulo anterior), no hay cambio detectable en la cantidad total de materia durante un cambio químico. Cuando ocurren reacciones químicas, los cambios de energía son relativamente modestos y los cambios de masa son demasiado pequeños para medirlos, por lo que las leyes de conservación de la materia y la energía se mantienen bien. Sin embargo, en las reacciones nucleares, los cambios de energía son mucho mayores (por factores de aproximadamente un millón), los cambios de masa son medibles y las conversiones materia-energía son significativas. Esto será examinado con más detalle en un capítulo posterior sobre química nuclear. Para abarcar tanto los cambios químicos como los nucleares, combinamos estas leyes en una sola declaración: La cantidad total de materia y energía en el universo es fija.
Energía térmica, temperatura y calor
La energía térmica es la energía cinética asociada con el movimiento aleatorio de átomos y moléculas. La temperatura es una medida cuantitativa de “caliente” o “frío”. Cuando los átomos y las moléculas de un objeto se mueven o vibran rápidamente, tienen una energía cinética promedio (KE) más alta, y decimos que el objeto está “caliente”. Cuando los átomos y las moléculas se mueven lentamente, tienen menor KE, y decimos que el objeto está “frío” (Figura\(\PageIndex{3}\)). Suponiendo que no se produzca ninguna reacción química o cambio de fase (como fusión o vaporización), aumentar la cantidad de energía térmica en una muestra de materia hará que aumente su temperatura. Y, suponiendo que no se produzca ninguna reacción química o cambio de fase (como condensación o congelación), disminuir la cantidad de energía térmica en una muestra de materia hará que disminuya su temperatura.

La mayoría de las sustancias se expanden a medida que aumenta su temperatura y se contraen a medida Esta propiedad se puede utilizar para medir los cambios de temperatura, como se muestra en la Figura\(\PageIndex{4}\). El funcionamiento de muchos termómetros depende de la expansión y contracción de las sustancias en respuesta a los cambios de temperatura.


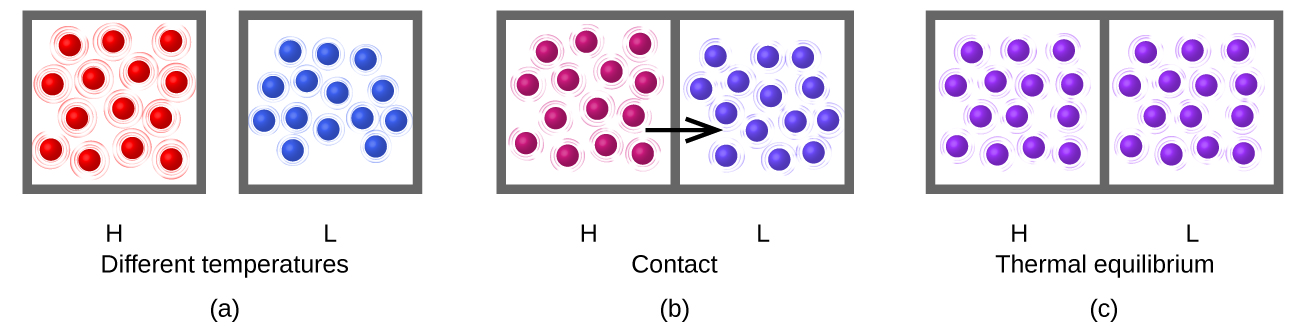
El calor (q) es la transferencia de energía térmica entre dos cuerpos a diferentes temperaturas. El flujo de calor (un término redundante, pero uno de uso común) aumenta la energía térmica de un cuerpo y disminuye la energía térmica del otro. Supongamos que inicialmente tenemos una sustancia de alta temperatura (y alta energía térmica) (H) y una sustancia de baja temperatura (y baja energía térmica) (L). Los átomos y moléculas en H tienen un promedio KE mayor que los de L. Si ponemos la sustancia H en contacto con la sustancia L, la energía térmica fluirá espontáneamente de la sustancia H a la sustancia L. La temperatura de la sustancia H disminuirá, al igual que el KE promedio de sus moléculas; la temperatura de la sustancia L aumentará, junto con el KE promedio de sus moléculas. El flujo de calor continuará hasta que las dos sustancias estén a la misma temperatura (Figura\(\PageIndex{5}\)).
La materia que experimenta reacciones químicas y cambios físicos puede liberar o absorber calor. Un cambio que libera calor se llama proceso exotérmico. Por ejemplo, la reacción de combustión que se produce cuando se usa un soplete de oxiacetileno es un proceso exotérmico, este proceso también libera energía en forma de luz como lo demuestra la llama de la antorcha (Figura\(\PageIndex{6a}\)). Una reacción o cambio que absorbe calor es un proceso endotérmico. Una bolsa fría utilizada para tratar las cepas musculares proporciona un ejemplo de un proceso endotérmico. Cuando se juntan las sustancias en la bolsa fría (agua y una sal como el nitrato de amonio), el proceso resultante absorbe el calor, lo que lleva a la sensación de frío.

Medición de la capacidad de energía y calor
Históricamente, la energía se midió en unidades de calorías (cal). Una caloría es la cantidad de energía requerida para elevar un gramo de agua en 1 grado C (1 kelvin). Sin embargo, esta cantidad depende de la presión atmosférica y de la temperatura inicial del agua. La facilidad de medición de los cambios energéticos en calorías ha hecho que la caloría siga siendo utilizada con frecuencia. La Caloría (con una C mayúscula), o gran caloría, comúnmente utilizada para cuantificar el contenido energético de los alimentos, es una kilocaloría. La unidad SI de calor, trabajo y energía es el joule. Un joule (J) se define como la cantidad de energía utilizada cuando una fuerza de 1 newton mueve un objeto 1 metro. Se nombra en honor al físico inglés James Prescott Joule. Un julio equivale a 1 kg m 2 /s 2, que también se llama 1 newton—metro. Un kilojulio (kJ) es de 1000 julios. Para estandarizar su definición, se ha establecido 1 caloría en 4.184 julios.
Ahora presentamos dos conceptos útiles para describir el flujo de calor y el cambio de temperatura. La capacidad calorífica (C) de un cuerpo de materia es la cantidad de calor (q) que absorbe o libera cuando experimenta un cambio de temperatura (Δ T) de 1 grado Celsius (o equivalentemente, 1 kelvin)
\[C=\dfrac{q}{ΔT} \label{5.2.1} \]
La capacidad calorífica está determinada tanto por el tipo como por la cantidad de sustancia que absorbe o libera calor. Por lo tanto, es una propiedad extensa, su valor es proporcional a la cantidad de la sustancia.
Por ejemplo, considere las capacidades de calor de dos sartenes de hierro fundido. La capacidad calorífica de la sartén grande es cinco veces mayor que la de la sartén pequeña ya que, aunque ambas están hechas del mismo material, la masa de la sartén grande es cinco veces mayor que la masa de la sartén pequeña. Más masa significa que hay más átomos presentes en la sartén más grande, por lo que se necesita más energía para hacer que todos esos átomos vibren más rápido. La capacidad calorífica de la pequeña sartén de hierro fundido se encuentra al observar que se necesitan 18,150 J de energía para elevar la temperatura de la sartén en 50.0 °C
\[C_{\text{small pan}}=\mathrm{\dfrac{18,140\; J}{50.0\; °C} =363\; J/°C} \label{5.2.2} \]
La sartén de hierro fundido más grande, aunque está hecha de la misma sustancia, requiere 90,700 J de energía para elevar su temperatura en 50.0 °C. La sartén más grande tiene una capacidad calorífica (proporcionalmente) mayor porque la mayor cantidad de material requiere una (proporcionalmente) mayor cantidad de energía para producir la misma temperatura cambio:
\[C_{\text{large pan}}=\mathrm{\dfrac{90,700\; J}{50.0\;°C}=1814\; J/°C} \label{5.2.3} \]
La capacidad calorífica específica (c) de una sustancia, comúnmente llamada su “calor específico”, es la cantidad de calor requerida para elevar la temperatura de 1 gramo de una sustancia en 1 grado Celsius (o 1 Kelvin):
\[c = \dfrac{q}{\mathrm{m\Delta T}} \label{5.2.4} \]
La capacidad calorífica específica depende únicamente del tipo de sustancia que absorbe o libera calor. Es una propiedad intensiva —el tipo, pero no la cantidad, de la sustancia es lo único que importa. Por ejemplo, la pequeña sartén de hierro fundido tiene una masa de 808 g. El calor específico del hierro (el material utilizado para hacer la sartén) es por lo tanto:
\[c_\ce{iron}=\mathrm{\dfrac{18,140\; J}{(808\; g)(50.0\;°C)} = 0.449\; J/g\; °C} \label{5.2.5} \]
La sartén grande tiene una masa de 4040 g. Utilizando los datos de esta sartén, también podemos calcular el calor específico del hierro:
\[c_\ce{iron}=\mathrm{\dfrac{90,700\; J}{(4,040\; g)(50.0\;°C)}=0.449\; J/g\; °C} \label{5.2.6} \]
Si bien la sartén grande es más masiva que la pequeña, ya que ambas están hechas del mismo material, ambas producen el mismo valor para calor específico (para el material de construcción, hierro). Obsérvese que el calor específico se mide en unidades de energía por temperatura por masa y es una propiedad intensiva, derivándose de una relación de dos propiedades extensas (calor y masa). La capacidad calorífica molar, también una propiedad intensiva, es la capacidad calorífica por mol de una sustancia en particular y tiene unidades de J/mol °C (Figura\(\PageIndex{7}\)).

El agua líquida tiene un calor específico relativamente alto (aproximadamente 4.2 J/g °C); la mayoría de los metales tienen calores específicos mucho más bajos (generalmente menos de 1 J/g °C). El calor específico de una sustancia varía algo con la temperatura. Sin embargo, esta variación suele ser lo suficientemente pequeña como para que tratemos el calor específico como constante en el rango de temperaturas que se considerarán en este capítulo. Los calores específicos de algunas sustancias comunes se enumeran en la Tabla\(\PageIndex{1}\).
| Sustancia | Símbolo (estado) | Calor Específico (J/g °C) |
|---|---|---|
| helio | Él (g) | 5.193 |
| agua | H 2 O (l) | 4.184 |
| etanol | C 2 H 6 O (l) | 2.376 |
| hielo | H 2 O (s) | 2.093 (a −10 °C) |
| vapor de agua | H 2 O (g) | 1.864 |
| nitrógeno | N 2 (g) | 1.040 |
| aire | 1.007 | |
| oxígeno | O 2 (g) | 0.918 |
| aluminio | Al (s) | 0.897 |
| dióxido de carbono | CO 2 (g) | 0.853 |
| argón | Ar (g) | 0.522 |
| hierro | Fe (s) | 0.449 |
| cobre | Cu (s) | 0.385 |
| plomo | Pb (s) | 0.130 |
| oro | Au (s) | 0.129 |
| silicio | Si (s) | 0.712 |
Si conocemos la masa de una sustancia y su calor específico, podemos determinar la cantidad de calor, q, que entra o sale de la sustancia midiendo el cambio de temperatura antes y después de que se gane o pierda el calor:
\[\begin{align*} q &= \ce{(specific\: heat)×(mass\: of\: substance)×(temperature\: change)}\label{5.2.7}\\q&=c×m×ΔT \\[4pt] &=c×m×(T_\ce{final}−T_\ce{initial})\end{align*} \]
En esta ecuación,\(c\) se encuentra el calor específico de la sustancia, m es su masa, y Δ T (que se lee “delta T”) es el cambio de temperatura, T final − T inicial. Si una sustancia gana energía térmica, su temperatura aumenta, su temperatura final es mayor que su temperatura inicial, T final − T inicial tiene un valor positivo, y el valor de q es positivo. Si una sustancia pierde energía térmica, su temperatura disminuye, la temperatura final es inferior a la temperatura inicial, T final − T inicial tiene un valor negativo, y el valor de q es negativo.
Se calienta un matraz que contiene\(\mathrm{8.0 \times 10^2\; g}\) agua, y la temperatura del agua aumenta de 21 °C a 85 °C. ¿Cuánto calor absorbió el agua?
Solución
Para responder a esta pregunta, considere estos factores:
- el calor específico de la sustancia que se calienta (en este caso, el agua)
- la cantidad de sustancia que se calienta (en este caso, 800 g)
- la magnitud del cambio de temperatura (en este caso, de 21 °C a 85 °C).
El calor específico del agua es de 4.184 J/g °C, por lo que para calentar 1 g de agua por 1 °C se requiere 4.184 J. Observamos que ya que se requiere 4.184 J para calentar 1 g de agua por 1 °C, necesitaremos 800 veces más para calentar 800 g de agua por 1 °C. Finalmente, observamos que ya que se requieren 4.184 J para calentar 1 g de agua por 1 °C, nosotros necesitará 64 veces más para calentarlo por 64 °C (es decir, de 21 °C a 85 °C).
Esto se puede resumir usando la ecuación:
\[\begin{align*} q&=c×m×ΔT \\[4pt] &=c×m×(T_\ce{final}−T_\ce{initial}) \\[4pt] &=\mathrm{(4.184\:J/\cancel{g}°C)×(800\:\cancel{g})×(85−21)°C}\\[4pt] &=\mathrm{(4.184\:J/\cancel{g}°\cancel{C})×(800\:\cancel{g})×(64)°\cancel{C}}\\[4pt] &=\mathrm{210,000\: J(=210\: kJ)} \end{align*} \nonumber \]
Debido a que la temperatura aumentó, el agua absorbió calor y\(q\) es positiva.
¿Cuánto calor, en julios, se debe agregar a una sartén de\(\mathrm{5.00 \times 10^2 \;g}\) hierro para aumentar su temperatura de 25 °C a 250 °C? El calor específico del hierro es 0.451 J/g °C.
Responder-
\(\mathrm{5.05 \times 10^4\; J}\)
Tenga en cuenta que la relación entre calor, calor específico, masa y cambio de temperatura se puede usar para determinar cualquiera de estas cantidades (no solo calor) si las otras tres son conocidas o se pueden deducir.
Una pieza de metal desconocido pesa 348 g. Cuando la pieza metálica absorbe 6.64 kJ de calor, su temperatura aumenta de 22.4 °C a 43.6 °C. Determinar el calor específico de este metal (lo que podría proporcionar una pista de su identidad).
Solución
Dado que el cambio de masa, calor y temperatura son conocidos por este metal, podemos determinar su calor específico usando la relación:
\[\begin{align*} q&=c \times m \times \Delta T \\[4pt] &=c \times m \times (T_\ce{final}−T_\ce{initial}) \end{align*} \nonumber \]
Sustituyendo los valores conocidos:
\[6,640\; \ce J=c \times \mathrm{(348\; g) \times (43.6 − 22.4)\; °C} \nonumber \]
Resolviendo:
\[c=\mathrm{\dfrac{6,640\; J}{(348\; g) \times (21.2°C)} =0.900\; J/g\; °C} \nonumber \]
Al comparar este valor con los valores de la Tabla\(\PageIndex{1}\), este valor coincide con el calor específico del aluminio, lo que sugiere que el metal desconocido puede ser el aluminio.
Una pieza de metal desconocido pesa 217 g. Cuando la pieza metálica absorbe 1.43 kJ de calor, su temperatura aumenta de 24.5 °C a 39.1 °C. Determinar el calor específico de este metal y predecir su identidad.
- Contestar
-
\(c = \mathrm{0.45 \;J/g \;°C}\); el metal es probable que sea hierro de verificar Tabla\(\PageIndex{1}\).
Plantas de energía solar térmica
La luz solar que llega a la tierra contiene miles de veces más energía de la que capturamos actualmente. Los sistemas termosolares proporcionan una posible solución al problema de convertir la energía del sol en energía que podemos utilizar. Las plantas termosolares a gran escala tienen diferentes detalles de diseño, pero todas concentran la luz solar para calentar alguna sustancia; el calor “almacenado” en esa sustancia se convierte luego en electricidad.
La Estación Generadora Solana en el desierto de Sonora de Arizona produce 280 megavatios de energía eléctrica. Utiliza espejos parabólicos que enfocan la luz solar en tuberías llenas de un fluido de transferencia de calor (HTF) (Figura\(\PageIndex{8}\)). El HTF entonces hace dos cosas: Convierte el agua en vapor, que hace girar turbinas, que a su vez produce electricidad, y funde y calienta una mezcla de sales, que funciona como un sistema de almacenamiento de energía térmica. Después de que el sol se pone, la mezcla de sal fundida puede liberar suficiente de su calor almacenado para producir vapor para hacer funcionar las turbinas durante 6 horas. Las sales fundidas se utilizan porque poseen una serie de propiedades beneficiosas, incluyendo altas capacidades térmicas y conductividades térmicas.

El Sistema de Generación Solar Ivanpah de 377 megavatios, ubicado en el desierto de Mojave en California, es la planta de energía solar térmica más grande del mundo (Figura\(\PageIndex{9}\)). Sus 170,000 espejos enfocan grandes cantidades de luz solar en tres torres llenas de agua, produciendo vapor a más de 538 °C que impulsa turbinas productoras de electricidad. Produce energía suficiente para alimentar a 140 mil hogares. El agua se utiliza como fluido de trabajo debido a su gran capacidad calorífica y calor de vaporización.

Resumen
La energía es la capacidad de hacer trabajo (aplicar una fuerza para mover la materia). La energía cinética (KE) es la energía del movimiento; la energía potencial es energía debida a la posición relativa, composición o condición. Cuando la energía se convierte de una forma a otra, la energía no se crea ni se destruye (ley de conservación de energía o primera ley de termodinámica). La materia tiene energía térmica debido al KE de sus moléculas y temperatura que corresponde al KE promedio de sus moléculas. El calor es energía que se transfiere entre objetos a diferentes temperaturas; fluye de una temperatura alta a una baja. Los procesos químicos y físicos pueden absorber calor (endotérmico) o liberar calor (exotérmico). La unidad SI de energía, calor y trabajo es el joule (J). El calor específico y la capacidad calorífica son medidas de la energía necesaria para cambiar la temperatura de una sustancia u objeto. La cantidad de calor absorbido o liberado por una sustancia depende directamente del tipo de sustancia, su masa y el cambio de temperatura que sufre.
Ecuaciones Clave
- \(q=c×m×ΔT=c×m×(T_\ce{final}−T_\ce{initial})\)
Glosario
- caloría (cal)
- unidad de calor u otra energía; la cantidad de energía requerida para elevar 1 gramo de agua en 1 grado Celsius; 1 cal se define como 4.184 J
- proceso endotérmico
- reacción química o cambio físico que absorbe el calor
- energía
- capacidad para suministrar calor o hacer trabajo
- proceso exotérmico
- reacción química o cambio físico que libera calor
- calor (q)
- transferencia de energía térmica entre dos cuerpos
- capacidad calorífica (C)
- propiedad extensa de un cuerpo de materia que representa la cantidad de calor requerida para aumentar su temperatura en 1 grado Celsius (o 1 Kelvin)
- julio (J)
- Unidad de energía SI; 1 julio es la energía cinética de un objeto con una masa de 2 kilogramos moviéndose con una velocidad de 1 metro por segundo, 1 J = 1 kg m 2 /s y 4.184 J = 1 cal
- energía cinética
- energía de un cuerpo en movimiento, en julios, igual a\(\dfrac{1}{2}mv^2\) (donde m = masa y v = velocidad)
- energía potencial
- energía de una partícula o sistema de partículas derivada de la posición, composición o condición relativa
- capacidad calorífica específica (c)
- propiedad intensiva de una sustancia que representa la cantidad de calor requerida para elevar la temperatura de 1 gramo de la sustancia en 1 grado Celsius (o 1 Kelvin)
- temperatura
- propiedad intensiva de la materia que es una medida cuantitativa de “picor” y “frialdad”
- energía térmica
- energía cinética asociada con el movimiento aleatorio de átomos y moléculas
- termoquímica
- estudio de medir la cantidad de calor absorbido o liberado durante una reacción química o un cambio físico
- trabajo (w)
- transferencia de energía debido a cambios en variables macroscópicas externas como presión y volumen; o hacer que la materia se mueva contra una fuerza opuesta


