7.2: Enlace covalente
- Page ID
- 75595
- Describir la formación de enlaces covalentes
- Definir la electronegatividad y evaluar la polaridad de los enlaces covalentes
En los compuestos iónicos, los electrones se transfieren entre átomos de diferentes elementos para formar iones. Pero esta no es la única forma en que se pueden formar compuestos. Los átomos también pueden hacer enlaces químicos al compartir electrones entre sí. Tales enlaces se llaman enlaces covalentes. Los enlaces covalentes se forman entre dos átomos cuando ambos tienen tendencias similares a atraer electrones hacia ellos mismos (es decir, cuando ambos átomos tienen energías de ionización y afinidades electrónicas idénticas o bastante similares). Por ejemplo, dos átomos de hidrógeno se unen covalentemente para formar una molécula H 2; cada átomo de hidrógeno en la molécula H 2 tiene dos electrones estabilizándolo, dando a cada átomo el mismo número de electrones de valencia que el gas noble He.
Los compuestos que contienen enlaces covalentes exhiben diferentes propiedades físicas que los compuestos iónicos. Debido a que la atracción entre moléculas, que son eléctricamente neutras, es más débil que la que existe entre iones cargados eléctricamente, los compuestos covalentes generalmente tienen puntos de fusión y ebullición mucho más bajos que los compuestos iónicos. De hecho, muchos compuestos covalentes son líquidos o gases a temperatura ambiente y, en sus estados sólidos, suelen ser mucho más blandos que los sólidos iónicos. Además, mientras que los compuestos iónicos son buenos conductores de electricidad cuando se disuelven en agua, la mayoría de los compuestos covalentes, al ser eléctricamente neutros, son malos conductores de electricidad en cualquier estado.
Formación de enlaces covalentes
Los átomos no metálicos frecuentemente forman enlaces covalentes con otros átomos no metálicos. Por ejemplo, la molécula de hidrógeno, H 2, contiene un enlace covalente entre sus dos átomos de hidrógeno. La figura\(\PageIndex{1}\) ilustra por qué se forma este enlace. Comenzando por el extremo derecho, tenemos dos átomos de hidrógeno separados con una energía potencial particular, indicada por la línea roja. A lo largo del eje x se encuentra la distancia entre los dos átomos. A medida que los dos átomos se acercan entre sí (moviéndose a la izquierda a lo largo del eje x), sus orbitales de valencia (1 s) comienzan a superponerse. Los electrones individuales en cada átomo de hidrógeno interactúan entonces con ambos núcleos atómicos, ocupando el espacio alrededor de ambos átomos. La fuerte atracción de cada electrón compartido hacia ambos núcleos estabiliza el sistema, y la energía potencial disminuye a medida que disminuye la distancia del enlace. Si los átomos continúan acercándose entre sí, las cargas positivas en los dos núcleos comienzan a repelerse entre sí, y la energía potencial aumenta. La longitud de unión está determinada por la distancia a la que se alcanza la energía potencial más baja.
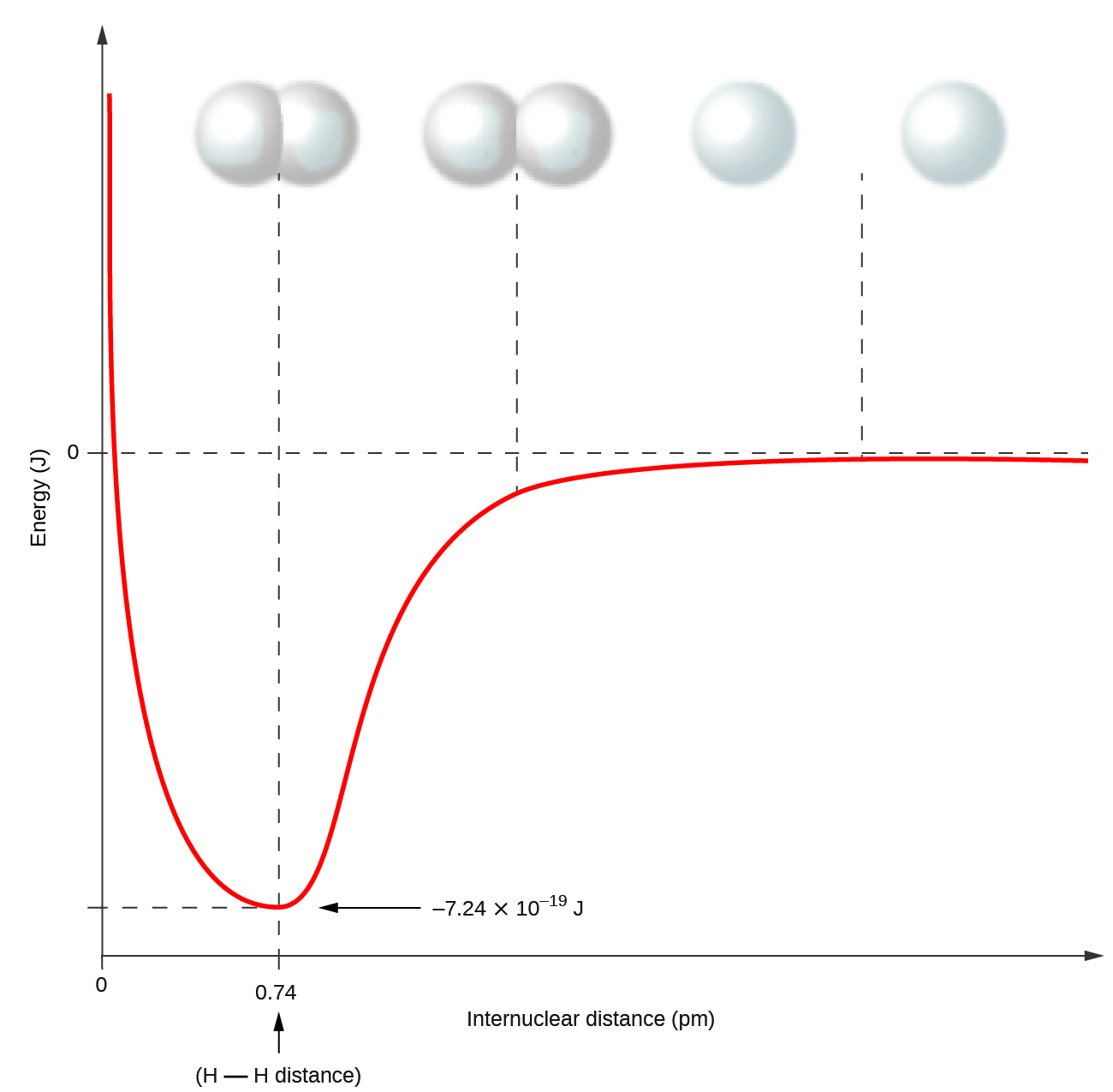
Es fundamental recordar que se debe agregar energía para romper los enlaces químicos (un proceso endotérmico), mientras que la formación de enlaces químicos libera energía (un proceso exotérmico). En el caso de H 2, el enlace covalente es muy fuerte; se debe agregar una gran cantidad de energía, 436 kJ, para romper los enlaces en un mol de moléculas de hidrógeno y hacer que los átomos se separen:
\[\ce{H2}(g)⟶\ce{2H}(g)\hspace{20px}ΔH=\mathrm{436\:kJ} \nonumber \]
Por el contrario, se libera la misma cantidad de energía cuando se forma un mol de moléculas H2 a partir de dos moles de átomos de H:
\[\ce{2H}(g)⟶\ce{H2}(g)\hspace{20px}ΔH=\mathrm{−436\:kJ} \nonumber \]
Puro vs. enlaces covalentes polares
Si los átomos que forman un enlace covalente son idénticos, como en H 2, Cl 2, y otras moléculas diatómicas, entonces los electrones en el enlace deben ser compartidos por igual. Nos referimos a esto como un enlace covalente puro. Los electrones compartidos en enlaces covalentes puros tienen la misma probabilidad de estar cerca de cada núcleo. En el caso de Cl 2, cada átomo comienza con siete electrones de valencia, y cada Cl comparte un electrón con el otro, formando un enlace covalente:
\[\ce{Cl + Cl⟶Cl2} \nonumber \]
El número total de electrones alrededor de cada átomo individual consiste en seis electrones no enlazantes y dos electrones compartidos (es decir, de unión) para ocho electrones totales, coincidiendo con el número de electrones de valencia en el argón de gas noble. Dado que los átomos de enlace son idénticos, Cl 2 también presenta un enlace covalente puro.
Cuando los átomos unidos por un enlace covalente son diferentes, los electrones de enlace son compartidos, pero ya no por igual. En cambio, los electrones de enlace son más atraídos por un átomo que por el otro, dando lugar a un desplazamiento de la densidad de electrones hacia ese átomo. Esta distribución desigual de electrones se conoce como un enlace covalente polar, caracterizado por una carga positiva parcial en un átomo y una carga negativa parcial en el otro. El átomo que atrae más fuertemente a los electrones adquiere la carga negativa parcial y viceversa. Por ejemplo, los electrones en el enlace H—Cl de una molécula de cloruro de hidrógeno pasan más tiempo cerca del átomo de cloro que cerca del átomo de hidrógeno. Así, en una molécula de HCl, el átomo de cloro lleva una carga negativa parcial y el átomo de hidrógeno tiene una carga positiva parcial. La figura\(\PageIndex{2}\) muestra la distribución de electrones en el enlace H—Cl. Tenga en cuenta que el área sombreada alrededor de Cl es mucho mayor que alrededor de H. Compárelo con la Figura\(\PageIndex{1}\), que muestra la distribución uniforme de electrones en el enlace no polar H 2.
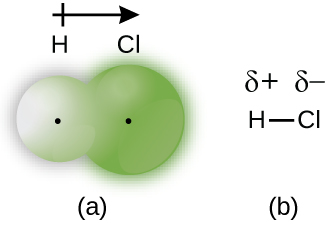
A veces designamos los átomos positivo y negativo en un enlace covalente polar usando una letra griega minúscula “delta”, δ, con un signo más o un signo menos para indicar si el átomo tiene una carga positiva parcial (δ+) o una carga negativa parcial (δ—). Este simbolismo se muestra para la molécula H—Cl en la Figura\(\PageIndex{2b}\).
Electronegatividad
Si un enlace es no polar o covalente polar está determinado por una propiedad de los átomos de enlace llamada electronegatividad. La electronegatividad es una medida de la tendencia de un átomo a atraer electrones (o densidad electrónica) hacia sí mismo. Determina cómo se distribuyen los electrones compartidos entre los dos átomos en un enlace. Cuanto más fuertemente atrae un átomo a los electrones en sus enlaces, mayor es su electronegatividad. Los electrones en un enlace covalente polar se desplazan hacia el átomo más electronegativo; así, el átomo más electronegativo es el que tiene la carga negativa parcial. Cuanto mayor sea la diferencia en la electronegatividad, más polarizada será la distribución de electrones y mayores serán las cargas parciales de los átomos.
La figura\(\PageIndex{3}\) muestra los valores de electronegatividad de los elementos propuestos por uno de los químicos más famosos del siglo XX: Linus Pauling. En general, la electronegatividad aumenta de izquierda a derecha a lo largo de un periodo de la tabla periódica y disminuye en grupo. Así, los no metales, que se encuentran en la parte superior derecha, tienden a tener las electronegatividades más altas, siendo el flúor el elemento más electronegativo de todos (EN = 4.0). Los metales tienden a ser menos elementos electronegativos, y los metales del grupo 1 tienen las electronegatividades más bajas. Obsérvese que los gases nobles están excluidos de esta cifra debido a que estos átomos generalmente no comparten electrones con otros átomos ya que tienen una capa de valencia completa. (Si bien los compuestos de gas noble como XEo 2 sí existen, solo se pueden formar en condiciones extremas, y por lo tanto no encajan perfectamente en el modelo general de electronegatividad).
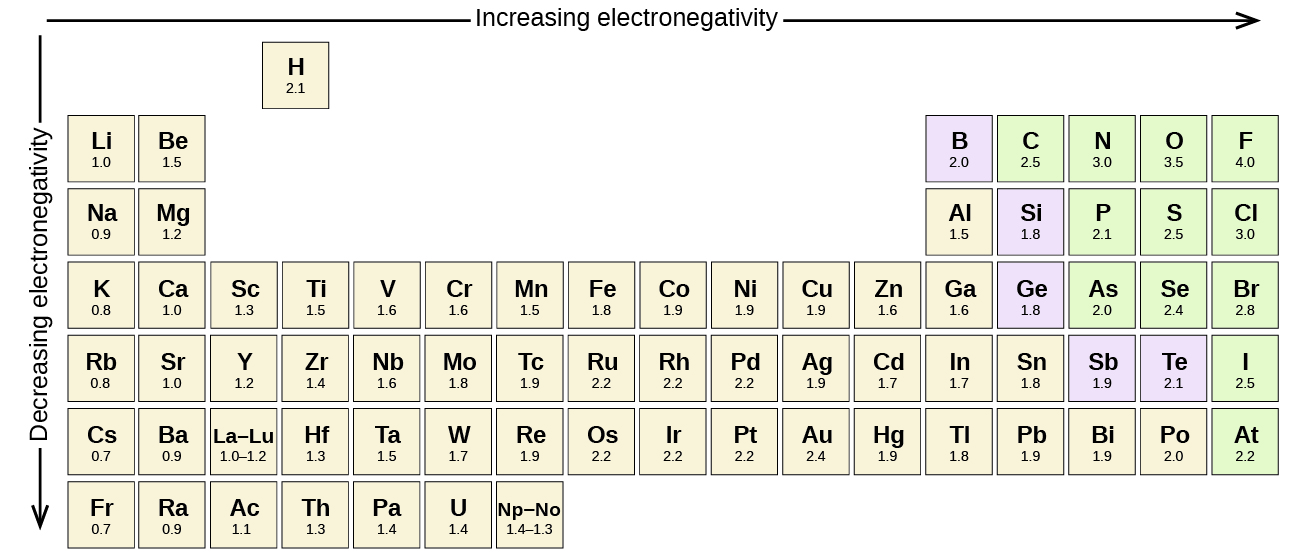
Linus Pauling es la única persona que ha recibido dos premios Nobel no compartidos (individuales): uno por química en 1954 por su trabajo sobre la naturaleza de los vínculos químicos y otro por la paz en 1962 por su oposición a las armas de destrucción masiva. Desarrolló muchas de las teorías y conceptos que son fundamentales para nuestra comprensión actual de la química, incluyendo electronegatividad y estructuras de resonancia.

Pauling también contribuyó a muchos otros campos además de la química. Su investigación sobre la anemia falciforme reveló la causa de la enfermedad, la presencia de una proteína anormal heredada genéticamente en la sangre, y allanó el camino para el campo de la genética molecular. Su trabajo también fue fundamental para frenar las pruebas de armas nucleares; demostró que las consecuencias radiactivas de las pruebas nucleares representaban un riesgo para la salud pública.
Electronegatividad versus afinidad electrónica
Debemos tener cuidado de no confundir la electronegatividad y la afinidad electrónica. La afinidad electrónica de un elemento es una cantidad física medible, es decir, la energía liberada o absorbida cuando un átomo aislado en fase gaseosa adquiere un electrón, medida en kJ/mol. La electronegatividad, por otro lado, describe cuán fuertemente un átomo atrae electrones en un enlace. Es una cantidad adimensional que se calcula, no se mide. Pauling derivó los primeros valores de electronegatividad comparando las cantidades de energía requeridas para romper diferentes tipos de enlaces. Eligió una escala relativa arbitraria que variaba de 0 a 4.
Electronegatividad y Tipo de Enlace
El valor absoluto de la diferencia en electronegatividad (ΔEN) de dos átomos unidos proporciona una medida aproximada de la polaridad que se espera en el enlace y, por lo tanto, el tipo de enlace. Cuando la diferencia es muy pequeña o cero, el enlace es covalente y no polar. Cuando es grande, el enlace es polar covalente o iónico. Los valores absolutos de las diferencias de electronegatividad entre los átomos en los enlaces H—H, H—Cl y Na—Cl son 0 (no polar), 0.9 (covalente polar) y 2.1 (iónico), respectivamente. El grado en que los electrones se comparten entre los átomos varía de completamente igual (enlace covalente puro) a nada (enlace iónico). La figura\(\PageIndex{4}\) muestra la relación entre la diferencia de electronegatividad y el tipo de enlace.

En la Figura se muestra una aproximación aproximada de las diferencias de electronegatividad asociadas con enlaces covalentes, covalentes polares e iónicos\(\PageIndex{4}\). Esta tabla es solo una guía general, sin embargo, con muchas excepciones. Por ejemplo, los átomos H y F en HF tienen una diferencia de electronegatividad de 1.9, y los átomos de N y H en NH 3 una diferencia de 0.9, sin embargo ambos compuestos forman enlaces que se consideran covalentes polares. Asimismo, los átomos de Na y Cl en NaCl tienen una diferencia de electronegatividad de 2.1, y los átomos de Mn e I en MnI 2 tienen una diferencia de 1.0, sin embargo, ambas sustancias forman compuestos iónicos.
La mejor guía para el carácter covalente o iónico de un enlace es considerar los tipos de átomos involucrados y sus posiciones relativas en la tabla periódica. Los enlaces entre dos no metales son generalmente covalentes; el enlace entre un metal y un no metal suele ser iónico.
Algunos compuestos contienen enlaces covalentes e iónicos. Los átomos en iones poliatómicos, como OH —\(\ce{NO3-}\), y\(\ce{NH4+}\), se mantienen unidos por enlaces covalentes polares. Sin embargo, estos iones poliatómicos forman compuestos iónicos al combinarse con iones de carga opuesta. Por ejemplo, el nitrato de potasio, KNO 3, contiene el catión K + y el\(\ce{NO3-}\) anión poliatómico. Así, el enlace en el nitrato de potasio es iónico, resultante de la atracción electrostática entre los iones K + y\(\ce{NO3-}\), así como covalente entre los átomos de nitrógeno y oxígeno en\(\ce{NO3-}\).
Las polaridades de enlace juegan un papel importante en la determinación de la estructura de las proteínas. Usando los valores de electronegatividad del Cuadro A2, organice los siguientes enlaces covalentes, todos comúnmente encontrados en aminoácidos, en orden de aumentar la polaridad. Luego designe los átomos positivos y negativos usando los símbolos δ+ y δ—:
C—H, C—N, C—O, N—H, O—H, S—H
Solución
La polaridad de estos enlaces aumenta a medida que aumenta el valor absoluto de la diferencia de electronegatividad. El átomo con la designación δ— es el más electronegativo de los dos. \(\PageIndex{1}\)El cuadro muestra estos enlaces en orden de polaridad creciente.
| Bond | ΔEN | Polaridad |
|---|---|---|
| C—H | 0.4 | \(\overset{δ−}{\ce C}−\overset{δ+}{\ce H}\) |
| S—H | 0.4 | \(\overset{δ−}{\ce S}−\overset{δ+}{\ce H}\) |
| C—N | 0.5 | \(\overset{δ+}{\ce C}−\overset{δ−}{\ce N}\) |
| N—H | 0.9 | \(\overset{δ−}{\ce N}−\overset{δ+}{\ce H}\) |
| C—O | 1.0 | \(\overset{δ+}{\ce C}−\overset{δ−}{\ce O}\) |
| O—H | 1.4 | \(\overset{δ−}{\ce O}−\overset{δ+}{\ce H}\) |
Las siliconas son compuestos poliméricos que contienen, entre otros, los siguientes tipos de enlaces covalentes: Si—O, Si—C, C—H y C—C. Usando los valores de electronegatividad de la Figura\(\PageIndex{3}\), ordenan los enlaces en orden de polaridad creciente y designan los átomos positivo y negativo usando los símbolos δ+ y δ—.
Contestar
| Bond | Diferencia de electronegatividad | Polaridad |
|---|---|---|
| C—C | 0.0 | no polar |
| C—H | 0.4 | \(\overset{δ−}{\ce C}−\overset{δ+}{\ce H}\) |
| Si—C | 0.7 | \(\overset{δ+}{\ce{Si}}−\overset{δ−}{\ce C}\) |
| Si—O | 1.7 | \(\overset{δ+}{\ce{Si}}−\overset{δ−}{\ce O}\) |
Resumen
Los enlaces covalentes se forman cuando los electrones se comparten entre los átomos y son atraídos por los núcleos de ambos átomos. En enlaces covalentes puros, los electrones se comparten por igual. En los enlaces covalentes polares, los electrones se comparten de manera desigual, ya que un átomo ejerce una fuerza de atracción más fuerte sobre los electrones que el otro. La capacidad de un átomo para atraer un par de electrones en un enlace químico se llama su electronegatividad. La diferencia en la electronegatividad entre dos átomos determina qué tan polar será un enlace. En una molécula diatómica con dos átomos idénticos, no hay diferencia en la electronegatividad, por lo que el enlace es no polar o covalente puro. Cuando la diferencia de electronegatividad es muy grande, como es el caso entre metales y no metales, la unión se caracteriza como iónica.
Glosario
- longitud de unión
- distancia entre los núcleos de dos átomos unidos en los que se alcanza la energía potencial más baja
- enlace covalente
- enlace formado cuando los electrones se comparten entre los átomos
- electronegatividad
- tendencia de un átomo a atraer electrones en un enlace a sí mismo
- enlace covalente polar
- enlace covalente entre átomos de diferentes electronegatividades; un enlace covalente con un extremo positivo y un extremo negativo
- enlace covalente puro
- (también, enlace covalente no polar) enlace covalente entre átomos de electronegatividades idénticas


