7.3: Símbolos y estructuras de Lewis
- Page ID
- 75607
- Escribe símbolos de Lewis para átomos neutros e iones
- Dibujar estructuras de Lewis que representan la unión en moléculas simples
Hasta el momento, hemos discutido los diversos tipos de enlaces que se forman entre átomos y/o iones. En todos los casos, estos enlaces implican la compartición o transferencia de electrones de concha de valencia entre átomos. En esta sección, exploraremos el método típico para representar electrones de concha de valencia y enlaces químicos, a saber, símbolos de Lewis y estructuras de Lewis.
Símbolos de Lewis
Utilizamos símbolos de Lewis para describir configuraciones de electrones de valencia de átomos e iones monatómicos. Un símbolo de Lewis consiste en un símbolo elemental rodeado por un punto para cada uno de sus electrones de valencia:
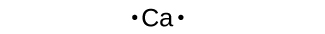
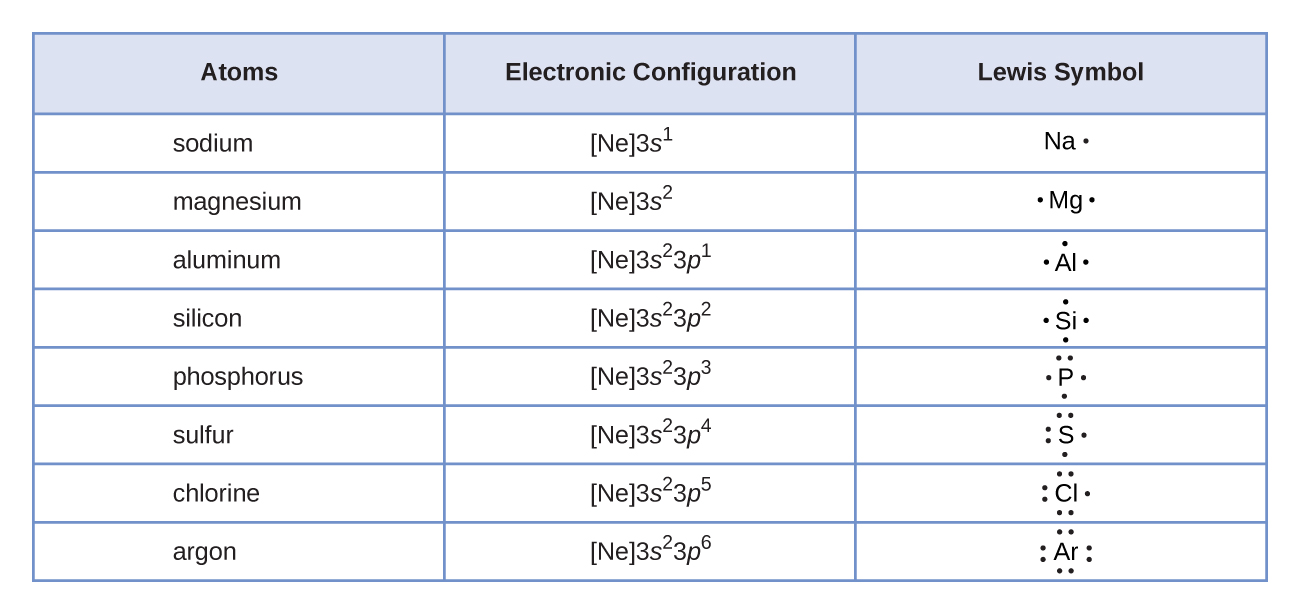
Los símbolos de Lewis se pueden utilizar para ilustrar la formación de cationes a partir de átomos, como se muestra aquí para el sodio y el calcio:

Asimismo, se pueden utilizar para mostrar la formación de aniones a partir de átomos, como se muestra aquí para cloro y azufre:

Lewis Estructuras
También utilizamos símbolos de Lewis para indicar la formación de enlaces covalentes, que se muestran en estructuras de Lewis, dibujos que describen la unión en moléculas e iones poliatómicos. Por ejemplo, cuando dos átomos de cloro forman una molécula de cloro, comparten un par de electrones:
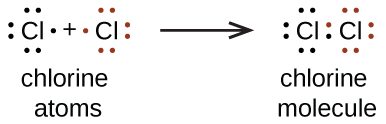
La estructura de Lewis indica que cada átomo de Cl tiene tres pares de electrones que no se utilizan en la unión (llamados pares solitarios) y un par compartido de electrones (escritos entre los átomos). Un guión (o línea) se usa generalmente para indicar un par compartido de electrones:
![]()
En el modelo de Lewis, un solo par compartido de electrones es un enlace sencillo. Cada átomo de Cl interactúa con ocho electrones de valencia en total: los seis en los pares solitarios y los dos en el enlace sencillo.
La regla del octeto
Las otras moléculas halógenas (F 2, Br 2, I 2 y At 2) forman enlaces como los de la molécula de cloro: un enlace sencillo entre átomos y tres pares solitarios de electrones por átomo. Esto permite que cada átomo de halógeno tenga una configuración electrónica de gas noble. La tendencia de los átomos del grupo principal a formar suficientes enlaces para obtener ocho electrones de valencia se conoce como regla del octeto.
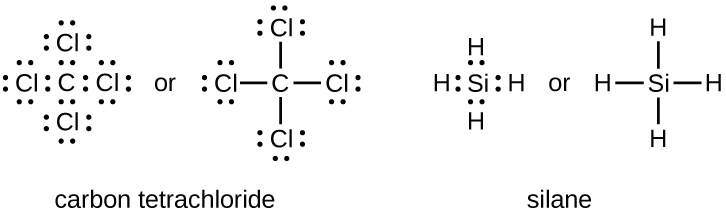
El número de enlaces que puede formar un átomo a menudo se puede predecir a partir del número de electrones necesarios para alcanzar un octeto (ocho electrones de valencia); esto es especialmente cierto para los no metales del segundo período de la tabla periódica (C, N, O y F). Por ejemplo, cada átomo de un elemento del grupo 14 tiene cuatro electrones en su caparazón más externo y por lo tanto requiere cuatro electrones más para alcanzar un octeto. Estos cuatro electrones se pueden ganar formando cuatro enlaces covalentes, como se ilustra aquí para el carbono en CCl 4 (tetracloruro de carbono) y silicio en SiH 4 (silano). Debido a que el hidrógeno solo necesita dos electrones para llenar su caparazón de valencia, es una excepción a la regla del octeto y solo necesita formar un enlace. Los elementos de transición y los elementos de transición internos tampoco siguen la regla del octeto ya que tienen electrones d y f involucrados en sus conchas de valencia.
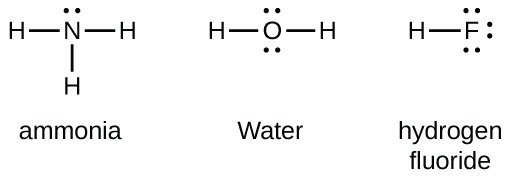
Los elementos del grupo 15 como el nitrógeno tienen cinco electrones de valencia en el símbolo atómico de Lewis: un par solitario y tres electrones desapareados. Para obtener un octeto, estos átomos forman tres enlaces covalentes, como en NH 3 (amoníaco). El oxígeno y otros átomos del grupo 16 obtienen un octeto formando dos enlaces covalentes:
Bonos Dobles y Triples
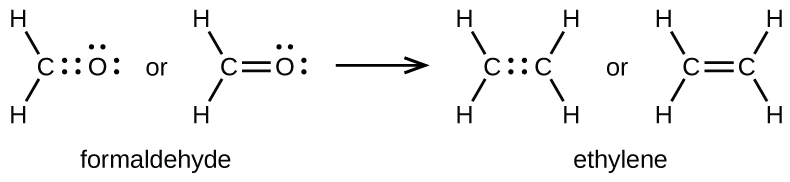
Como se mencionó anteriormente, cuando un par de átomos comparte un par de electrones, lo llamamos un enlace sencillo. Sin embargo, un par de átomos puede necesitar compartir más de un par de electrones para lograr el octeto requerido. Se forma un doble enlace cuando dos pares de electrones se comparten entre un par de átomos, como entre los átomos de carbono y oxígeno en CH 2 O (formaldehído) y entre los dos átomos de carbono en C 2 H 4 (etileno):
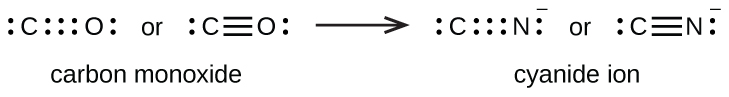
Se forma un triple enlace cuando tres pares de electrones son compartidos por un par de átomos, como en el monóxido de carbono (CO) y el ion cianuro (CN —):
Escribiendo estructuras de Lewis con la regla del octeto
Para moléculas e iones moleculares muy simples, podemos escribir las estructuras de Lewis simplemente emparejando los electrones desapareados en los átomos constituyentes. Vea estos ejemplos:
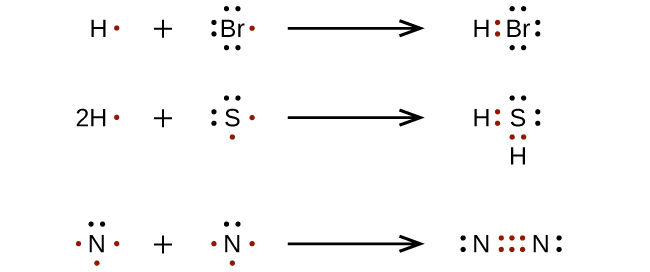
Para moléculas e iones moleculares más complicados, es útil seguir el procedimiento paso a paso descrito aquí:
- Determinar el número total de electrones de valencia (capa externa) entre todos los átomos. Para los cationes, restar un electrón por cada carga positiva. Para los aniones, agregue un electrón por cada carga negativa.
- Dibuja una estructura esquelética de la molécula o ion, disponiendo los átomos alrededor de un átomo central. (Generalmente, el elemento menos electronegativo debe colocarse en el centro). Conecte cada átomo al átomo central con un enlace sencillo (un par de electrones).
- Distribuir los electrones restantes como pares solitarios en los átomos terminales (excepto hidrógeno), completando un octeto alrededor de cada átomo.
- Colocar todos los electrones restantes en el átomo central.
- Reorganizar los electrones de los átomos externos para hacer múltiples enlaces con el átomo central para obtener octetos siempre que sea posible.
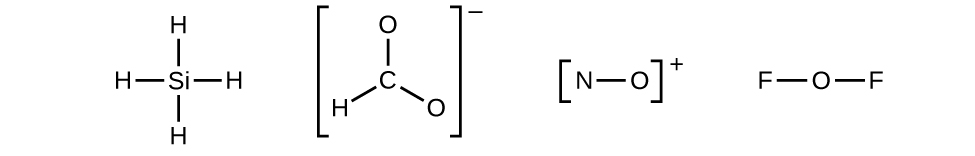
Determinemos las estructuras de Lewis de SiH 4\(\ce{CHO2-}\),, NO +, y OF 2 como ejemplos siguiendo este procedimiento:
- Determinar el número total de electrones de valencia (capa externa) en la molécula o ion.
- Para una molécula, agregamos el número de electrones de valencia en cada átomo de la molécula:
\(\begin{align} &\phantom{+}\ce{SiH4}\\ &\phantom{+}\textrm{Si: 4 valence electrons/atom × 1 atom = 4}\\ &\underline{\textrm{+H: 1 valence electron/atom × 4 atoms = 4}}\\ &\hspace{271px}\textrm{= 8 valence electrons} \end{align}\)
- Para un ion negativo, como\(\ce{CHO2-}\), agregamos el número de electrones de valencia en los átomos al número de cargas negativas en el ion (se gana un electrón por cada carga negativa única):
\ (\ ce {CHO2-}\\
\ textrm {C: 4 electrones de valencia/átomo × 1 átomo}\ hespacio {6px} =\ fantasma {1} 4\\
\ textrm {H: 1 electrón/átomo de valencia × 1 átomo}\ hespacio {12px} =\ phantom {1} 1\\
\ textrm {O: 6 electrones/átomo de valencia × 2 átomos = 12}\\
\ subrayado {+\ hspace {100px}\ textrm {1 electrón adicional}\ hspace {9px} =\ phantom {1} 1}\
\\ hspace {264px}\ textrm {= 18 electrones de valencia}\) - Para un ion positivo, como NO +, sumamos el número de electrones de valencia en los átomos en el ion y luego restamos el número de cargas positivas en el ion (se pierde un electrón por cada carga positiva única) del número total de electrones de valencia:
\ (\ ce {NO+}\\
\ textrm {N: 5 electrones de valencia/átomo × 1 átomo} =\ phantom {−} 5\\
\ textrm {O: 6 electrones de valencia/átomo × 1 átomo}\ hespacio {5px} =\ fantasma {−} 6\\
\ subrayado {\ textrm {+ −1 electrón (carga positiva)}\ hespacio {44px} = −1}\\
\ hspace {260px}\ textrm {= 10 electrones de valencia}\) - Dado que el DE 2 es una molécula neutra, simplemente agregamos el número de electrones de valencia:
\ (\ phantom {+}\ ce {OF2}\
\ fantasma {+}\ textrm {O: 6 electrones de valencia/átomo × 1 átomo}\ hespacio {10px} = 6\\
\ subrayado {\ textrm {+ F: 7 electrones de valencia/átomo × 2 átomos} = 14}\
\\ hspace {280px}\ textrm {= 20 electrones de valencia}\)
- Para una molécula, agregamos el número de electrones de valencia en cada átomo de la molécula:
- Dibuja una estructura esquelética de la molécula o ion, disponiendo los átomos alrededor de un átomo central y conectando cada átomo al átomo central con un solo enlace (un par de electrones). (Tenga en cuenta que denotamos iones con corchetes alrededor de la estructura, indicando la carga fuera de los corchetes:)
- Cuando son posibles varias disposiciones de átomos, en cuanto a\(\ce{CHO2-}\), debemos usar evidencia experimental para elegir la correcta. En general, los elementos menos electronegativos tienen más probabilidades de ser átomos centrales. En\(\ce{CHO2-}\), el átomo de carbono menos electronegativo ocupa la posición central con los átomos de oxígeno e hidrógeno que lo rodean. Otros ejemplos incluyen P en POCl 3, S en SO 2 y Cl en\(\ce{ClO4-}\). Una excepción es que el hidrógeno casi nunca es un átomo central. Como elemento más electronegativo, el flúor tampoco puede ser un átomo central.
- Distribuir los electrones restantes como pares solitarios en los átomos terminales (excepto hidrógeno) para completar sus conchas de valencia con un octeto de electrones.
- No quedan electrones en SiH 4, por lo que no se modifica:
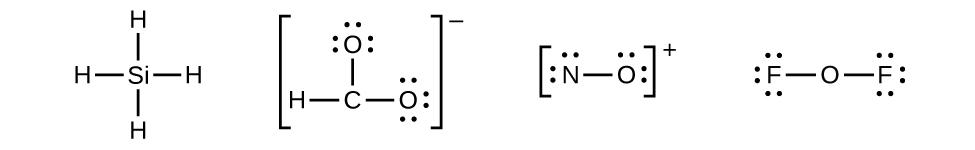
- Colocar todos los electrones restantes en el átomo central.
- Para SiH 4\(\ce{CHO2-}\),, y NO +, no quedan electrones; ya colocamos todos los electrones determinados en el Paso 1.
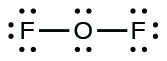
- Para el DE 2, teníamos 16 electrones restantes en el Paso 3, y colocamos 12, dejando 4 para ser colocados en el átomo central:
- Reorganizar los electrones de los átomos externos para hacer múltiples enlaces con el átomo central para obtener octetos siempre que sea posible.
- SiH 4: Si ya tiene octeto, así que no hay que hacer nada.
- \(\ce{CHO2-}\): We have distributed the valence electrons as lone pairs on the oxygen atoms, but the carbon atom lacks an octet:
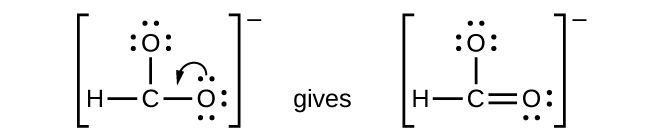
- NO +: Para este ion, agregamos ocho electrones externos, pero ninguno de los átomos tiene octeto. No podemos agregar más electrones ya que ya usamos el total que encontramos en el Paso 1, por lo que debemos mover electrones para formar un enlace múltiple:
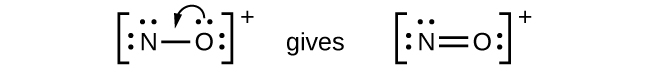
- Esto todavía no produce un octeto, por lo que debemos mover otro par, formando un triple enlace:
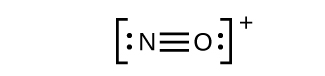
- En DE 2, cada átomo tiene un octeto tal como se dibuja, así que nada cambia.
NASA’s Cassini-Huygens mission detected a large cloud of toxic hydrogen cyanide (HCN) on Titan, one of Saturn’s moons. Titan also contains ethane (H3CCH3), acetylene (HCCH), and ammonia (NH3). What are the Lewis structures of these molecules?
Solution
Calculate the number of valence electrons.
- HCN: (1 × 1) + (4 × 1) + (5 × 1) = 10
- H3CCH3: (1 × 3) + (2 × 4) + (1 × 3) = 14
- HCCH: (1 × 1) + (2 × 4) + (1 × 1) = 10
- NH3: (5 × 1) + (3 × 1) = 8
Draw a skeleton and connect the atoms with single bonds. Remember that H is never a central atom:
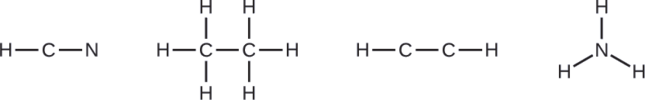
Where needed, distribute electrons to the terminal atoms:
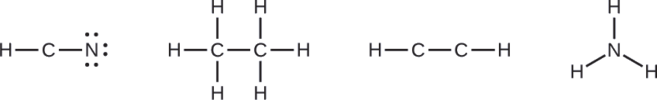
- HCN: six electrons placed on N
- H3CCH3: no electrons remain
- HCCH: no terminal atoms capable of accepting electrons
- NH3: no terminal atoms capable of accepting electrons
Where needed, place remaining electrons on the central atom:
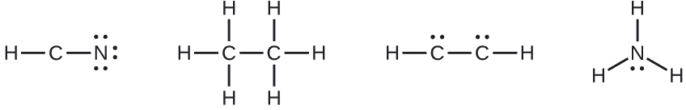
- HCN: no electrons remain
- H3CCH3: no electrons remain
- HCCH: four electrons placed on carbon
- NH3: two electrons placed on nitrogen
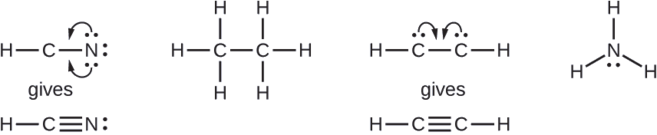
Where needed, rearrange electrons to form multiple bonds in order to obtain an octet on each atom:
- HCN: form two more C–N bonds
- H3CCH3: all atoms have the correct number of electrons
- HCCH: form a triple bond between the two carbon atoms
- NH3: all atoms have the correct number of electrons
Both carbon monoxide, CO, and carbon dioxide, CO2, are products of the combustion of fossil fuels. Both of these gases also cause problems: CO is toxic and CO2 has been implicated in global climate change. What are the Lewis structures of these two molecules?
- Answer
-
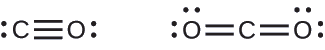
Carbon soot has been known to man since prehistoric times, but it was not until fairly recently that the molecular structure of the main component of soot was discovered. In 1996, the Nobel Prize in Chemistry was awarded to Richard Smalley, Robert Curl, and Harold Kroto for their work in discovering a new form of carbon, the C60 buckminsterfullerene molecule. An entire class of compounds, including spheres and tubes of various shapes, were discovered based on C60. This type of molecule, called a fullerene, consists of a complex network of single- and double-bonded carbon atoms arranged in such a way that each carbon atom obtains a full octet of electrons. Because of their size and shape, fullerenes can encapsulate other molecules, so they have shown potential in various applications from hydrogen storage to targeted drug delivery systems. They also possess unique electronic and optical properties that have been put to good use in solar powered devices and chemical sensors.
Exceptions to the Octet Rule
Many covalent molecules have central atoms that do not have eight electrons in their Lewis structures. These molecules fall into three categories:
- Odd-electron molecules have an odd number of valence electrons, and therefore have an unpaired electron.
- Electron-deficient molecules have a central atom that has fewer electrons than needed for a noble gas configuration.
- Hypervalent molecules have a central atom that has more electrons than needed for a noble gas configuration.
Odd-electron Molecules
We call molecules that contain an odd number of electrons free radicals. Nitric oxide, NO, is an example of an odd-electron molecule; it is produced in internal combustion engines when oxygen and nitrogen react at high temperatures.
To draw the Lewis structure for an odd-electron molecule like NO, we follow the same five steps we would for other molecules, but with a few minor changes:
- Determine the total number of valence (outer shell) electrons. The sum of the valence electrons is 5 (from N) + 6 (from O) = 11. The odd number immediately tells us that we have a free radical, so we know that not every atom can have eight electrons in its valence shell.
- Draw a skeleton structure of the molecule. We can easily draw a skeleton with an N–O single bond: N–O
- Distribute the remaining electrons as lone pairs on the terminal atoms. In this case, there is no central atom, so we distribute the electrons around both atoms. We give eight electrons to the more electronegative atom in these situations; thus oxygen has the filled valence shell:
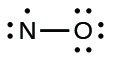
- Colocar todos los electrones restantes en el átomo central. Dado que no quedan electrones, este paso no aplica.
- Reorganizar los electrones para hacer múltiples enlaces con el átomo central para obtener octetos siempre que sea posible. Sabemos que una molécula de electrones impares no puede tener un octeto por cada átomo, pero queremos acercar cada átomo lo más posible a un octeto. En este caso, el nitrógeno tiene sólo cinco electrones a su alrededor. Para acercarnos a un octeto de nitrógeno, tomamos uno de los pares solitarios del oxígeno y lo usamos para formar un doble enlace NO. (No podemos tomar otro par solitario de electrones en oxígeno y formar un triple enlace porque el nitrógeno tendría entonces nueve electrones:)
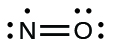
Moléculas deficientes en electrones
También encontraremos algunas moléculas que contienen átomos centrales que no tienen una concha de valencia llena. Generalmente, se trata de moléculas con átomos centrales de los grupos 2 y 13 y átomos externos que son hidrógeno u otros átomos que no forman múltiples enlaces. Por ejemplo, en las estructuras de Lewis del dihidruro de berilio, BeH 2, y trifluoruro de boro, BF 3, los átomos de berilio y boro tienen cada uno solo cuatro y seis electrones, respectivamente. Es posible dibujar una estructura con un doble enlace entre un átomo de boro y un átomo de flúor en BF 3, satisfaciendo la regla del octeto, pero la evidencia experimental indica que las longitudes de enlace son más cercanas a la esperada para los enlaces simples B-F. Esto sugiere que la mejor estructura de Lewis tiene tres enlaces simples B-F y un boro deficiente en electrones. La reactividad del compuesto también es consistente con un boro deficiente en electrones. Sin embargo, los enlaces B-F son ligeramente más cortos de lo que realmente se espera para los enlaces simples B-F, lo que indica que se encuentra algún carácter de doble enlace en la molécula real.
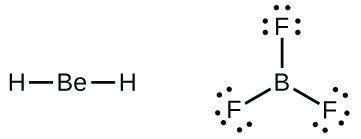
Un átomo como el átomo de boro en BF 3, que no tiene ocho electrones, es muy reactivo. Se combina fácilmente con una molécula que contiene un átomo con un par solitario de electrones. Por ejemplo, NH 3 reacciona con BF 3 porque el par solitario sobre nitrógeno puede compartirse con el átomo de boro:
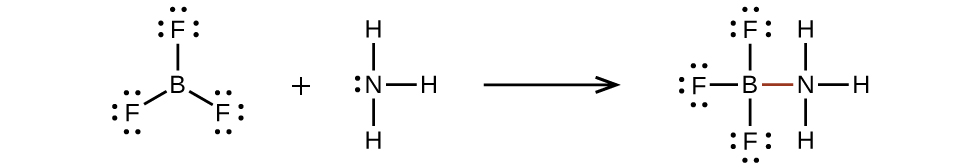
Moléculas hipervalentes
Los elementos en el segundo periodo de la tabla periódica (n = 2) pueden acomodar sólo ocho electrones en sus orbitales de concha de valencia porque solo tienen cuatro orbitales de valencia (uno de 2 s y tres orbitales de 2 p). Los elementos en los períodos tercero y superior (n ≥ 3) tienen más de cuatro orbitales de valencia y pueden compartir más de cuatro pares de electrones con otros átomos debido a que tienen orbitales d vacíos en la misma cáscara. Las moléculas formadas a partir de estos elementos a veces se denominan moléculas hipervalentes.\(\PageIndex{5}\) La tabla muestra las estructuras de Lewis para dos moléculas hipervalentes, pCl 5 y SF 6.
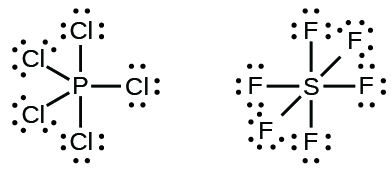
En algunas moléculas hipervalentes, como IF 5 y xEF 4, algunos de los electrones en la capa externa del átomo central son pares solitarios:
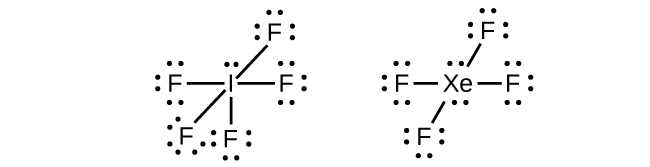
Cuando escribimos las estructuras de Lewis para estas moléculas, encontramos que nos quedan electrones después de llenar las conchas de valencia de los átomos externos con ocho electrones. Estos electrones adicionales deben ser asignados al átomo central.
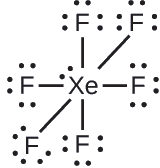
El xenón es un gas noble, pero forma una serie de compuestos estables. Lo examinamos\(\ce{XeF4}\) antes. ¿Cuáles son las estructuras de Lewis\(\ce{XeF2}\) y\(\ce{XeF6}\)?
Solución
Podemos dibujar la estructura de Lewis de cualquier molécula covalente siguiendo los seis pasos discutidos anteriormente. En este caso, podemos condensar los últimos pasos, ya que no todos aplican.
Paso 1: Calcular el número de electrones de valencia:
\(\ce{XeF6}\): 8 + (6 × 7) = 50
Paso 2: Dibuja un esqueleto uniendo los átomos mediante enlaces sencillos. El xenón será el átomo central porque el flúor no puede ser un átomo central:
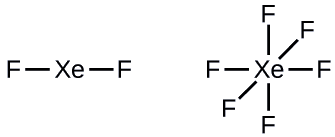
Paso 3: Distribuir los electrones restantes.
XeF 2: Colocamos tres pares solitarios de electrones alrededor de cada átomo F, representando 12 electrones y dando a cada átomo F 8 electrones. Así, quedan seis electrones (tres pares solitarios). Estos pares solitarios deben colocarse en el átomo de Xe. Esto es aceptable porque los átomos de Xe tienen orbitales de concha d de valencia vacía y pueden acomodar más de ocho electrones. La estructura de Lewis de XeF 2 muestra dos pares de enlaces y tres pares solitarios de electrones alrededor del átomo de Xe:
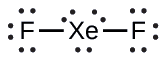
XeF 6: Colocamos tres pares solitarios de electrones alrededor de cada átomo F, lo que representa 36 electrones. Quedan dos electrones, y este par solitario se coloca en el átomo de Xe:
Los halógenos forman una clase de compuestos llamados los interhalógenos, en los que los átomos de halógeno se unen covalentemente entre sí. Escribir las estructuras de Lewis para los interhalógenos\(\ce{BrCl3}\) y\(\ce{ICl4-}\).
- Contestar
-
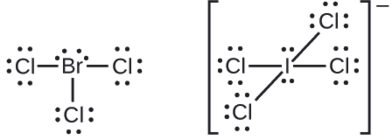
Resumen
Las estructuras electrónicas de valencia se pueden visualizar dibujando símbolos de Lewis (para átomos e iones monoatómicos) y estructuras de Lewis (para moléculas e iones poliatómicos). Se utilizan pares solitarios, electrones desapareados y enlaces simples, dobles o triples para indicar dónde se encuentran los electrones de valencia alrededor de cada átomo en una estructura de Lewis. La mayoría de las estructuras, especialmente las que contienen elementos de segunda fila, obedecen a la regla del octeto, en la que cada átomo (excepto H) está rodeado por ocho electrones. Las excepciones a la regla del octeto ocurren para moléculas de electrones impares (radicales libres), moléculas deficientes en electrones y moléculas hipervalentes.
Glosario
- doble enlace
- enlace covalente en el que dos pares de electrones se comparten entre dos átomos
- radicales libres
- molécula que contiene un número impar de electrones
- molécula hipervalente
- molécula que contiene al menos un elemento del grupo principal que tiene más de ocho electrones en su capa de valencia
- Estructura de Lewis
- diagrama que muestra pares solitarios y pares de unión de electrones en una molécula o un ion
- Símbolo de Lewis
- símbolo para un elemento o ion monoatómico que usa un punto para representar cada electrón de valencia en el elemento o ion
- par solitario
- dos (un par de) electrones de valencia que no se utilizan para formar un enlace covalente
- regla del octeto
- pauta que establece que los átomos del grupo principal formarán estructuras en las que ocho electrones de valencia interactúan con cada núcleo, contando los electrones de enlace como interactuando con ambos átomos conectados por el enlace
- enlace sencillo
- enlace en el que un solo par de electrones se comparte entre dos átomos
- triple enlace
- enlace en el que tres pares de electrones se comparten entre dos átomos


