7.5: Fortalezas de los enlaces iónicos y covalentes
- Page ID
- 75583
- Describir la energía de la formación y rotura de enlaces covalentes e iónicos
- Usar el ciclo Born-Haber para calcular energías de red para compuestos iónicos
- Usar energías promedio de enlace covalente para estimar entalpías de reacción
La fuerza de un enlace describe la fuerza con la que cada átomo está unido a otro átomo y, por lo tanto, cuánta energía se requiere para romper el enlace entre los dos átomos. En esta sección, aprenderá sobre la fuerza de enlace de los enlaces covalentes, y luego comparará eso con la fuerza de los enlaces iónicos, que está relacionada con la energía reticular de un compuesto.
Fuerza de enlace: enlaces covalentes
Las moléculas estables existen porque los enlaces covalentes mantienen unidos los átomos. Medimos la fuerza de un enlace covalente por la energía requerida para romperlo, es decir, la energía necesaria para separar los átomos unidos. Separar cualquier par de átomos unidos requiere energía; cuanto más fuerte sea un enlace, mayor será la energía requerida para romperlo. La energía requerida para romper un enlace covalente específico en un mol de moléculas gaseosas se denomina energía de enlace o energía de disociación de enlace. La energía de enlace para una molécula diatómica\(D_{X–Y}\),, se define como el cambio de entalpía estándar para la reacción endotérmica:
\[XY_{(g)}⟶X_{(g)}+Y_{(g)}\;\;\; D_{X−Y}=ΔH° \label{7.6.1} \]
Por ejemplo, la energía de enlace del enlace H — H covalente puro\(\Delta_{H–H}\), es 436 kJ por mol de enlaces H—H rotos:
\[H_{2(g)}⟶2H_{(g)} \;\;\; D_{H−H}=ΔH°=436kJ \label{EQ2} \]
Romper un enlace siempre requiere que se agregue energía a la molécula. Correspondientemente, hacer un vínculo siempre libera energía.
Las moléculas con tres o más átomos tienen dos o más enlaces. La suma de todas las energías de enlace en dicha molécula es igual al cambio de entalpía estándar para la reacción endotérmica que rompe todos los enlaces en la molécula. Por ejemplo, la suma de las cuatro energías de enlace C-H en CH 4, 1660 kJ, es igual al cambio de entalpía estándar de la reacción:
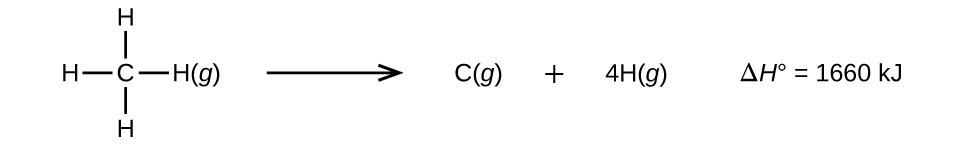
La energía promedio de enlace C—H\(D_{C–H}\), es 1660/4 = 415 kJ/mol porque hay cuatro moles de enlaces C—H rotos por mol de reacción. Aunque los cuatro enlaces C—H son equivalentes en la molécula original, no requieren cada uno la misma energía para romperse; una vez que se rompe el primer enlace (lo que requiere 439 kJ/mol), los enlaces restantes son más fáciles de romper. El valor de 415 kJ/mol es el promedio, no el valor exacto requerido para romper cualquier enlace.
La fuerza de un enlace entre dos átomos aumenta a medida que aumenta el número de pares de electrones en el enlace. Generalmente, a medida que aumenta la fuerza de unión, la longitud de unión disminuye. Así, encontramos que los enlaces triples son más fuertes y más cortos que los dobles enlaces entre los mismos dos átomos; asimismo, los dobles enlaces son más fuertes y más cortos que los enlaces simples entre los mismos dos átomos. Las energías promedio de enlace para algunos enlaces comunes aparecen en la Tabla\(\PageIndex{2}\), y una comparación de longitudes de enlace y fuerzas de unión para algunos enlaces comunes aparece en la Tabla\(\PageIndex{2}\). Cuando un átomo se une a varios átomos en un grupo, la fuerza del enlace generalmente disminuye a medida que bajamos del grupo. Por ejemplo, C-F es 439 kJ/mol, C—Cl es 330 kJ/mol y C—Br es 275 kJ/mol.
| Bond | Energía de bonos | Bond | Energía de bonos | Bond | Energía de bonos | ||
|---|---|---|---|---|---|---|---|
| H—H | 436 | C—S | 260 | F—Cl | 255 | ||
| H—C | 415 | C—Cl | 330 | F—Br | 235 | ||
| H—N | 390 | C—Br | 275 | Si—Si | 230 | ||
| H—O | 464 | C—I | 240 | Si—P | 215 | ||
| H—F | 569 | N—N | 160 | Si—S | 225 | ||
| H—Si | 395 | \(\mathrm{N=N}\) | 418 | Si—Cl | 359 | ||
| H—P | 320 | \(\mathrm{N≡N}\) | 946 | Si—Br | 290 | ||
| H—S | 340 | N—O | 200 | Si—I | 215 | ||
| H—Cl | 432 | N—F | 270 | P—P | 215 | ||
| H—Br | 370 | N—P | 210 | P—S | 230 | ||
| H—I | 295 | N—Cl | 200 | P—Cl | 330 | ||
| C—C | 345 | N—Br | 245 | P—Br | 270 | ||
| \(\mathrm{C=C}\) | 611 | O—O | 140 | P—I | 215 | ||
| \(\mathrm{C≡C}\) | 837 | \(\mathrm{O=O}\) | 498 | S—S | 215 | ||
| C—N | 290 | O—F | 160 | S—Cl | 250 | ||
| \(\mathrm{C=N}\) | 615 | O—Si | 370 | S—Br | 215 | ||
| \(\mathrm{C≡N}\) | 891 | O—P | 350 | Cl—Cl | 243 | ||
| C—O | 350 | O—Cl | 205 | Cl—Br | 220 | ||
| \(\mathrm{C=O}\) | 741 | O—I | 200 | Cl—I | 210 | ||
| \(\mathrm{C≡O}\) | 1080 | F—F | 160 | Br—Br | 190 | ||
| C—F | 439 | F—Si | 540 | Br—I | 180 | ||
| C—Si | 360 | F—P | 489 | I—I | 150 | ||
| C—P | 265 | F—S | 285 |
| Bond | Longitud de enlace (Å) | Energía de enlace (kJ/mol) |
|---|---|---|
| C—C | 1.54 | 345 |
| \(\mathrm{C=C}\) | 1.34 | 611 |
| \(\mathrm{C≡C}\) | 1.20 | 837 |
| C—N | 1.43 | 290 |
| \(\mathrm{C=N}\) | 1.38 | 615 |
| \(\mathrm{C≡N}\) | 1.16 | 891 |
| C—O | 1.43 | 350 |
| \(\mathrm{C=O}\) | 1.23 | 741 |
| \(\mathrm{C≡O}\) | 1.13 | 1080 |
Podemos usar energías de enlace para calcular los cambios aproximados de entalpía para reacciones en las que no se dispone de entalpías de formación. Los cálculos de este tipo también nos dirán si una reacción es exotérmica o endotérmica.
- Una reacción exotérmica (Δ H negativo, calor producido) resulta cuando los enlaces en los productos son más fuertes que los enlaces en los reactivos.
- Una reacción endotérmica (Δ H positivo, calor absorbido) resulta cuando los enlaces en los productos son más débiles que los de los reactivos.
El cambio de entalpía, Δ H, para una reacción química es aproximadamente igual a la suma de la energía requerida para romper todos los enlaces en los reactivos (energía “in”, signo positivo) más la energía liberada cuando se forman todos los enlaces en los productos (energía “out”, signo negativo). Esto se puede expresar matemáticamente de la siguiente manera:
\[\Delta H=\sum D_{\text{bonds broken}}− \sum D_{\text{bonds formed}} \label{EQ3} \]
En esta expresión, el símbolo\(\Sigma\) significa “la suma de” y D representa la energía del enlace en kilojulios por mol, que siempre es un número positivo. La energía de enlace se obtiene de una tabla y dependerá de si el enlace particular es un enlace simple, doble o triple. Así, al calcular las entalpías de esta manera, es importante que consideremos la unión en todos los reactivos y productos. Debido a que los valores D son típicamente promedios para un tipo de enlace en muchas moléculas diferentes, este cálculo proporciona una estimación aproximada, no un valor exacto, para la entalpía de reacción.
Considere la siguiente reacción:
\[\ce{H_{2(g)} + Cl_{2(g)}⟶2HCl_{(g)}} \label{EQ4} \]
o
\[\ce{H–H_{(g)} + Cl–Cl_{(g)}⟶2H–Cl_{(g)}} \label{\EQ5} \]
Para formar dos moles de HCl, se debe romper un mol de enlaces H—H y un mol de enlaces Cl—Cl. La energía requerida para romper estos enlaces es la suma de la energía de enlace del enlace H—H (436 kJ/mol) y el enlace Cl—Cl (243 kJ/mol). Durante la reacción, se forman dos moles de enlaces H—Cl (energía de enlace = 432 kJ/mol), liberando 2 × 432 kJ; o 864 kJ. Debido a que los enlaces en los productos son más fuertes que los de los reactivos, la reacción libera más energía de la que consume:
\ [\ begin {align*}
ΔH&=\ sum\ mathrm {D_ {bonos\: rotos}} −\ sum\ mathrm {D_ {bonos\: formados}}\\ [4pt]
&=\ mathrm {[D_ {H−H} +D_ {Cl−Cl}] −2D_ {H−Cl}}\\ [4pt]
&=\ mathrm {[436+243] −2 (432) =−185\ :kJ}
\ final {alinear*}\ nonumber\]
Este exceso de energía se libera como calor, por lo que la reacción es exotérmica. El Cuadro T2 da un valor para la entalpía molar estándar de formación de HCl (g)\(ΔH^\circ_\ce f\), de —92.307 kJ/mol. El doble de ese valor es —184.6 kJ, lo que concuerda bien con la respuesta obtenida antes para la formación de dos moles de HCl.
El metanol, CH 3 OH, puede ser un excelente combustible alternativo. La reacción a alta temperatura de vapor y carbono produce una mezcla de los gases monóxido de carbono, CO e hidrógeno, H 2, a partir de los cuales se puede producir metanol. Usando las energías de enlace en la Tabla\(\PageIndex{2}\), calcule el cambio aproximado de entalpía, Δ H, para la reacción aquí:
\[CO_{(g)}+2H2_{(g)}⟶CH_3OH_{(g)} \nonumber \]
Solución
Primero, necesitamos escribir las estructuras de Lewis de los reactivos y los productos:
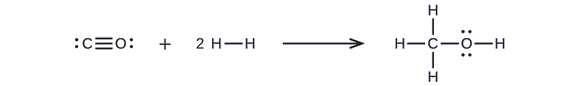
A partir de esto, vemos que Δ H para esta reacción implica la energía requerida para romper un triple enlace C—O y dos enlaces sencillos H-H, así como la energía producida por la formación de tres enlaces simples C—H, un enlace sencillo C—O y un enlace sencillo O-H. Podemos expresar esto de la siguiente manera (a través de la Ecuación\ ref {EQ3}):
\ [\ begin {align*}
ΔH&=\ suma D_ {bonos\: rotos} −\ suma D_ {bonos\: formados}\\
ΔH&=\ mathrm {[D_ {C=O} +2 (D_ {H−H})] − [3 (D_ {C−H}) +D_ {C−O} +D_ {O−H}]} fin
\ {alinear*}\ nonumber\]
Usando los valores de energía de enlace en la Tabla\(\PageIndex{2}\), obtenemos:
\ [\ begin {alinear*}
ΔH&= [1080+2 (436)] − [3 (415) +350+464]\\
&=\ ce {−107\ :kJ}
\ end {align*}\ nonumber\]
Podemos comparar este valor con el valor calculado en base a\(ΔH^\circ_\ce f\) los datos del Apéndice G:
\ [\ begin {alinear*}
ΔH&= [ΔH^\ circ_ {\ ce f}\ ce {CH3OH} (g)] − [ΔH^\ circ_ {\ ce f}\ ce {CO} (g) +2×ΔH^\ circ_ {\ ce f}\ ce {H2}]\\
&= [−201.0] − [−110.52+2×2×0]\\
&=\ mathrm {−90.5\ :kJ}
\ end {align*}\ nonumber\]
Tenga en cuenta que existe una brecha bastante significativa entre los valores calculados usando los dos métodos diferentes. Esto ocurre porque los valores D son el promedio de diferentes fuerzas de unión; por lo tanto, a menudo solo dan un acuerdo aproximado con otros datos.
El alcohol etílico, CH 3 CH 2 OH, fue uno de los primeros químicos orgánicos sintetizados deliberadamente por humanos. Tiene muchos usos en la industria, y es el alcohol contenido en las bebidas alcohólicas. Se puede obtener por la fermentación de azúcar o sintetizarse por la hidratación de etileno en la siguiente reacción:

Utilizando las energías de enlace en la Tabla\(\PageIndex{2}\), calcular un cambio aproximado de entalpía, Δ H, para esta reacción.
- Responder
-
—35 kJ
Fuerza de enlace iónico y energía de celosía
Un compuesto iónico es estable debido a la atracción electrostática entre sus iones positivos y negativos. La energía reticular de un compuesto es una medida de la fuerza de esta atracción. La energía reticular (\(ΔH_{lattice}\)) de un compuesto iónico se define como la energía requerida para separar un mol del sólido en sus iones gaseosos componentes. Para el sólido iónico MX, la energía reticular es el cambio de entalpía del proceso:
\[MX_{(s)}⟶Mn^+_{(g)}+X^{n−}_{(g)} \;\;\;\;\; ΔH_{lattice} \label{EQ6} \]
Tenga en cuenta que estamos usando la convención donde el sólido iónico se separa en iones, por lo que nuestras energías reticulares serán endotérmicas (valores positivos). Algunos textos utilizan la convención equivalente pero opuesta, definiendo la energía reticular como la energía liberada cuando los iones separados se combinan para formar una red y dar valores negativos (exotérmicos). Así, si estás buscando energías de celosía en otra referencia, ten la certeza de verificar qué definición se está utilizando. En ambos casos, una magnitud mayor para la energía reticular indica un compuesto iónico más estable. Para el cloruro de sodio, Δ H reticulado = 769 kJ. Por lo tanto, se requieren 769 kJ para separar un mol de NaCl sólido en iones Na + y Cl — gaseosos. Cuando un mol de cada uno de los iones Na + y Cl — gaseosos forman NaCl sólido, se liberan 769 kJ de calor.
La energía reticular\(ΔH_{lattice}\) de un cristal iónico puede expresarse mediante la siguiente ecuación (derivada de la ley de Coulomb, que rige las fuerzas entre cargas eléctricas):
\[ΔH_{lattice}=\dfrac{C(Z^+)(Z^−)}{R_o} \label{EQ7} \]
en el que
- \(\ce{C}\)es una constante que depende del tipo de estructura cristalina;
- \(Z^+\)y\(Z^–\) son las cargas sobre los iones; y
- \(R_o\)es la distancia interiónica (la suma de los radios de los iones positivo y negativo).
Así, la energía reticular de un cristal iónico aumenta rápidamente a medida que las cargas de los iones aumentan y los tamaños de los iones disminuyen. Cuando todos los demás parámetros se mantienen constantes, duplicar la carga tanto del catión como del anión cuadruplica la energía de la red. Por ejemplo, la energía reticular de LiF (Z + y Z — = 1) es 1023 kJ/mol, mientras que la de MgO (Z + y Z — = 2) es 3900 kJ/mol (R o es casi lo mismo, aproximadamente 200pm para ambos compuestos).
Distintas distancias interatómicas producen diferentes energías de celosía. Por ejemplo, podemos comparar la energía reticular de MgF 2 (2957 kJ/mol) con la de MgI 2 (2327 kJ/mol) para observar el efecto sobre la energía reticular del tamaño iónico más pequeño de F —en comparación con I —.
La gema preciosa rubí es óxido de aluminio, Al 2 O 3, que contiene trazas de Cr 3 +. El compuesto Al 2 Se 3 se utiliza en la fabricación de algunos dispositivos semiconductores. ¿Cuál tiene la energía de celosía más grande, Al 2 O 3 o Al 2 Se 3?
Solución
En estos dos compuestos iónicos, las cargas Z + y Z —son las mismas, por lo que la diferencia en la energía de la red dependerá principalmente de R o. El ion O 2— es más pequeño que el ion Se 2 —. Así, Al 2 O 3 tendría una distancia interiónica más corta que Al 2 Se 3, y Al 2 O 3 tendría la mayor energía de celosía.
El óxido de zinc, ZnO, es un protector solar muy efectivo. ¿Cómo se compararía la energía reticular del ZnO con la del NaCl?
- Responder
-
ZnO tendría la mayor energía reticular porque los valores Z tanto del catión como del anión en ZnO son mayores, y la distancia interiónica de ZnO es menor que la de NaCl.
El Ciclo Nacido-Haber
No es posible medir las energías de celosía directamente. Sin embargo, la energía reticular se puede calcular usando la ecuación dada en la sección anterior o usando un ciclo termoquímico. El ciclo Born-Haber es una aplicación de la ley de Hess que descompone la formación de un sólido iónico en una serie de etapas individuales:
- \(ΔH^\circ_\ce f\), la entalpía estándar de formación del compuesto
- IE, la energía de ionización del metal
- EA, la afinidad electrónica del no metal
- \(ΔH^\circ_s\), la entalpía de sublimación del metal
- D, la energía de disociación del enlace del no metal
- ΔH celosía, la energía de celosía del compuesto
La\(\PageIndex{1}\) figura representa el ciclo de Born-Haber para la formación de fluoruro de cesio sólido.
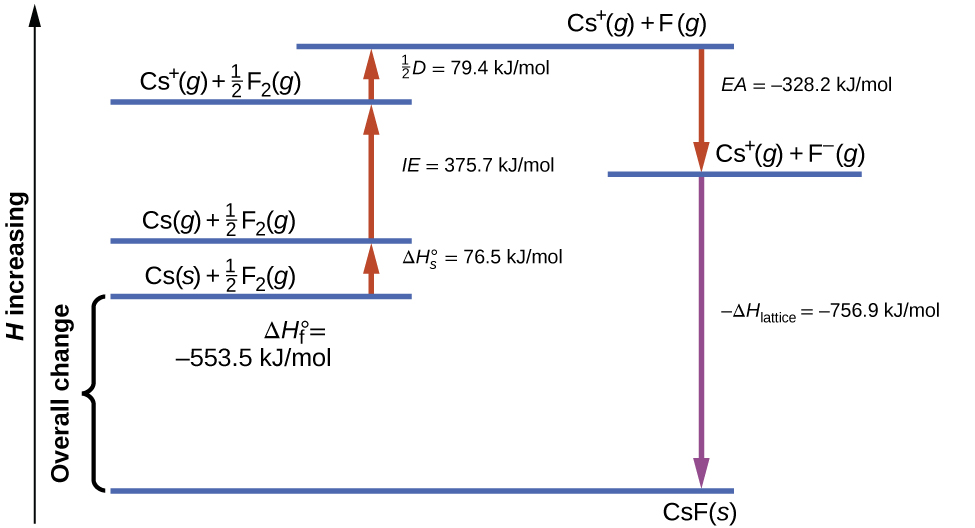
Comenzamos con los elementos en sus estados más comunes, Cs (s) y F 2 (g). El\(ΔH^\circ_\ce s\) representa la conversión de cesio sólido en un gas, y luego la energía de ionización convierte los átomos de cesio gaseoso en cationes. En el siguiente paso, se da cuenta de la energía requerida para romper el enlace F-F para producir átomos de flúor. Convertir un mol de átomos de flúor en iones fluoruro es un proceso exotérmico, por lo que esta etapa emite energía (la afinidad electrónica) y se muestra como decreciente a lo largo del eje y. Ahora tenemos un mol de cationes Cs y un mol de aniones F. Estos iones se combinan para producir fluoruro de cesio sólido. El cambio de entalpía en este paso es el negativo de la energía reticular, por lo que también es una cantidad exotérmica. La energía total involucrada en esta conversión es igual a la entalpía de formación determinada experimentalmente,\(ΔH^\circ_\ce f\), del compuesto a partir de sus elementos. En este caso, el cambio general es exotérmico.
La ley de Hess también se puede utilizar para mostrar la relación entre las entalpías de los pasos individuales y la entalpía de formación. \(\PageIndex{3}\)El cuadro muestra esto para fluoruro de cesio, CsF.
| Entalpía de sublimación de Cs (s) | \(\ce{Cs}(s)⟶\ce{Cs}(g)\hspace{20px}ΔH=ΔH^\circ_s=\mathrm{77\:kJ/mol}\) |
|---|---|
| La mitad de la energía de enlace de F 2 | \(\dfrac{1}{2}\ce{F2}(g)⟶\ce{F}(g)\hspace{20px}ΔH=\dfrac{1}{2}D=\mathrm{79\:kJ/mol}\) |
| Energía de ionización de Cs (g) | \(\ce{Cs}(g)⟶\ce{Cs+}(g)+\ce{e-}\hspace{20px}ΔH=IE=\ce{376\:kJ/mol}\) |
| Negativo de la afinidad electrónica de F | \(\ce{F}(g)+\ce{e-}⟶\ce{F-}(g)\hspace{20px}ΔH=−EA=\ce{-328\:kJ/mol}\) |
| Negativo de la energía reticular de CsF (s) | \(\ce{Cs+}(g)+\ce{F-}(g)⟶\ce{CsF}(s)\hspace{20px}ΔH=−ΔH_\ce{lattice}=\:?\) |
| Entalpía de formación de CsF (s), añadir los pasos 1—5 |
\(ΔH=ΔH^\circ_f=ΔH^\circ_s+\dfrac{1}{2}D+IE+(−EA)+(−ΔH_\ce{lattice})\) \(\ce{Cs}(s)+\dfrac{1}{2}\ce{F2}(g)⟶\ce{CsF}(s)=\ce{-554\:kJ/mol}\) |
Así, la energía de la red se puede calcular a partir de otros valores. Para el cloruro de cesio, utilizando estos datos, la energía reticular es:
\[ΔH_\ce{lattice}=\mathrm{(411+109+122+496+368)\:kJ=770\:kJ} \nonumber \]
El ciclo Nacido-Haber también se puede utilizar para calcular cualquiera de las otras cantidades en la ecuación para la energía de celosía, siempre que se conozca el resto. Por ejemplo, si se conoce la entalpía relevante de sublimación\(ΔH^\circ_s\), energía de ionización (IE), entalpía de disociación de enlace (D), energía reticular Δ H retícula y entalpía estándar de formación,\(ΔH^\circ_\ce f\) se puede utilizar el ciclo Born-Haber para determinar el electrón afinidad de un átomo.
Las energías de red calculadas para los compuestos iónicos son típicamente mucho mayores que las energías de disociación de enlaces medidas para los enlaces covalentes. Mientras que las energías de la red normalmente caen en el rango de 600—4000 kJ/mol (algunas incluso mayores), las energías de disociación de enlaces covalentes están típicamente entre 150—400 kJ/mol para los enlaces simples. Tenga en cuenta, sin embargo, que estos no son valores directamente comparables. Para los compuestos iónicos, las energías reticulares están asociadas con muchas interacciones, ya que los cationes y aniones se agrupan en una red extendida. Para los enlaces covalentes, la energía de disociación del enlace se asocia con la interacción de solo dos átomos.
Resumen
La fuerza de un enlace covalente se mide por su energía de disociación del enlace, es decir, la cantidad de energía requerida para romper ese enlace particular en un mol de moléculas. Los enlaces múltiples son más fuertes que los enlaces simples entre los mismos átomos. La entalpía de una reacción se puede estimar con base en el aporte de energía requerido para romper enlaces y la energía liberada cuando se forman nuevos enlaces. Para los enlaces iónicos, la energía reticular es la energía requerida para separar un mol de un compuesto en sus iones en fase gaseosa. La energía de celosía aumenta para iones con cargas más altas y distancias más cortas entre iones. Las energías de celosía a menudo se calculan utilizando el ciclo Born-Haber, un ciclo termoquímico que incluye todas las etapas energéticas involucradas en la conversión de elementos en un compuesto iónico.
Ecuaciones Clave
- Energía de enlace para una molécula diatómica:\(\ce{XY}(g)⟶\ce{X}(g)+\ce{Y}(g)\hspace{20px}\ce{D_{X–Y}}=ΔH°\)
- Cambio de entalpía: Δ H = D enlaces rotos — D enlaces formados
- Energía de celosía para un MX sólido:\(\ce{MX}(s)⟶\ce M^{n+}(g)+\ce X^{n−}(g)\hspace{20px}ΔH_\ce{lattice}\)
- Energía reticular para un cristal iónico:\(ΔH_\ce{lattice}=\mathrm{\dfrac{C(Z^+)(Z^-)}{R_o}}\)
Notas al pie
- Esta pregunta es tomada del Examen de Colocación Avanzada de Química y se utiliza con el permiso del Servicio de Pruebas Educativas.
Glosario
- energía de bonos
- (también, energía de disociación de enlaces) energía requerida para romper un enlace covalente en una sustancia gaseosa
- Ciclo Nacido-Haber
- ciclo termoquímico que relaciona las diversas etapas energéticas involucradas en la formación de un sólido iónico a partir de los elementos relevantes
- energía de celosía (celosía Δ H)
- energía requerida para separar un mol de un sólido iónico en sus iones gaseosos componentes


