7.4: Cargos Formales y Resonancia
- Page ID
- 75621
- Calcular cargas formales para átomos en cualquier estructura de Lewis
- Usar cargas formales para identificar la estructura de Lewis más razonable para una molécula dada
- Explicar el concepto de resonancia y dibujar estructuras de Lewis que representan formas de resonancia para una molécula dada
Anteriormente, discutimos cómo escribir estructuras de Lewis para moléculas e iones poliatómicos. En algunos casos, sin embargo, aparentemente hay más de una estructura válida para una molécula. Podemos usar el concepto de cargos formales para ayudarnos a predecir la estructura de Lewis más apropiada cuando más de una es razonable.
Cálculo de cargo formal
La carga formal de un átomo en una molécula es la carga hipotética que tendría el átomo si pudiéramos redistribuir los electrones en los enlaces de manera uniforme entre los átomos. Otra forma de decir esto es que la carga formal resulta cuando tomamos el número de electrones de valencia de un átomo neutro, restamos los electrones no enlazantes, y luego restamos el número de enlaces conectados a ese átomo en la estructura de Lewis.
Así, calculamos el cargo formal de la siguiente manera:
\[\textrm{formal charge = # valence shell electrons (free atom) − # lone pair electrons − }\dfrac{1}{2}\textrm{ # bonding electrons} \nonumber \]
Podemos verificar los cálculos de cargos formales determinando la suma de los cargos formales para toda la estructura. La suma de las cargas formales de todos los átomos en una molécula debe ser cero; la suma de las cargas formales en un ion debe ser igual a la carga del ion.
Debemos recordar que la carga formal calculada para un átomo no es la carga real del átomo en la molécula. El cargo formal es sólo un procedimiento útil de contabilidad; no indica la presencia de cargos reales.
Asignar cargas formales a cada átomo en el ion interhalógeno\(\ce{ICl4-}\).
S olución
Dividimos los pares de electrones de enlace por igual para todos los\(\ce{I–Cl}\) enlaces:
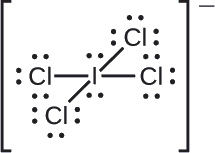
Asignamos pares solitarios de electrones a sus átomos. Cada átomo de Cl tiene ahora siete electrones asignados a él, y el átomo I tiene ocho.
Restar este número del número de electrones de valencia para el átomo neutro:
- I: 7 — 8 = —1
- Cl: 7 — 7 = 0
La suma de las cargas formales de todos los átomos es igual a —1, que es idéntica a la carga del ion (—1).
Calcular la carga formal para cada átomo en la molécula de monóxido de carbono:

- Contestar
-
C −1, O +1
Asignar cargas formales a cada átomo en la molécula interhalógena\(\ce{BrCl3}\).
Solución
Asigne uno de los electrones en cada enlace Br-Cl al átomo de Br y uno al átomo de Cl en ese enlace:
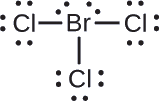
Asignar los pares solitarios a su átomo. Ahora cada átomo de Cl tiene siete electrones y el átomo Br tiene siete electrones.
Restar este número del número de electrones de valencia para el átomo neutro. Esto le da al cargo formal:
- Br: 7 — 7 = 0
- Cl: 7 — 7 = 0
Todos los átomos en\(\ce{BrCl3}\) tienen una carga formal de cero, y la suma de las cargas formales totaliza cero, como debe ser en una molécula neutra.
Determinar la carga formal para cada átomo en\(\ce{NCl3}\).
- Contestar
-
N: 0; los tres átomos de Cl: 0
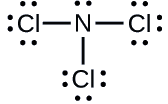
Uso de la carga formal para predecir la estructura molecular
La disposición de los átomos en una molécula o ion se llama su estructura molecular. En muchos casos, seguir los pasos para escribir las estructuras de Lewis puede conducir a más de una posible estructura molecular: diferentes enlaces múltiples y ubicaciones de electrones de pares solidos o diferentes disposiciones de átomos, por ejemplo. Algunas pautas que involucran carga formal pueden ser útiles para decidir cuál de las posibles estructuras es más probable para una molécula o ion en particular.
- Una estructura molecular en la que todas las cargas formales son cero es preferible a aquella en la que algunas cargas formales no son cero.
- Si la estructura de Lewis debe tener cargos formales distintos de cero, es preferible el arreglo con los cargos formales más pequeños distintos de cero.
- Las estructuras de Lewis son preferibles cuando las cargas formales adyacentes son cero o del signo opuesto.
- Cuando debemos elegir entre varias estructuras de Lewis con distribuciones similares de cargas formales, es preferible la estructura con las cargas formales negativas sobre los átomos más electronegativos.
Para ver cómo se aplican estos lineamientos, consideremos algunas posibles estructuras para el dióxido de carbono,\(\ce{CO2}\). Sabemos por nuestra discusión anterior que el átomo menos electronegativo suele ocupar la posición central, pero las cargas formales nos permiten entender por qué ocurre esto. Podemos dibujar tres posibilidades para la estructura: carbono en el centro y dobles enlaces, carbono en el centro con un enlace simple y triple, y oxígeno en el centro con dobles enlaces:
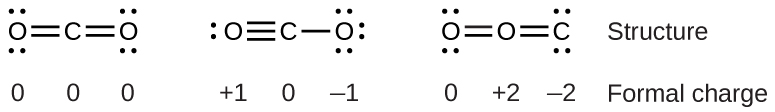
Comparando los tres cargos formales, podemos identificar definitivamente la estructura de la izquierda como preferible porque solo tiene cargos formales de cero (Directriz 1).
Como otro ejemplo, el ion tiocianato, un ion formado a partir de un átomo de carbono, un átomo de nitrógeno y un átomo de azufre, podría tener tres estructuras moleculares diferentes:\(\ce{CNS^{–}}\),\(\ce{NCS^{–}}\), o\(\ce{CSN^{–}}\). Las cargas formales presentes en cada una de estas estructuras moleculares pueden ayudarnos a elegir la disposición más probable de los átomos. Las posibles estructuras de Lewis y las cargas formales para cada una de las tres estructuras posibles para el ion tiocianato se muestran aquí:
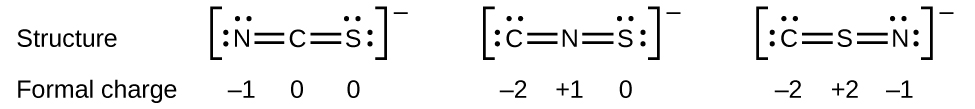
Obsérvese que la suma de las cargas formales en cada caso es igual a la carga del ion (—1). Sin embargo, se prefiere la primera disposición de átomos porque tiene el menor número de átomos con cargas formales distintas de cero (Directriz 2). Además, coloca el átomo menos electronegativo en el centro, y la carga negativa en el elemento más electronegativo (Directriz 4).
El óxido nitroso, N 2 O, comúnmente conocido como gas de la risa, se utiliza como anestésico en cirugías menores, como la extracción rutinaria de muelas del juicio. ¿Cuál es la estructura probable para el óxido nitroso?

Solución Determinar el cargo formal arroja lo siguiente:
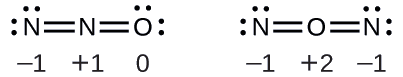
La estructura con un átomo de oxígeno terminal satisface mejor los criterios para la distribución más estable de la carga formal:
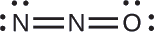
Se minimiza el número de átomos con cargas formales (Directriz 2), y no hay carga formal mayor que uno (Directriz 2). Esto vuelve a ser consistente con la preferencia por tener el átomo menos electronegativo en la posición central.
¿Cuál es la estructura molecular más probable para el ion nitrito (\(\ce{NO2-}\))?
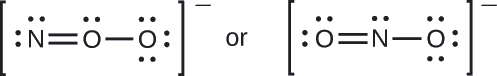
- Contestar
-
\(\ce{ONO^{–}}\)
Resonancia
Habrás notado que el anión nitrito en el Ejemplo\(\PageIndex{3}\) puede tener dos estructuras posibles con los átomos en las mismas posiciones. Los electrones involucrados en el doble enlace N-O, sin embargo, están en diferentes posiciones:
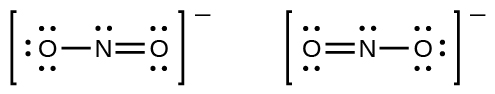
Si los iones nitrito realmente contienen un enlace simple y uno doble, esperaríamos que las dos longitudes de enlace fueran diferentes. Un doble enlace entre dos átomos es más corto (y más fuerte) que un enlace sencillo entre los mismos dos átomos. Los experimentos muestran, sin embargo, que ambos enlaces N-O\(\ce{NO2-}\) tienen la misma fuerza y longitud, y son idénticos en todas las demás propiedades.
No es posible escribir una sola estructura de Lewis para la que\(\ce{NO2-}\) el nitrógeno tenga un octeto y ambos enlaces sean equivalentes. En cambio, utilizamos el concepto de resonancia: si se pueden escribir dos o más estructuras de Lewis con la misma disposición de átomos para una molécula o ion, la distribución real de los electrones es un promedio de la que muestran las diversas estructuras de Lewis. La distribución real de electrones en cada uno de los enlaces nitrógeno-oxígeno en\(\ce{NO2-}\) es el promedio de un doble enlace y un enlace simple. Llamamos a las estructuras de Lewis individuales formas de resonancia. La estructura electrónica real de la molécula (el promedio de las formas de resonancia) se denomina híbrido de resonancia de las formas de resonancia individuales. Una flecha de doble punta entre las estructuras de Lewis indica que son formas de resonancia. Así, la estructura electrónica del\(\ce{NO2-}\) ion se muestra como:
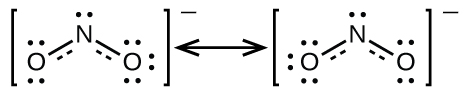
Debemos recordar que una molécula descrita como un híbrido de resonancia nunca posee una estructura electrónica descrita por ninguna de las dos formas de resonancia. No fluctúa entre formas de resonancia; más bien, la estructura electrónica real es siempre el promedio de la que muestran todas las formas de resonancia. George Wheland, uno de los pioneros de la teoría de la resonancia, utilizó una analogía histórica para describir la relación entre las formas de resonancia y los híbridos de resonancia. Un viajero medieval, nunca antes visto un rinoceronte, lo describió como un híbrido de un dragón y un unicornio porque tenía muchas propiedades en común con ambos. Así como un rinoceronte no es ni dragón a veces ni unicornio en otras ocasiones, un híbrido de resonancia no es ni de sus formas de resonancia en un momento dado. Al igual que un rinoceronte, es una entidad real que la evidencia experimental ha demostrado existir. Tiene algunas características en común con sus formas de resonancia, pero las formas de resonancia en sí mismas son imágenes convenientes, imaginarias (como el unicornio y el dragón).
El anión carbonato\(\ce{CO3^2-}\),, proporciona un segundo ejemplo de resonancia:
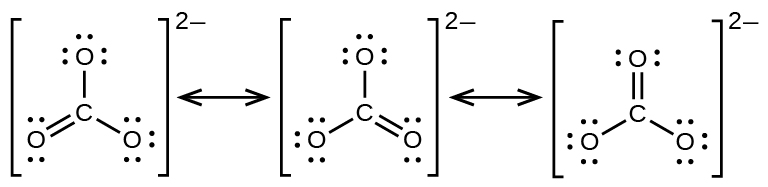
Un átomo de oxígeno debe tener un doble enlace al carbono para completar el octeto en el átomo central. Todos los átomos de oxígeno, sin embargo, son equivalentes, y el doble enlace podría formarse a partir de cualquiera de los tres átomos. Esto da lugar a tres formas de resonancia del ion carbonato. Debido a que podemos escribir tres estructuras de resonancia idénticas, sabemos que la disposición real de los electrones en el ion carbonato es el promedio de las tres estructuras. Nuevamente, los experimentos muestran que los tres enlaces C-O son exactamente iguales.
Resumen
En una estructura de Lewis, se pueden asignar cargas formales a cada átomo tratando cada enlace como si la mitad de los electrones estuvieran asignados a cada átomo. Estos hipotéticos cargos formales son una guía para determinar la estructura de Lewis más apropiada. Se prefiere una estructura en la que los cargos formales sean lo más cercanos posible a cero. La resonancia ocurre en los casos en que se pueden escribir dos o más estructuras de Lewis con disposiciones idénticas de átomos pero diferentes distribuciones de electrones. La distribución real de electrones (el híbrido de resonancia) es un promedio de la distribución indicada por las estructuras individuales de Lewis (las formas de resonancia).
Ecuaciones Clave
- \(\textrm{formal charge = # valence shell electrons (free atom) − # one pair electrons − }\dfrac{1}{2}\textrm{ # bonding electrons}\)
Glosario
- cargo formal
- carga que resultaría en un átomo tomando el número de electrones de valencia en el átomo neutro y restando los electrones no enlazantes y el número de enlaces (la mitad de los electrones de enlace)
- estructura molecular
- disposición de átomos en una molécula o ion
- resonancia
- situación en la que una estructura de Lewis es insuficiente para describir la unión en una molécula y se observa el promedio de múltiples estructuras
- formas de resonancia
- dos o más estructuras de Lewis que tienen la misma disposición de átomos pero diferentes disposiciones de electrones
- híbrido de resonancia
- promedio de las formas de resonancia mostradas por las estructuras individuales de Lewis


