10.4: Diagramas de fases
- Page ID
- 75247
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)- Explicar la construcción y uso de un diagrama de fases típico
- Utilice diagramas de fases para identificar fases estables a temperaturas y presiones dadas, y para describir las transiciones de fase resultantes de los cambios en estas propiedades
- Describir la fase fluida supercrítica de la materia
En el módulo anterior se describió la variación de la presión de vapor de equilibrio de un líquido con la temperatura. Considerando la definición de punto de ebullición, las gráficas de presión de vapor versus temperatura representan cómo varía el punto de ebullición del líquido con la presión. También se describió el uso de curvas de calentamiento y enfriamiento para determinar el punto de fusión (o congelación) de una sustancia. Al realizar tales mediciones en un amplio rango de presiones, se obtienen datos que pueden presentarse gráficamente como un diagrama de fases. Un diagrama de fases combina gráficas de presión versus temperatura para los equilibrios de transición de fase líquido-gas, sólido-líquido y sólido-gas de una sustancia. Estos diagramas indican los estados físicos que existen bajo condiciones específicas de presión y temperatura, y también proporcionan la dependencia de presión de las temperaturas de transición de fase (puntos de fusión, puntos de sublimación, puntos de ebullición). Un diagrama de fases típico para una sustancia pura se muestra en la Figura\(\PageIndex{1}\).
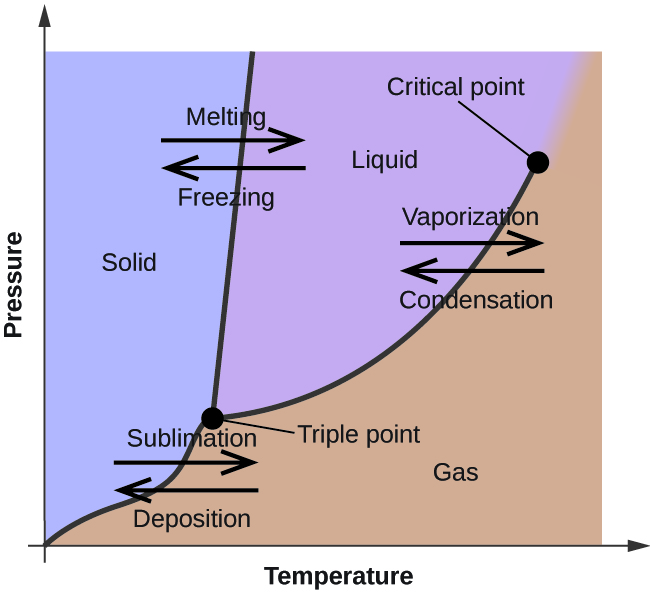
Para ilustrar la utilidad de estas parcelas, considere el diagrama de fases para el agua que se muestra en la Figura\(\PageIndex{2}\).

Podemos utilizar el diagrama de fases para identificar el estado físico de una muestra de agua bajo condiciones específicas de presión y temperatura. Por ejemplo, una presión de 50 kPa y una temperatura de −10 °C corresponden a la región del diagrama etiquetada como “hielo”. Bajo estas condiciones, el agua existe sólo como un sólido (hielo). Una presión de 50 kPa y una temperatura de 50 °C corresponden a la región del “agua”; aquí, el agua existe solo como líquido. A 25 kPa y 200 °C, el agua solo existe en estado gaseoso. Obsérvese que en el diagrama de fases H 2 O, los ejes de presión y temperatura no se dibujan a una escala constante para permitir la ilustración de varias características importantes como se describe aquí.
La curva BC en la Figura\(\PageIndex{2}\) es la gráfica de presión de vapor versus temperatura como se describe en el módulo anterior de este capítulo. Esta curva de “líquido-vapor” separa las regiones líquida y gaseosa del diagrama de fases y proporciona el punto de ebullición para el agua a cualquier presión. Por ejemplo, a 1 atm, el punto de ebullición es de 100 °C. Observe que la curva líquido-vapor termina a una temperatura de 374 °C y una presión de 218 atm, lo que indica que el agua no puede existir como líquido por encima de esta temperatura, independientemente de la presión. Las propiedades físicas del agua en estas condiciones son intermedias entre las de sus fases líquida y gaseosa. Este estado único de la materia se denomina fluido supercrítico, tema que se describirá en la siguiente sección de este módulo.
La curva sólido-vapor, etiquetada AB en la Figura\(\PageIndex{2}\), indica las temperaturas y presiones a las que el hielo y el vapor de agua están en equilibrio. Estos pares de datos de temperatura-presión corresponden a los puntos de sublimación, o deposición, para el agua. Si pudiéramos hacer zoom en la línea de sólido-gas en la Figura\(\PageIndex{2}\), veríamos que el hielo tiene una presión de vapor de aproximadamente 0.20 kPa a −10 °C, así, si colocamos una muestra congelada al vacío con una presión menor a 0.20 kPa, el hielo se sublimará. Esta es la base del proceso de “liofilización” que a menudo se utiliza para conservar alimentos, como el helado que se muestra en la Figura\(\PageIndex{3}\).

La curva sólido-líquido marcada BD muestra las temperaturas y presiones a las que el hielo y el agua líquida están en equilibrio, representando los puntos de fusión/congelación para el agua. Tenga en cuenta que esta curva presenta una ligera pendiente negativa (muy exagerada para mayor claridad), lo que indica que el punto de fusión para el agua disminuye ligeramente a medida que aumenta la presión. El agua es una sustancia inusual en este sentido, ya que la mayoría de las sustancias presentan un aumento en el punto de fusión al aumentar la presión. Este comportamiento es en parte responsable del movimiento de los glaciares, como el que se muestra en la Figura\(\PageIndex{4}\). El fondo de un glaciar experimenta una inmensa presión debido a su peso que puede derretir parte del hielo, formando una capa de agua líquida sobre la que el glaciar puede deslizarse más fácilmente.

El punto de intersección de las tres curvas está etiquetado como B en la Figura\(\PageIndex{2}\). A la presión y temperatura representadas por este punto, las tres fases del agua coexisten en equilibrio. Este par de datos de temperatura-presión se llama el punto triple. A presiones inferiores al punto triple, el agua no puede existir como líquido, independientemente de la temperatura.
Utilizando el diagrama de fases para el agua dado en la Figura 10.4.2, determinar el estado del agua a las siguientes temperaturas y presiones:
- −10 °C y 50 kPa
- 25 °C y 90 kPa
- 50 °C y 40 kPa
- 80 °C y 5 kPa
- −10 °C y 0.3 kPa
- 50 °C y 0.3 kPa
Solución
Utilizando el diagrama de fases para el agua, podemos determinar que el estado del agua a cada temperatura y presión dada es el siguiente: (a) sólido; (b) líquido; (c) líquido; (d) gas; (e) sólido; (f) gas.
¿Qué cambios de fase puede sufrir el agua a medida que cambia la temperatura si la presión se mantiene en 0.3 kPa? Si la presión se mantiene en 50 kPa?
- Contestar
-
A 0.3 kPa: s⟶ g a −58 °C. A 50 kPa: s⟶ l a 0 °C, l ⟶ g a 78 °C
Considera el diagrama de fases para el dióxido de carbono mostrado en la Figura\(\PageIndex{5}\) como otro ejemplo. La curva sólido-líquido presenta una pendiente positiva, lo que indica que el punto de fusión para CO 2 aumenta con la presión como lo hace para la mayoría de las sustancias (siendo el agua una notable excepción como se describió anteriormente). Observe que el punto triple está muy por encima de 1 atm, lo que indica que el dióxido de carbono no puede existir como líquido bajo condiciones de presión ambiente. En cambio, enfriar el dióxido de carbono gaseoso a 1 atm da como resultado su deposición en estado sólido. Asimismo, el dióxido de carbono sólido no se funde a una presión de 1 atm, sino que se sublima para producir CO 2 gaseoso. Finalmente, observe que el punto crítico para el dióxido de carbono se observa a una temperatura y presión relativamente modestas en comparación con el agua.
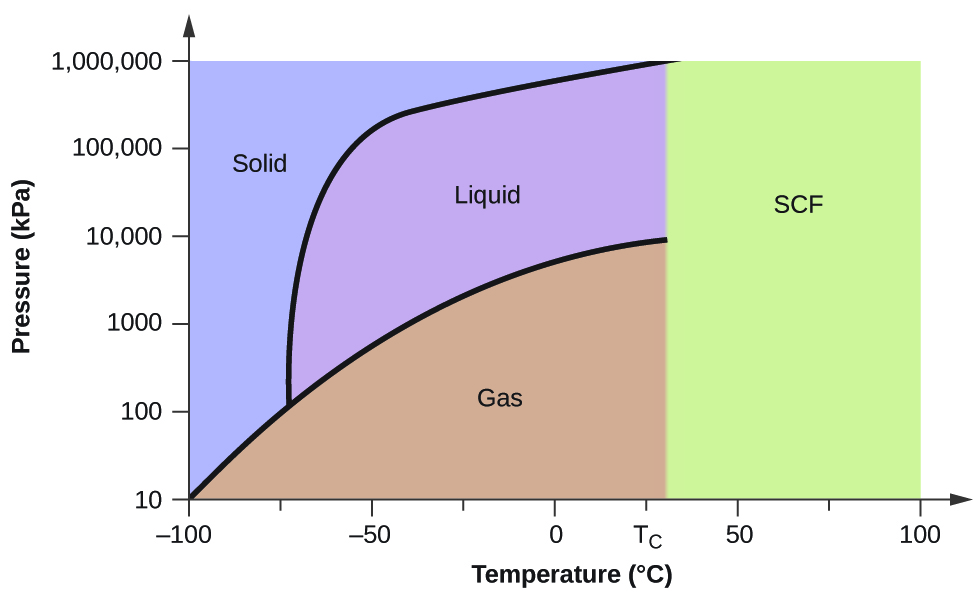
Utilizando el diagrama de fases para el dióxido de carbono que se muestra en la Figura 10.4.5, se determina el estado del CO 2 a las siguientes temperaturas y presiones:
- −30 °C y 2000 kPa
- −60 °C y 1000 kPa
- −60 °C y 100 kPa
- 20 °C y 1500 kPa
- 0 °C y 100 kPa
- 20 °C y 100 kPa
Solución
Utilizando el diagrama de fases para el dióxido de carbono proporcionado, podemos determinar que el estado de CO 2 a cada temperatura y presión dadas son los siguientes: (a) líquido; (b) sólido; (c) gas; (d) líquido; (e) gas; (f) gas.
Determinar los cambios de fase que experimenta el dióxido de carbono cuando se varía su temperatura, manteniendo así su presión constante a 1500 kPa? ¿A 500 kPa? ¿A qué temperaturas aproximadas ocurren estos cambios de fase?
- Contestar
-
a 1500 kPa: s⟶ l a −45 °C, l⟶ g a −10 °C; a 500 kPa: s⟶ g a −58 °C
Fluidos Supercríticos
Si colocamos una muestra de agua en un recipiente sellado a 25 °C, retiramos el aire y dejamos que el equilibrio de vaporización-condensación se establezca, nos queda una mezcla de agua líquida y vapor de agua a una presión de 0.03 atm. Se observa claramente un límite distinto entre el líquido más denso y el gas menos denso. A medida que aumentamos la temperatura, la presión del vapor de agua aumenta, como lo describe la curva líquido-gas en el diagrama de fases para el agua (Figura\(\PageIndex{2}\)), y se mantiene un equilibrio bifásico de las fases líquida y gaseosa. A una temperatura de 374 °C, la presión de vapor ha aumentado a 218 atm, y cualquier aumento adicional en la temperatura da como resultado la desaparición del límite entre las fases líquida y vapor. Toda el agua en el recipiente está ahora presente en una sola fase cuyas propiedades físicas son intermedias entre las de los estados gaseoso y líquido. Esta fase de la materia se denomina fluido supercrítico, y la temperatura y presión por encima de la cual existe esta fase es el punto crítico (Figura\(\PageIndex{5}\)). Por encima de su temperatura crítica, un gas no se puede licuar sin importar cuánta presión se aplique. La presión requerida para licuar un gas a su temperatura crítica se llama presión crítica. Las temperaturas críticas y presiones críticas de algunas sustancias comunes se dan en la Tabla\(\PageIndex{1}\).
| Sustancia | Temperatura crítica (K) | Presión Crítica (atm) |
|---|---|---|
| hidrógeno | 33.2 | 12.8 |
| nitrógeno | 126.0 | 33.5 |
| oxígeno | 154.3 | 49.7 |
| dióxido de carbono | 304.2 | 73.0 |
| amoníaco | 405.5 | 111.5 |
| dióxido de azufre | 430.3 | 77.7 |
| agua | 647.1 | 217.7 |
Al igual que un gas, un fluido supercrítico se expandirá y llenará un contenedor, pero su densidad es mucho mayor que las densidades típicas de gas, siendo típicamente cercanas a las de los líquidos. Al igual que los líquidos, estos fluidos son capaces de disolver solutos no volátiles. No presentan esencialmente tensión superficial y viscosidades muy bajas, sin embargo, por lo que pueden penetrar más eficazmente aberturas muy pequeñas en una mezcla sólida y eliminar los componentes solubles. Estas propiedades hacen que los fluidos supercríticos sean solventes extremadamente útiles para una amplia gama de aplicaciones. Por ejemplo, el dióxido de carbono supercrítico se ha convertido en un solvente muy popular en la industria alimentaria, siendo utilizado para descafeinar café, eliminar grasas de las papas fritas y extraer compuestos de sabor y fragancia de aceites cítricos. No es tóxico, relativamente económico y no se considera contaminante. Después de su uso, el CO 2 se puede recuperar fácilmente reduciendo la presión y recogiendo el gas resultante.
Si agitamos un extintor de dióxido de carbono en un día fresco (18 °C), podemos escuchar CO 2 líquido chapoteando alrededor del interior del cilindro. Sin embargo, el mismo cilindro parece no contener líquido en un caluroso día de verano (35 °C). Explique estas observaciones.
Solución
En el día frío, la temperatura del CO 2 está por debajo de la temperatura crítica de CO 2, 304 K o 31 °C (Tabla\(\PageIndex{1}\)), por lo que el CO 2 líquido está presente en el cilindro. En el día caluroso, la temperatura del CO 2 es mayor que su temperatura crítica de 31 °C Por encima de esta temperatura ninguna cantidad de presión puede licuar CO 2 por lo que no existe CO 2 líquido en el extintor.
El amoníaco se puede licuar por compresión a temperatura ambiente; el oxígeno no se puede licuar bajo estas condiciones. ¿Por qué los dos gases presentan un comportamiento diferente?
- Contestar
-
La temperatura crítica del amoníaco es 405.5 K, la cual es superior a la temperatura ambiente. La temperatura crítica del oxígeno está por debajo de la temperatura ambiente; por lo tanto, el oxígeno no se puede licuar a temperatura ambiente.
Descafeinar café usando CO 2 supercrítico
El café es el segundo producto más comercializado del mundo, siguiendo únicamente al petróleo. En todo el mundo, a la gente le encanta el aroma y el sabor del café. Muchos de nosotros también dependemos de un componente del café, la cafeína, para ayudarnos a ponernos en marcha por la mañana o mantenernos alerta por la tarde. Pero al final del día, el efecto estimulante del café puede evitar que duermas, por lo que puede optar por tomar café descafeinado por la noche.
Desde principios del siglo XX, se han utilizado muchos métodos para descafeinar el café. Todos tienen ventajas e inconvenientes, y todos dependen de las propiedades físicas y químicas de la cafeína. Debido a que la cafeína es una molécula algo polar, se disuelve bien en agua, un líquido polar. Sin embargo, dado que muchos de los otros más de 400 compuestos que contribuyen al sabor y aroma del café también se disuelven en H 2 O, los procesos de descafeinación con agua caliente también pueden eliminar algunos de estos compuestos, afectando negativamente el olor y sabor del café descafeinado. El diclorometano (CH 2 Cl 2) y el acetato de etilo (CH 3 CO 2 C 2 H 5) tienen polaridad similar a la cafeína, y por lo tanto son solventes muy efectivos para la extracción de cafeína, pero ambos también eliminan algunos componentes de sabor y aroma, y su uso requiere largos tiempos de extracción y limpieza. Debido a que ambos solventes son tóxicos, se han planteado preocupaciones de salud con respecto al efecto del solvente residual que permanece en el café descafeinado.
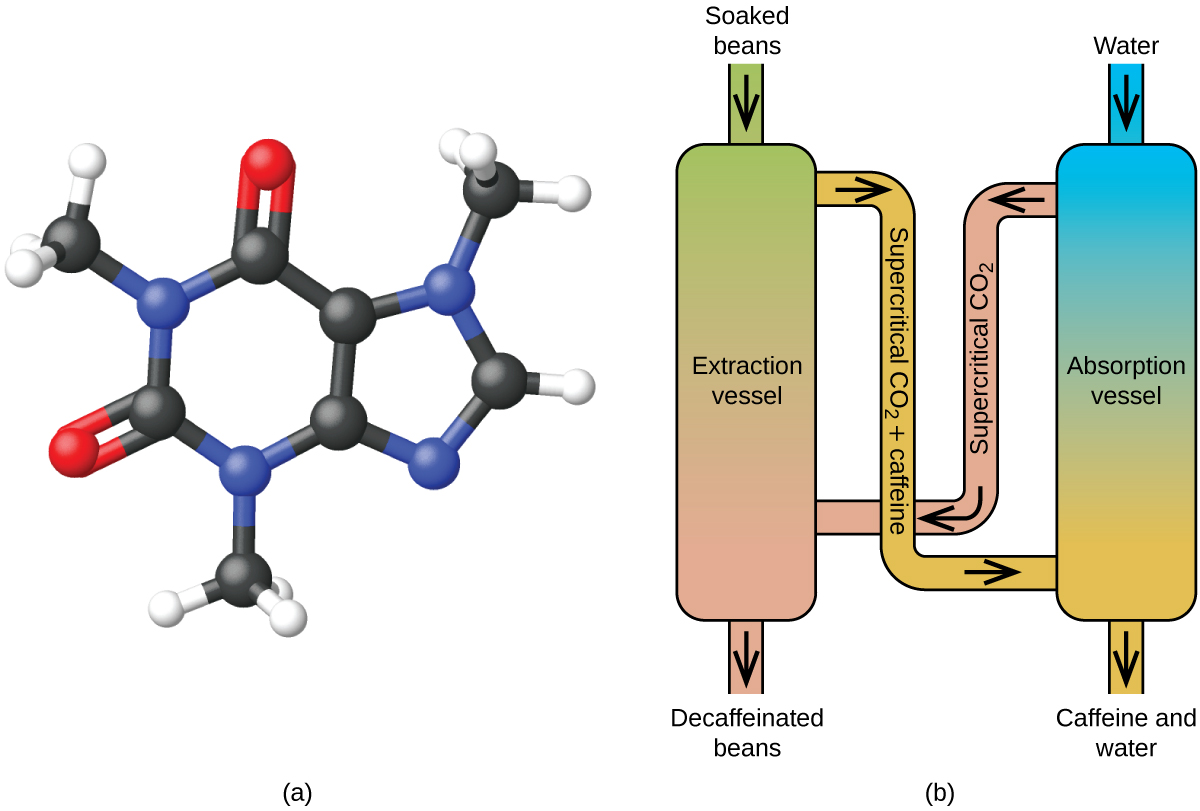
La extracción de fluidos supercríticos utilizando dióxido de carbono está siendo ampliamente utilizada como un método de descafeinación más efectivo y respetuoso con el medio ambiente (Figura\(\PageIndex{7}\)). A temperaturas superiores a 304.2 K y presiones superiores a 7376 kPa, el CO 2 es un fluido supercrítico, con propiedades tanto de gas como de líquido. Como un gas, penetra profundamente en los granos de café; como un líquido, disuelve efectivamente ciertas sustancias. La extracción de dióxido de carbono supercrítico de granos de café al vapor elimina 97− 99% de la cafeína, dejando intactos los compuestos de sabor y aroma del café. Debido a que el CO 2 es un gas en condiciones estándar, su eliminación de los granos de café extraídos se logra fácilmente, al igual que la recuperación de la cafeína del extracto. La cafeína recuperada de los granos de café a través de este proceso es un producto valioso que puede ser utilizado posteriormente como aditivo para otros alimentos o medicamentos.
Resumen
Las condiciones de temperatura y presión en las que existe una sustancia en estado sólido, líquido y gaseoso se resumen en un diagrama de fases para esa sustancia. Los diagramas de fase son gráficos combinados de tres curvas de equilibrio presión-temperatura: sólido-líquido, líquido-gas y sólido-gas. Estas curvas representan las relaciones entre las temperaturas de transición de fase y las presiones. El punto de intersección de las tres curvas representa el punto triple de la sustancia: la temperatura y la presión en las que las tres fases están en equilibrio. A presiones por debajo del punto triple, una sustancia no puede existir en estado líquido, independientemente de su temperatura. El término de la curva líquido-gas representa el punto crítico de la sustancia, la presión y temperatura por encima de la cual no puede existir una fase líquida.
Glosario
- punto crítico
- temperatura y presión por encima de la cual un gas no se puede condensar en un líquido
- diagrama de fases
- gráfico presión-temperatura que resume las condiciones bajo las cuales pueden existir las fases de una sustancia
- fluido supercrítico
- sustancia a una temperatura y presión superiores a su punto crítico; exhibe propiedades intermedias entre las de estado gaseoso y líquido
- punto triple
- temperatura y presión a la que las fases de vapor, líquido y sólido de una sustancia están en equilibrio


