11.1: El Proceso de Disolución
- Page ID
- 75357
- Describir las propiedades básicas de las soluciones y cómo se forman.
- Predecir si una mezcla dada dará lugar a una solución basada en las propiedades moleculares de sus componentes.
- Explique por qué algunas soluciones producen o absorben calor cuando se forman.
Un capítulo anterior de este texto introdujo soluciones, definidas como mezclas homogéneas de dos o más sustancias. A menudo, un componente de una solución está presente a una concentración significativamente mayor, en cuyo caso se llama el disolvente. Los otros componentes de la solución presentes en concentraciones relativamente menores se denominan solutos. El azúcar es un sólido covalente compuesto por moléculas de sacarosa,\(\ce{C12H22O11}\). Cuando este compuesto se disuelve en agua, sus moléculas se distribuyen uniformemente entre las moléculas de agua:
\[\ce{C12H22O11 (s) ⟶ C12H22O11 (aq) } \label{Eq1} \]
El subíndice “ac” en la ecuación significa que las moléculas de sacarosa son solutos y por lo tanto se dispersan individualmente por toda la solución acuosa (el agua es el disolvente). Aunque las moléculas de sacarosa son más pesadas que las moléculas de agua, permanecen dispersas por toda la solución; la gravedad no hace que se “asienten” con el tiempo.
Dicromato de potasio,\(\ce{K_2Cr_2O_7}\), es un compuesto iónico compuesto por iones de potasio incoloros\(\mathrm{K^+}\),, e iones dicromato naranja,\(\ce{Cr_2O_7^{2−}}\). Cuando se agrega una pequeña cantidad de dicromato de potasio sólido al agua, el compuesto se disuelve y se disocia para producir iones potasio e iones dicromato distribuidos uniformemente por toda la mezcla (Figura\(\PageIndex{1}\)), como se indica en esta ecuación:
\[\ce{K2Cr2O7(s) ⟶ 2K^{+} (aq) + Cr2O7^{2-} (aq)} \label{Eq2} \]
Al igual que con la mezcla de azúcar y agua, esta mezcla también es una solución acuosa. Sus solutos, iones potasio y dicromato, permanecen dispersos individualmente entre las moléculas de disolvente (agua).

El agua se usa tan a menudo como solvente que la palabra solución ha llegado a implicar una solución acuosa a muchas personas. Sin embargo, casi cualquier gas, líquido o sólido puede actuar como solvente. Muchas aleaciones son soluciones sólidas de un metal disuelto en otro; por ejemplo, las monedas estadounidenses de cinco centavos contienen níquel disuelto en cobre. El aire es una solución gaseosa, una mezcla homogénea de nitrógeno, oxígeno y varios otros gases. El oxígeno (un gas), el alcohol (un líquido) y el azúcar (un sólido) se disuelven en agua (un líquido) para formar soluciones líquidas. La tabla\(\PageIndex{1}\) da ejemplos de varias soluciones diferentes y las fases de los solutos y disolventes.
| Solución | Soluto | Solvente |
|---|---|---|
| aire | O 2 (g) | N 2 (g) |
| Refrescos | CO 2 (g) | H 2 O (l) |
| hidrógeno en paladio | H 2 (g) | Pd (s) |
| alcohol | H 2 O (l) | C 3 H 8 O (l) (2-propanol) |
| agua salada | NaCl (s) | H 2 O (l) |
| latón | Zn (s) | Cu (s) |
Las soluciones exhiben estos rasgos definitorios:
- Son homogéneos; es decir, después de mezclar una solución, tiene la misma composición en todos los puntos (su composición es uniforme).
- El estado físico de una solución —sólida, líquida o gaseosa— es típicamente el mismo que el del disolvente, como lo demuestran los ejemplos en la Tabla\(\PageIndex{1}\).
- Los componentes de una solución se dispersan a escala molecular; es decir, consisten en una mezcla de moléculas separadas, átomos y/o iones.
- El soluto disuelto en una solución no se asentará ni se separará del disolvente.
- La composición de una solución, o las concentraciones de sus componentes, se pueden variar continuamente, dentro de límites.
La formación de soluciones
La formación de una solución es un ejemplo de un proceso espontáneo, un proceso que ocurre bajo condiciones específicas sin necesidad de energía de alguna fuente externa. A veces agitamos una mezcla para acelerar el proceso de disolución, pero esto no es necesario; se formaría una solución homogénea si esperáramos lo suficiente. El tema de la espontaneidad es de vital importancia para el estudio de la termodinámica química y se trata más a fondo en un capítulo posterior de este texto. Para efectos de la discusión de este capítulo, bastará considerar dos criterios que favorecen, pero no garantizan, la formación espontánea de una solución:
- una disminución en la energía interna del sistema (un cambio exotérmico, como se discutió en el capítulo anterior sobre termoquímica)
- un incremento en el trastorno en el sistema (lo que indica un incremento en la entropía del sistema, como conocerás en el capítulo posterior sobre termodinámica)
En el proceso de disolución, un cambio de energía interna a menudo, pero no siempre, ocurre a medida que el calor es absorbido o evolucionado. Siempre se produce un aumento en el trastorno cuando se forma una solución.
Cuando las fuerzas de atracción intermoleculares entre las especies de soluto y disolvente en una solución no son diferentes de las presentes en los componentes separados, la solución se forma sin cambio de energía acompañante. Tal solución se llama una solución ideal. Una mezcla de gases ideales (o gases como el helio y el argón, que se acercan estrechamente al comportamiento ideal) es un ejemplo de una solución ideal, ya que las entidades que comprenden estos gases no experimentan atractivos intermoleculares significativos.
Cuando se conectan contenedores de helio y argón, los gases se mezclan espontáneamente debido a la difusión y forman una solución (Figura\(\PageIndex{2}\)). La formación de esta solución implica claramente un aumento del desorden, ya que los átomos de helio y argón ocupan un volumen dos veces más grande que el que ocupaba cada uno antes de la mezcla.
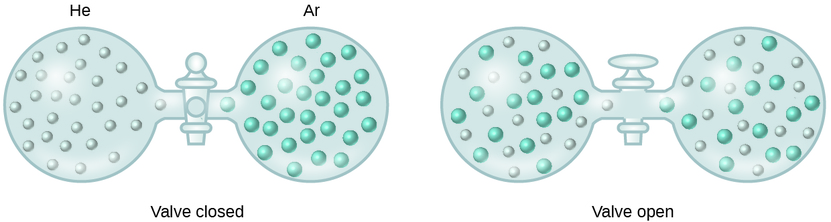
También se pueden formar soluciones ideales cuando se mezclan líquidos estructuralmente similares. Por ejemplo, las mezclas de los alcoholes metanol (CH 3 OH) y etanol (C 2 H 5 OH) forman soluciones ideales, al igual que las mezclas de los hidrocarburos pentano,\(\ce{C5H12}\), y hexano,\(\ce{C6H14}\). Colocar metanol y etanol, o pentano y hexano, en los bulbos mostrados en la Figura\(\PageIndex{2}\) dará como resultado la misma difusión y posterior mezcla de estos líquidos que se observa para los gases He y Ar (aunque a una velocidad mucho más lenta), produciendo soluciones sin cambio significativo en la energía. Sin embargo, a diferencia de una mezcla de gases, los componentes de estas soluciones líquido-líquido experimentan fuerzas atractivas intermoleculares. Pero dado que las moléculas de las dos sustancias que se mezclan son estructuralmente muy similares, las fuerzas de atracción intermoleculares entre moléculas similares y diferentes son esencialmente las mismas, y el proceso de disolución, por lo tanto, no implica ningún aumento o disminución apreciable de la energía. Estos ejemplos ilustran cómo la difusión por sí sola puede proporcionar la fuerza impulsora requerida para provocar la formación espontánea de una solución. En algunos casos, sin embargo, las magnitudes relativas de las fuerzas intermoleculares de atracción entre las especies de soluto y disolvente pueden impedir la disolución.
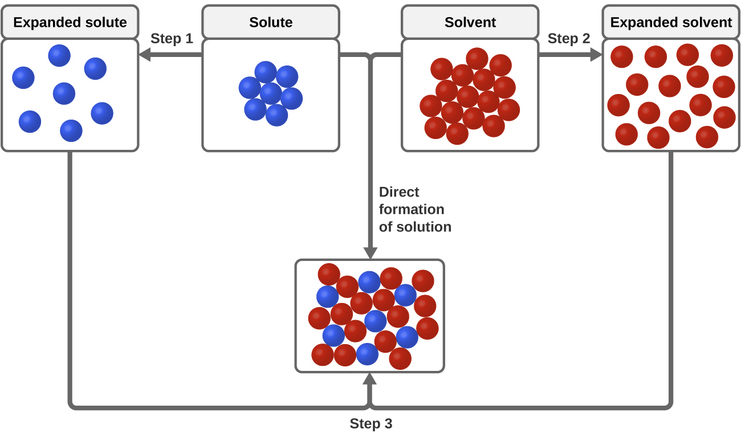
Tres tipos de fuerzas de atracción intermoleculares son relevantes para el proceso de disolución: soluto-soluto, disolvente-disolvente y soluto-disolvente. Como se ilustra en la Figura\(\PageIndex{3}\), la formación de una solución puede verse como un proceso paso a paso en el que se consume energía para superar las atracciones soluto-soluto y disolvente-disolvente (procesos endotérmicos) y se libera cuando se establecen las atracciones soluto-disolvente (un proceso exotérmico denominado como solvatación). Las magnitudes relativas de los cambios de energía asociados con estos procesos paso a paso determinan si el proceso de disolución en general liberará o absorberá energía. En algunos casos, las soluciones no se forman porque la energía requerida para separar las especies de soluto y disolvente es mucho mayor que la energía liberada por la solvatación.

Por ejemplo, los aceites de cocina y el agua no se mezclarán en ningún grado apreciable para producir soluciones (Figura\(\PageIndex{4}\)). Los enlaces de hidrógeno son la fuerza de atracción intermolecular dominante presente en el agua líquida; las moléculas de hidrocarburos no polares de los aceites de cocina no son capaces de formar enlaces de hidrógeno, sino que se mantienen unidas por fuerzas de dispersión. La formación de una solución aceite-agua requeriría superar el enlace de hidrógeno muy fuerte en el agua, así como las fuerzas de dispersión significativamente fuertes entre las moléculas de aceite relativamente grandes. Y, dado que las moléculas polares de agua y las moléculas de aceite no polares no experimentarían una atracción intermolecular muy fuerte, se liberaría muy poca energía por solvatación.
Por otro lado, una mezcla de etanol y agua se mezclará en cualquier proporción para dar una solución. En este caso, ambas sustancias son capaces de formar enlaces de hidrógeno, por lo que el proceso de solvatación es suficientemente exotérmico para compensar las separaciones endotérmicas de las moléculas de soluto y disolvente.

Como se señaló al inicio de este módulo, la formación espontánea de solución se ve favorecida, pero no garantizada, por los procesos de disolución exotérmica. Si bien muchos compuestos solubles, de hecho, se disuelven con la liberación de calor, algunos se disuelven endotérmicamente. El nitrato de amonio (NH 4 NO 3) es uno de esos ejemplos y se utiliza para hacer compresas frías instantáneas para tratar lesiones como la que se muestra en la Figura\(\PageIndex{5}\). Una bolsa de agua de pared delgada se sella dentro de una bolsa más grande con NH 4 NO 3 sólido. Cuando se rompe la bolsa más pequeña, se forma una solución de NH 4 NO 3, absorbiendo el calor del entorno (la zona lesionada a la que se aplica el paquete) y proporcionando una compresa fría que disminuye la hinchazón. Las disoluciones endotérmicas como esta requieren un mayor aporte de energía para separar las especies de solutos que se recupera cuando los solutos están solvatados, pero son espontáneas, no obstante, debido al aumento del trastorno que acompaña a la formación de la solución.
Video\(\PageIndex{1}\): Vea este breve video que ilustra los procesos de disolución endotérmica y exotérmica.
Resumen
Se forma una solución cuando dos o más sustancias se combinan físicamente para producir una mezcla que es homogénea a nivel molecular. El disolvente es el componente más concentrado y determina el estado físico de la solución. Los solutos son los otros componentes típicamente presentes en concentraciones menores que las del disolvente. Las soluciones pueden formarse endotérmica o exotérmicamente, dependiendo de las magnitudes relativas de las fuerzas de atracción intermoleculares de soluto y disolvente. Las soluciones ideales se forman sin cambios apreciables en la energía.
Notas al pie
- Si se observan burbujas de gas dentro del líquido, la mezcla no es homogénea y, por lo tanto, no es una solución.
Glosario
- aleación
- mezcla sólida de un elemento metálico y uno o más elementos adicionales
- solución ideal
- solución que se forma sin cambio de energía acompañante
- solvatación
- proceso exotérmico en el que se establecen las fuerzas de atracción intermoleculares entre el soluto y el disolvente en una solución
- proceso espontáneo
- cambio físico o químico que ocurre sin la adición de energía de una fuente externa


