13.1: Equilibrios Químicos
- Page ID
- 75752
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)- Describir la naturaleza de los sistemas de equilibrio
- Explicar la naturaleza dinámica de un equilibrio químico
Una reacción química suele escribirse de una manera que sugiere que procede en una dirección, la dirección en la que leemos, pero todas las reacciones químicas son reversibles, y tanto la reacción directa como la inversa ocurren en un grado u otro dependiendo de las condiciones. En un equilibrio químico, las reacciones directa e inversa ocurren a tasas iguales, y las concentraciones de productos y reactivos permanecen constantes. Si ejecutamos una reacción en un sistema cerrado para que los productos no puedan escapar, a menudo encontramos que la reacción no da un rendimiento del 100% de productos. En cambio, algunos reactivos permanecen después de que las concentraciones dejan de cambiar. En este punto, cuando no hay más cambios en las concentraciones de reactivos y productos, decimos que la reacción está en equilibrio. Una mezcla de reactivos y productos se encuentra en equilibrio.
Por ejemplo, cuando colocamos una muestra de tetroxido de dinitrógeno (\(N_2O_4\), un gas incoloro) en un tubo de vidrio, forma dióxido de nitrógeno (\(\ce{NO2}\), un gas marrón) por la reacción
\[\ce{ N2O4(g) \rightleftharpoons 2NO2(g)} \label{13.2.1} \]
El color se vuelve más oscuro a medida\(\ce{N2O4}\) que se convierte en\(\ce{NO2}\). Cuando el sistema alcanza el equilibrio, ambos\(\ce{N2O4}\) y\(\ce{NO2}\) están presentes (Figura\(\PageIndex{1}\)).
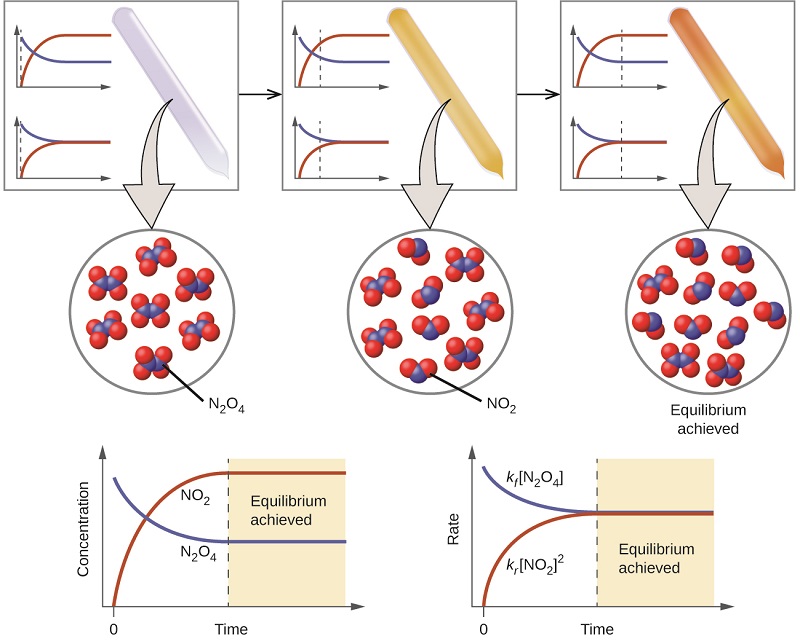
La formación de\(\ce{NO2}\) from\(\ce{N2O4}\) es una reacción reversible, la cual se identifica por la flecha de equilibrio (\(\rightleftharpoons\)). Todas las reacciones son reversibles, pero muchas reacciones, para todos los fines prácticos, proceden en una dirección hasta que los reactivos se agotan y solo se revertirán bajo ciertas condiciones. Tales reacciones a menudo se representan con una flecha unidireccional desde los reactivos hasta los productos. Muchas otras reacciones, como la formación de\(\ce{NO2}\) from\(\ce{N2O4}\), son reversibles bajo condiciones más fácilmente obtenibles y, por lo tanto, se nombran como tales. En una reacción reversible, los reactivos pueden combinarse para formar productos y los productos pueden reaccionar para formar los reactivos. Así, no sólo puede\(\ce{N2O4}\) descomponerse para formar\(\ce{NO2}\), sino que lo\(\ce{NO2}\) producido puede reaccionar para formar\(\ce{N2O4}\). Tan pronto como la reacción directa produce alguna\(\ce{NO2}\), la reacción inversa comienza y\(\ce{NO2}\) comienza a reaccionar para formarse\(\ce{N2O4}\). En equilibrio, las concentraciones de\(\ce{N2O4}\) y ya\(\ce{NO2}\) no cambian debido a que la tasa de formación de\(\ce{NO2}\) es exactamente igual a la tasa de consumo de\(\ce{NO2}\), y la tasa de formación de\(\ce{N2O4}\) es exactamente igual a la tasa de consumo de\(\ce{N2O4}\). El equilibrio químico es un proceso dinámico: Al igual que con los nadadores y los bañistas, los números de cada uno permanecen constantes, sin embargo hay un flujo de ida y vuelta entre ellos (Figura\(\PageIndex{2}\)).

En un equilibrio químico, las reacciones directa e inversa no se detienen, sino que continúan ocurriendo a la misma velocidad, conduciendo a concentraciones constantes de los reactivos y los productos. Las gráficas que muestran cómo cambian las velocidades de reacción y las concentraciones con respecto al tiempo se muestran en la Figura\(\PageIndex{1}\).
Podemos detectar un estado de equilibrio porque las concentraciones de reactivos y productos no parecen cambiar. Sin embargo, es importante que verifiquemos que la ausencia de cambio se debe al equilibrio y no a una velocidad de reacción tan lenta que los cambios en la concentración son difíciles de detectar.
Utilizamos una flecha doble al escribir una ecuación para una reacción reversible. Tal reacción puede o no estar en equilibrio. Por ejemplo, la Figura\(\PageIndex{1}\) muestra la reacción:
\[\ce{N2O4(g) \rightleftharpoons 2NO2(g)} \label{13.2.2} \]
Cuando queremos hablar de un componente particular de una reacción reversible, utilizamos una sola flecha. Por ejemplo, en el equilibrio mostrado en la Figura\(\PageIndex{1}\), la velocidad de la reacción directa
\[\ce{2NO2(g) \rightarrow N2O4(g)} \label{13.2.3} \]
es igual a la velocidad de la reacción hacia atrás
\[\ce{N2O4(g) \rightarrow 2NO2(g)} \label{13.2.4} \]
La conexión entre la química y los refrescos carbonatados se remonta a 1767, cuando Joseph Priestley (1733—1804; más conocido hoy por su papel en el descubrimiento e identificación del oxígeno) descubrió un método de infundir agua con dióxido de carbono para hacer agua carbonatada. En 1772, Priestly publicó un artículo titulado “Impregnando agua con aire fijo”. El artículo describe el goteo de aceite de vitriolo (hoy lo llamamos ácido sulfúrico, pero qué gran manera de describir ácido sulfúrico: “aceite de vitriolo” significa literalmente “maldad líquida”) sobre la tiza (carbonato de calcio). El resultante\(CO_2\) cae en el recipiente de agua debajo del recipiente en el que tiene lugar la reacción inicial; la agitación ayuda a la\(CO_2\) mezcla gaseosa en el agua líquida.
\[\ce{H2SO4(l) + CaCO3(s) \rightarrow CO2(g) + H2O (l) + CaSO4 (aq)} \nonumber \]
El dióxido de carbono es ligeramente soluble en agua. Hay una reacción de equilibrio que se produce a medida que el dióxido de carbono reacciona con el agua para formar ácido carbónico (\(H_2CO_3\)). Dado que el ácido carbónico es un ácido débil, puede disociarse en protones (\(H^+\)) e iones de hidrogenocarbonato (\(HCO_3^−\)).
\[\ce{ CO2 (aq) + H2O(l) \rightleftharpoons H2CO3 (aq) \rightleftharpoons HCO3^{-} (aq) + H^{+} (aq)} \nonumber \]
Hoy en día, se\(\ce{CO_2}\) pueden presurizar en refrescos, estableciendo el equilibrio mostrado anteriormente. Sin embargo, una vez que abres el contenedor de bebidas, se produce una cascada de cambios de equilibrio. Primero, el\(\ce{CO_2}\) gas en el espacio de aire en la parte superior de la botella escapa, provocando que el equilibrio entre fase gaseosa\(\ce{CO_2}\) y disuelto o acuoso\(\ce{CO_2}\) se desplace, disminuyendo la concentración de\(\ce{CO_2}\) en el refresco. Menos\(\ce{CO_2}\) disuelto en el líquido lleva a que el ácido carbónico se descomponga a disuelto\(\ce{CO_2}\) y H 2 O. La disminución de la concentración de ácido carbónico provoca un desplazamiento del equilibrio final. Siempre y cuando el refresco esté en un recipiente abierto, las\(\ce{CO_2}\) burbujas salen de la bebida, liberando el gas al aire (Figura\(\PageIndex{3}\)). Con la tapa de la botella, las\(\ce{CO_2}\) reacciones ya no están en equilibrio y continuarán hasta que no queden más reactivos. Esto da como resultado un refresco con una\(\ce{CO_2}\) concentración muy baja, a menudo referido como “plano”.

Consideremos la evaporación del bromo como un segundo ejemplo de un sistema en equilibrio.
\[\ce{Br2(l) \rightleftharpoons Br2(g)} \nonumber \]
Se puede establecer un equilibrio para un cambio físico, como esta transición de líquido a gas, así como para una reacción química. La figura\(\PageIndex{4}\) muestra una muestra de bromo líquido en equilibrio con vapor de bromo en un recipiente cerrado. Cuando vertimos bromo líquido en una botella vacía en la que no hay vapor de bromo, algo de líquido se evapora, la cantidad de líquido disminuye, y la cantidad de vapor aumenta. Si tapamos la botella para que no se escape vapor, la cantidad de líquido y vapor eventualmente dejará de cambiar y se establecerá un equilibrio entre el líquido y el vapor. Si la botella no estuviera tapada, el vapor de bromo se escaparía y no se alcanzaría ningún equilibrio.

Resumen
Una reacción está en equilibrio cuando las cantidades de reactivos o productos ya no cambian. El equilibrio químico es un proceso dinámico, lo que significa que la velocidad de formación de los productos por la reacción directa es igual a la velocidad a la que los productos vuelven a formar reactivos por la reacción inversa.
Glosario
- equilibrio
- en las reacciones químicas, el estado en el que la conversión de los reactivos en productos y la conversión de los productos de nuevo en reactivos ocurren simultáneamente a la misma velocidad; estado de equilibrio
- reacción reversible
- reacción química que puede proceder tanto en la dirección hacia adelante como hacia atrás en condiciones dadas


