13.2: Constantes de equilibrio
- Page ID
- 75765
- Derivar cocientes de reacción de ecuaciones químicas que representan reacciones homogéneas y heterogéneas
- Calcular valores de cocientes de reacción y constantes de equilibrio, usando concentraciones y presiones
- Relacionar la magnitud de una constante de equilibrio con las propiedades del sistema químico
Ahora que tenemos un símbolo (\(\rightleftharpoons\)) para designar reacciones reversibles, necesitaremos una forma de expresar matemáticamente cómo las cantidades de reactivos y productos afectan el equilibrio del sistema. Una ecuación general para una reacción reversible puede escribirse de la siguiente manera:
\[m\ce{A}+n\ce{B}+ \rightleftharpoons x\ce{C}+y\ce{D} \label{13.3.1} \]
Podemos escribir el cociente de reacción (\(Q\)) para esta ecuación. Cuando se evalúa usando concentraciones, se llama\(Q_c\). Utilizamos corchetes para indicar concentraciones molares de reactivos y productos.
\[ Q_c=\dfrac{[\ce{C}]^x[\ce{D}]^y}{[\ce{A}]^m[\ce{B}]^n} \label{13.3.2} \]
El cociente de reacción es igual a las concentraciones molares de los productos de la ecuación química (multiplicados juntos) sobre los reactivos (también multiplicados juntos), elevándose cada concentración a la potencia del coeficiente de esa sustancia en la ecuación química equilibrada. Por ejemplo, el cociente de reacción para la reacción reversible
\[\ce{2NO}_{2(g)} \rightleftharpoons \ce{N_2O}_{4(g)} \label{13.3.3} \]
viene dada por esta expresión:
\[Q_c=\ce{\dfrac{[N_2O_4]}{[NO_2]^2}} \label{13.3.4} \]
Escriba la expresión del cociente de reacción para cada una de las siguientes reacciones:
- \(\ce{3O}_{2(g)} \rightleftharpoons \ce{2O}_{3(g)}\)
- \(\ce{N}_{2(g)}+\ce{3H}_{2(g)} \rightleftharpoons \ce{2NH}_{3(g)}\)
- \(\ce{4NH}_{3(g)}+\ce{7O}_{2(g)} \rightleftharpoons \ce{4NO}_{2(g)}+\ce{6H_2O}_{(g)}\)
Solución
- \(Q_c=\dfrac{[\ce{O3}]^2}{[\ce{O2}]^3}\)
- \( Q_c=\dfrac{[\ce{NH3}]^2}{\ce{[N2][H2]}^3}\)
- \( Q_c=\dfrac{\ce{[NO2]^4[H2O]^6}}{\ce{[NH3]^4[O2]^7}}\)
Escriba la expresión del cociente de reacción para cada una de las siguientes reacciones:
- \( \ce{2SO2}(g)+\ce{O2}(g) \rightleftharpoons \ce{2SO3}(g)\)
- \( \ce{C4H8}(g) \rightleftharpoons \ce{2C2H4}(g)\)
- \( \ce{2C4H10}(g)+\ce{13O2}(g) \rightleftharpoons \ce{8CO2}(g)+\ce{10H2O}(g)\)
- Responder a
-
\( Q_c=\dfrac{[\ce{SO3}]^2}{\ce{[SO2]^2[O2]}}\)
- Respuesta b
-
\( Q_c=\dfrac{[\ce{C2H4}]^2}{[\ce{C4H8}]}\)
- Respuesta c
-
\( Q_c=\dfrac{\ce{[CO2]^8[H2O]^{10}}}{\ce{[C4H10]^2[O2]^{13}}}\)
El valor numérico de\(Q_c\) para una reacción dada varía; depende de las concentraciones de productos y reactivos presentes en el momento en\(Q_c\) que se determina. Cuando se mezclan reactivos puros,\(Q_c\) es inicialmente cero porque no hay productos presentes en ese punto. A medida que avanza la reacción, el valor de\(Q_c\) aumenta a medida que aumentan las concentraciones de los productos y las concentraciones de los reactivos disminuyen simultáneamente (Figura\(\PageIndex{1}\)). Cuando la reacción alcanza el equilibrio, el valor del cociente de reacción ya no cambia porque las concentraciones ya no cambian.
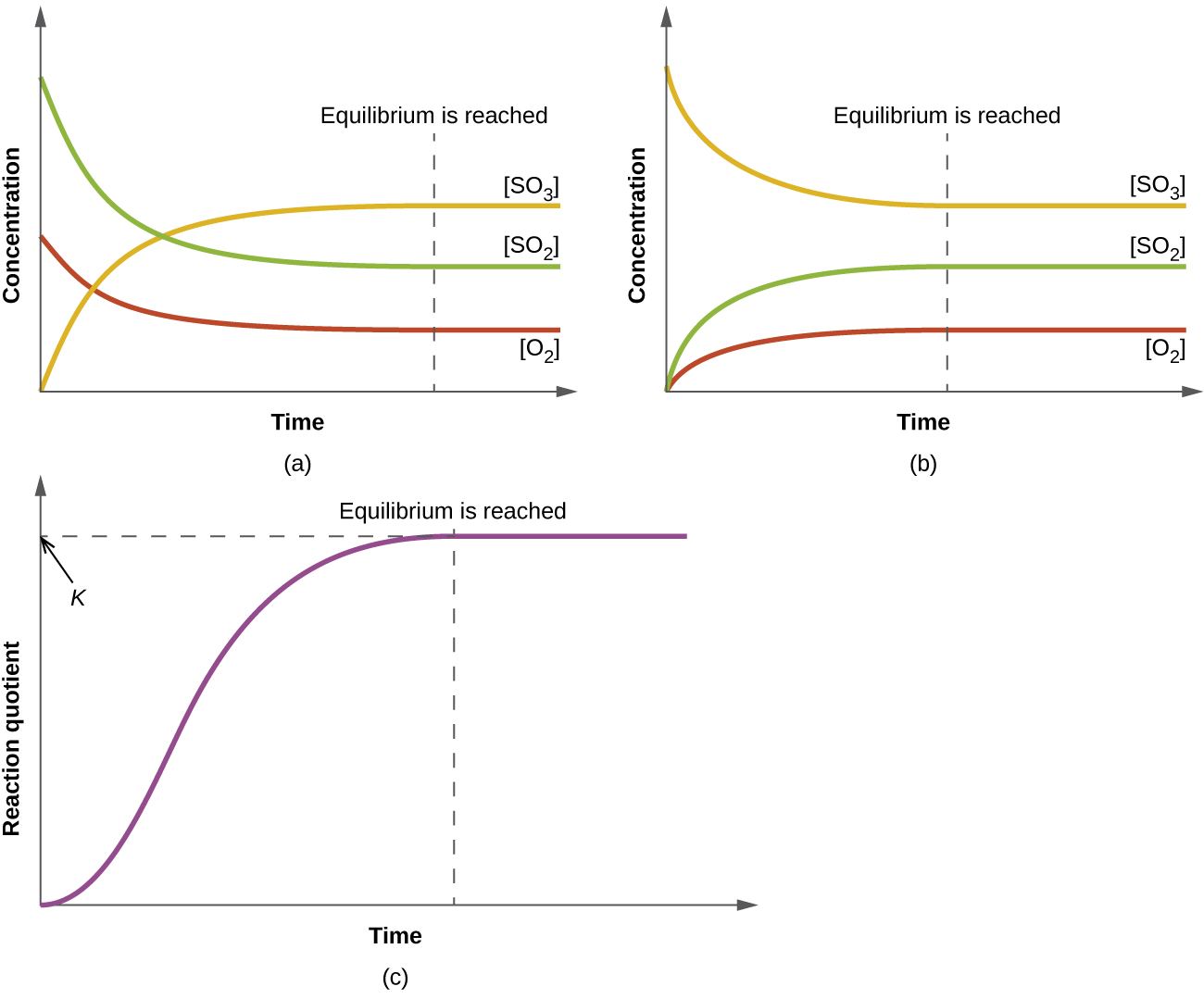
Cuando una mezcla de reactivos y productos de una reacción alcanza el equilibrio a una temperatura dada, su cociente de reacción siempre tiene el mismo valor. Este valor se llama la constante de equilibrio (\(K\)) de la reacción a esa temperatura. En cuanto al cociente de reacción, cuando se evalúa en términos de concentraciones, se anota como\(K_c\).
Que un cociente de reacción siempre asume el mismo valor en equilibrio puede expresarse como:
\[Q_c \textrm{ at equilibrium}=K_c=\dfrac{[\ce C]^x[\ce D]^y...}{[\ce A]^m[\ce B]^n...} \label{13.3.5} \]
Esta ecuación es una declaración matemática de la ley de acción masiva: Cuando una reacción ha alcanzado el equilibrio a una temperatura dada, el cociente de reacción para la reacción siempre tiene el mismo valor.
El dióxido de nitrógeno gaseoso forma tetroóxido de dinitrógeno de acuerdo con esta ecuación:
\[\ce{2NO}_{2(g)} \rightleftharpoons \ce{N_2O}_{4(g)} \nonumber \]
Cuando\(\ce{NO2}\) se agregan 0.10 mol a un matraz de 1.0-L a 25 °C, la concentración cambia de manera que en equilibrio, [NO 2] = 0.016 M y [N 2 O 4] = 0.042 M.
- ¿Cuál es el valor del cociente de reacción antes de que ocurra alguna reacción?
- ¿Cuál es el valor de la constante de equilibrio para la reacción?
Solución
- Antes de que se forme algún producto\(\mathrm{[NO_2]=\dfrac{0.10\:mol}{1.0\:L}}=0.10\:M\),, y [N 2 O 4] = 0 M. Así,\[Q_c=\ce{\dfrac{[N2O4]}{[NO2]^2}}=\dfrac{0}{0.10^2}=0 \nonumber \]
- En equilibrio, el valor de la constante de equilibrio es igual al valor del cociente de reacción. En equilibrio,\[K_c=Q_c=\ce{\dfrac{[N2O4]}{[NO2]^2}}=\dfrac{0.042}{0.016^2}=1.6\times 10^2. \nonumber \]
La constante de equilibrio es 1.6 × 10 2.
Tenga en cuenta que el análisis dimensional sugeriría que la unidad para este\(K_c\) valor debería ser M −1. Sin embargo, es una práctica común omitir unidades para\(K_c\) valores calculados como se describe aquí, ya que es la magnitud de una constante de equilibrio la que transmite información útil. Como se discutirá más adelante en este módulo, el enfoque riguroso para calcular las constantes de equilibrio utiliza cantidades adimensionales derivadas de actividades en lugar de concentraciones molares, por lo que\(K_c\) los valores son verdaderamente inútiles.
Para la reacción
\[\ce{2SO2}(g)+\ce{O2}(g) \rightleftharpoons \ce{2SO3}(g) \nonumber \]
las concentraciones en equilibrio son [SO 2] = 0.90 M, [O 2] = 0.35 M, y [SO 3] = 1.1 M. ¿Cuál es el valor de la constante de equilibrio, K c?
- Responder
-
K c = 4.3
La magnitud de una constante de equilibrio es una medida del rendimiento de una reacción cuando alcanza el equilibrio. Un gran valor para\(K_c\) indica que el equilibrio se alcanza solo después de que los reactivos se hayan convertido en gran medida en productos. Un pequeño valor de\(K_c\) —mucho menor que 1—indica que el equilibrio se alcanza cuando solo una pequeña proporción de los reactivos se han convertido en productos.
Una vez que\(K_c\) se conoce un valor de para una reacción, se puede utilizar para predecir cambios direccionales en comparación con el valor de\(Q_c\). Un sistema que no esté en equilibrio procederá en la dirección que establezca el equilibrio. Los datos de la Figura\(\PageIndex{2}\) ilustran esto. Cuando se calientan a una temperatura constante, 800 °C, diferentes mezclas de partida de\(\ce{CO}\)\(\ce{H_2O}\),\(\ce{CO_2}\), y\(\ce{H_2}\) reaccionan para alcanzar composiciones que se adhieren al mismo equilibrio (el valor de\(Q_c\) los cambios hasta que es igual al valor de K c). Este valor es 0.640, la constante de equilibrio para la reacción bajo estas condiciones.
\[\ce{CO}(g)+\ce{H2O}(g) \rightleftharpoons \ce{CO2}(g)+\ce{H2}(g) \hspace{20px} K_c=0.640 \hspace{20px} \mathrm{T=800°C} \label{13.3.6} \]
Es importante reconocer que se puede establecer un equilibrio a partir de reactivos o de productos, o de una mezcla de ambos. Por ejemplo, el equilibrio se estableció a partir de la Mezcla 2 de la Figura\(\PageIndex{2}\) cuando los productos de la reacción se calentaron en un recipiente cerrado. De hecho, una técnica utilizada para determinar si una reacción está realmente en equilibrio es acercarse al equilibrio comenzando con reactivos en un experimento y comenzando con productos en otro. Si se observa el mismo valor del cociente de reacción cuando las concentraciones dejan de cambiar en ambos experimentos, entonces podemos estar seguros de que el sistema ha alcanzado el equilibrio.
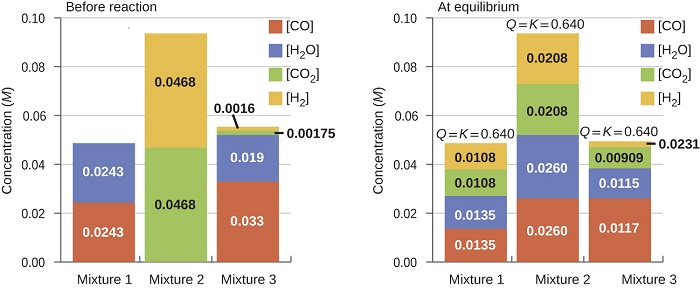
Aquí se dan las concentraciones de partida de reactivos y productos para tres experimentos que involucran esta reacción:
\[\ce{CO}(g)+\ce{H2O}(g) \rightleftharpoons \ce{CO2}(g)+\ce{H2}(g) \nonumber \]
con\(K_c=0.64 \). Determinar en qué dirección procede la reacción a medida que va al equilibrio en cada uno de los tres experimentos mostrados.
| Reactantes/Productos | Experimento 1 | Experimento 2 | Experimento 3 |
|---|---|---|---|
| [CO] i | 0.0203 M | 0.011 M | 0.0094 M |
| [H 2 O] i | 0.0203 M | 0.0011 M | 0.0025 M |
| [CO 2] i | 0.0040 M | 0.037 M | 0.0015 M |
| [H 2] i | 0.0040 M | 0.046 M | 0.0076 M |
Solución
Experimento 1:
\[Q_c=\ce{\dfrac{[CO2][H2]}{[CO][H2O]}}=\dfrac{(0.0040)(0.0040)}{(0.0203)(0.0203)}=0.039. \nonumber \]
Q c <\(K_c\) (0.039 < 0.64)
La reacción se desplazará hacia la derecha.
Experimento 2:
\[Q_c=\ce{\dfrac{[CO2][H2]}{[CO][H2O]}}=\dfrac{(0.037)(0.046)}{(0.011)(0.0011)}=1.4 \times 10^2 \nonumber \]
Q c >\(K_c\) (140 > 0.64)
La reacción se desplazará hacia la izquierda.
Experimento 3:
\[Q_c=\ce{\dfrac{[CO2][H2]}{[CO][H2O]}}=\dfrac{(0.0015)(0.0076)}{(0.0094)(0.0025)}=0.48 \nonumber \]
Q c <\(K_c\) (0.48 < 0.64)
La reacción se desplazará hacia la derecha.
Calcular el cociente de reacción y determinar la dirección en la que cada una de las siguientes reacciones procederá a alcanzar el equilibrio.
a) Un matraz de 1.00 l que contiene 0.0500 mol de NO (g), 0.0155 mol de Cl 2 (g) y 0.500 mol de NOCl:
\[\ce{2NO}(g)+\ce{Cl2}(g)⇌\ce{2NOCl}(g)\hspace{20px}K_c=4.6\times 10^4 \nonumber \]
b) Un matraz de 5.0 l que contiene 17 g de NH 3, 14 g de N 2 y 12 g de H 2:
\[\ce{N2}(g)+\ce{3H2}(g)⇌\ce{2NH3}(g)\hspace{20px}K_c=0.060 \nonumber \]
(c) Un matraz de 2.00-L que contiene 230 g de SO 3 (g):
\[\ce{2SO3}(g)⇌\ce{2SO2}(g)+\ce{O2}(g)\hspace{20px}K_c=0.230 \nonumber \]
- Responder a
-
\(Q_c\)= 6.45 × 10 3, desplaza a la derecha.
- Respuesta b
-
\(Q_c\)= 0.12, desplaza a la izquierda.
- Respuesta c
-
\(Q_c\)= 0, desplaza a la derecha
En Ejemplo\(\PageIndex{2}\), se mencionó que la práctica común es omitir unidades al evaluar cocientes de reacción y constantes de equilibrio. Cabe señalar que el uso de concentraciones en estos cálculos es un enfoque conveniente pero simplificado que a veces conduce a resultados que aparentemente entran en conflicto con la ley de la acción masiva. Por ejemplo, los equilibrios que involucran iones acuosos a menudo exhiben constantes de equilibrio que varían bastante significativamente (no son constantes) a altas concentraciones de solución. Esto se puede evitar calculando\(K_c\) valores utilizando las actividades de los reactivos y productos en el sistema de equilibrio en lugar de sus concentraciones. La actividad de una sustancia es una medida de su concentración efectiva en condiciones especificadas. Si bien una discusión detallada de esta importante cantidad está fuera del alcance de un texto introductorio, es necesario estar al tanto de algunos aspectos importantes:
- Las actividades son cantidades adimensionales (sin unidades) y en esencia son concentraciones “ajustadas”.
- Para soluciones relativamente diluidas, la actividad de un soluto y su concentración molar son aproximadamente iguales.
- Las actividades para las fases condensadas puras (sólidos y líquidos) son iguales a 1.
- Las actividades para solventes en soluciones diluidas son iguales a 1.
Como consecuencia de estos dos últimos aspectos,\(Q_c\) y\(K_c\) las expresiones no contienen términos para sólidos o líquidos o disolventes en soluciones diluidas (siendo numéricamente iguales a 1, estos términos no tienen efecto sobre el valor de la expresión). En esta sección se encontrarán varios ejemplos de equilibrios que producen tales expresiones.
Equilibrios homogéneos
Un equilibrio homogéneo es aquel en el que todos los reactivos y productos están presentes en una sola solución (por definición, una mezcla homogénea). En este capítulo, nos concentraremos en los dos tipos más comunes de equilibrios homogéneos: los que ocurren en soluciones en fase líquida y los que involucran exclusivamente especies gaseosas. Las reacciones entre solutos en soluciones líquidas pertenecen a un tipo de equilibrios homogéneos. Las especies químicas involucradas pueden ser moléculas, iones o una mezcla de ambos. Aquí se proporcionan varios ejemplos:
Ejemplo 1
\[\ce{C2H2}(aq)+\ce{2Br2}(aq) \rightleftharpoons \ce{C2H2Br4}(aq)\hspace{20px} \label{13.3.7a} \]
con constante de equilibrio asociada
\[K_c=\ce{\dfrac{[C2H2Br4]}{[C2H2][Br2]^2}} \label{13.3.7b} \]
Ejemplo 2
\[\ce{I2}(aq)+\ce{I-}(aq) \rightleftharpoons \ce{I3-}(aq) \label{13.3.8b} \]
con constante de equilibrio asociada
\[K_c=\ce{\dfrac{[I3- ]}{[I2][I- ]}} \label{13.3.8c} \]
Ejemplo 3
\[\ce{Hg2^2+}(aq)+\ce{NO3-}(aq)+\ce{3H3O+}(aq) \rightleftharpoons \ce{2Hg^2+}(aq)+\ce{HNO2}(aq)+\ce{4H2O}(l) \label{13.3.9a} \]
con constante de equilibrio asociada
\[K_c=\ce{\dfrac{[Hg^2+]^2[HNO2]}{[Hg2^2+][NO3- ][H3O+]^3}} \label{13.3.9b} \]
Ejemplo 4
\[\ce{HF}(aq)+\ce{H2O}(l) \rightleftharpoons \ce{H3O+}(aq)+\ce{F-}(aq) \label{13.3.10a} \]
con constante de equilibrio asociada
\[K_c=\ce{\dfrac{[H3O+][F- ]}{[HF]}} \label{13.3.10b} \]
Ejemplo 5
\[\ce{NH3}(aq)+\ce{H2O}(l) \rightleftharpoons \ce{NH4+}(aq)+\ce{OH-}(aq) \label{13.3.11a} \]
con constante de equilibrio asociada
\[K_c=\ce{\dfrac{[NH4+][OH- ]}{[NH3]}} \label{13.3.11b} \]
En cada uno de estos ejemplos, el sistema de equilibrio es una solución acuosa, como denotan las anotaciones ac en las fórmulas de soluto. Dado que H 2 O (l) es el disolvente para estas soluciones, se le asigna una actividad de 1, y por lo tanto no aparece explícitamente como término en la\(K_c\) expresión, como se discutió anteriormente, aunque también pueda aparecer como reactivo o producto en la ecuación química.
Las reacciones en las que todos los reactivos y productos son gases representan una segunda clase de equilibrios homogéneos. Usamos concentraciones molares en los siguientes ejemplos, pero veremos en breve que también se pueden usar presiones parciales de los gases:
Ejemplo 1
\[\ce{C2H6}(g) \rightleftharpoons \ce{C2H4}(g)+\ce{H2}(g) \label{13.3.12a} \]
con constante de equilibrio asociada
\[K_c=\ce{\dfrac{[C2H4][H2]}{[C2H6]}} \label{13.3.12b} \]
Ejemplo 2
\[\ce{3O2}(g) \rightleftharpoons \ce{2O3}(g) \label{13.3.13a} \]
con constante de equilibrio asociada
\[K_c=\ce{\dfrac{[O3]^2}{[O2]^3}} \label{13.3.13b} \]
Ejemplo 3
\[\ce{N2}(g)+\ce{3H2}(g) \rightleftharpoons \ce{2NH3}(g) \label{13.3.14a} \]
con constante de equilibrio asociada
\[K_c=\ce{\dfrac{[NH3]^2}{[N2][H2]^3}} \label{13.3.14b} \]
Ejemplo 4
\[\ce{C3H8}(g)+\ce{5O2}(g) \rightleftharpoons \ce{3CO2}(g)+\ce{4H2O}(g)\label{13.3.15a} \]
con constante de equilibrio asociada
\[K_c=\ce{\dfrac{[CO2]^3[H2O]^4}{[C3H8][O2]^5}}\label{13.3.15b} \]
Nótese que la concentración de\(\ce{H_2O}_{(g)}\) ha sido incluida en el último ejemplo debido a que el agua no es el disolvente en esta reacción en fase gaseosa y su concentración (y actividad) cambia.
Siempre que los gases estén involucrados en una reacción, se puede usar la presión parcial de cada gas en lugar de su concentración en la ecuación para el cociente de reacción porque la presión parcial de un gas es directamente proporcional a su concentración a temperatura constante. Esta relación puede derivarse de la ecuación de gas ideal, donde M es la concentración molar de gas,\(\dfrac{n}{V}\).
\[\begin{align} PV&=nRT \label{13.3.16} \\[4pt] P &=\left(\dfrac{n}{V}\right)RT \label{13.3.17} \\[4pt] &=MRT \label{13.3.18} \end{align} \]
Así, a temperatura constante, la presión de un gas es directamente proporcional a su concentración. Usando las presiones parciales de los gases, podemos escribir el cociente de reacción para el sistema
\[\ce{C2H6}(g) \rightleftharpoons \ce{C2H4}(g)+\ce{H2}(g) \label{13.3.19} \]
siguiendo las mismas pautas para derivar expresiones basadas en la concentración:
\[Q_P=\dfrac{P_{\ce{C2H4}}P_{\ce{H2}}}{P_{\ce{C2H6}}} \label{13.3.20} \]
En esta ecuación usamos Q P para indicar un cociente de reacción escrito con presiones parciales:\(P_{\ce{C2H6}}\) es la presión parcial de C 2 H 6;\(P_{\ce{H2}}\), la presión parcial de H 2; y\(P_{\ce{C2H6}}\), la presión parcial de C 2 H 4. En equilibrio:
\[K_P=Q_P=\dfrac{P_{\ce{C2H4}}P_{\ce{H2}}}{P_{\ce{C2H6}}} \label{13.3.21} \]
El subíndice\(P\) en el símbolo\(K_P\) designa una constante de equilibrio derivada usando presiones parciales en lugar de concentraciones. La constante de equilibrio, K P, sigue siendo una constante, pero su valor numérico puede diferir de la constante de equilibrio encontrada para la misma reacción mediante el uso de concentraciones.
La conversión entre un valor para\(K_c\), una constante de equilibrio expresada en términos de concentraciones, y un valor para\(K_P\), una constante de equilibrio expresada en términos de presiones, es directa (un K o Q sin subíndice podría ser concentración o presión).
La ecuación que relaciona\(K_c\) y\(K_P\) se deriva de la siguiente manera. Para la reacción en fase gaseosa:
\[m\ce{A}+n\ce{B} \rightleftharpoons x\ce{C}+y\ce{D} \label{13.3.22} \]
con
\[ \begin{align} K_P &=\dfrac{(P_C)^x(P_D)^y}{(P_A)^m(P_B)^n} \label{13.3.23} \\[4pt] &=\dfrac{([\ce C]×RT)^x([\ce D]×RT)^y}{([\ce A]×RT)^m([\ce B]×RT)^n} \label{13.3.24} \\[4pt] &=\dfrac{[\ce C]^x[\ce D]^y}{[\ce A]^m[\ce B]^n}×\dfrac{(RT)^{x+y}}{(RT)^{m+n}} \label{13.3.25} \\[4pt] &=K_c(RT)^{(x+y)−(m+n)} \label{13.3.26} \\[4pt] &=K_c(RT)^{Δn} \label{13.3.27} \end{align} \]
La relación entre\(K_c\) y\(K_P\) es
\[ \color{red} K_P=K_c(RT)^{Δn} \label{13.3.28} \]
En esta ecuación, Δn es la diferencia entre la suma de los coeficientes de los productos gaseosos y la suma de los coeficientes de los reactivos gaseosos en la reacción (el cambio en moles de gas entre los reactivos y los productos). Para la reacción en fase gaseosa\(m\ce{A}+n\ce{B} \rightleftharpoons x\ce{C}+y\ce{D}\), tenemos
\[Δn=(x+y)−(m+n) \label{13.3.29} \]
Escribe las ecuaciones para la conversión de\(K_c\) a K P para cada una de las siguientes reacciones:
- \(\ce{C2H6}(g) \rightleftharpoons \ce{C2H4}(g)+\ce{H2}(g)\)
- \(\ce{CO}(g)+\ce{H2O}(g) \rightleftharpoons \ce{CO2}(g)+\ce{H2}(g)\)
- \(\ce{N2}(g)+\ce{3H2}(g) \rightleftharpoons \ce{2NH3}(g)\)
- K c es igual a 0.28 para la siguiente reacción a 900 °C:
\[\ce{CS2}(g)+\ce{4H2}(g) \rightleftharpoons \ce{CH4}(g)+\ce{2H2S}(g) \nonumber \]
¿Qué es K P a esta temperatura?
Solución
(a) Δ n = (2) − (1) = 1
K P =\(K_c\) (RT) Δ n =\(K_c\) (RT) 1 =\(K_c\) (RT)
(b) Δ n = (2) − (2) = 0
K P =\(K_c\) (RT) Δ n =\(K_c\) (RT) 0 = K c
(c) Δ n = (2) − (1 + 3) = −2
K P =\(K_c\) (RT) Δ n =\(K_c\) (RT) −2 =\(\dfrac{K_c}{(RT)^2}\)
d) K P =\(K_c\) (RT) Δ n = (0.28) [(0.0821) (1173)] −2 = 3.0 × 10 −5
Escriba las ecuaciones para la conversión de\(K_c\) a K P para cada una de las siguientes reacciones, que ocurren en la fase gaseosa:
- \(\ce{2SO2}(g)+\ce{O2}(g) \rightleftharpoons \ce{2SO3}(g)\)
- \(\ce{N2O4}(g) \rightleftharpoons \ce{2NO2}(g)\)
- \(\ce{C3H8}(g)+\ce{5O2}(g) \rightleftharpoons \ce{3CO2}(g)+\ce{4H2O}(g)\)
- A 227 °C, la siguiente reacción tiene\(K_c\) = 0.0952:
\[\ce{CH3OH}(g) \rightleftharpoons \ce{CO}(g)+\ce{2H2}(g) \nonumber \]
¿Cuál sería el valor de K P a esta temperatura?
- Contestar a
-
K P =\(K_c\) (RT) −1
- Respuesta b
-
K P =\(K_c\) (RT)
- Respuesta c
-
K P =\(K_c\) (RT);
- Respuesta d
-
160 o 1.6 × 10 2
Equilibrios heterogéneos
Un equilibrio heterogéneo es un sistema en el que los reactivos y productos se encuentran en dos o más fases. Las fases pueden ser cualquier combinación de fases sólidas, líquidas o gaseosas, y soluciones. Al tratar estos equilibrios, recuerde que los sólidos y los líquidos puros no aparecen en expresiones constantes de equilibrio (las actividades de sólidos puros, líquidos puros y solventes son 1).
Algunos equilibrios heterogéneos implican cambios químicos:
Ejemplo 1
\[\ce{PbCl2}(s) \rightleftharpoons \ce{Pb^2+}(aq)+\ce{2Cl-}(aq) \label{13.3.30a} \]
con constante de equilibrio asociada
\[K_c=\ce{[Pb^2+][Cl- ]^2} \label{13.3.30b} \]
Ejemplo 1
\[\ce{CaO}(s)+\ce{CO2}(g) \rightleftharpoons \ce{CaCO3}(s) \label{13.3.31a} \]
con constante de equilibrio asociada
\[K_c=\dfrac{1}{[\ce{CO2}]} \label{13.3.31b} \]
Ejemplo 1
\[\ce{C}(s)+\ce{2S}(g) \rightleftharpoons \ce{CS2}(g) \label{13.3.32a} \]
con constante de equilibrio asociada
\[K_c=\ce{\dfrac{[CS2]}{[S]^2}} \label{13.3.32b} \]
Otros equilibrios heterogéneos implican cambios de fase, por ejemplo, la evaporación del bromo líquido, como se muestra en la siguiente ecuación:
\[\ce{Br2}(l) \rightleftharpoons \ce{Br2}(g) \label{13.3.33a} \]
con constante de equilibrio asociada
\[K_c=[\ce{Br2}] \label{13.3.33b} \]
Podemos escribir ecuaciones para cocientes de reacción de equilibrios heterogéneos que involucran gases, usando presiones parciales en lugar de concentraciones. Dos ejemplos son:
\[\ce{CaO}(s)+\ce{CO2}(g) \rightleftharpoons \ce{CaCO3}(s)\label{13.3.34a} \]
con constante de equilibrio asociada
\[K_P=\dfrac{1}{P_{\ce{CO2}}} \label{13.3.34b} \]
\[\ce{C}(s)+\ce{2S}(g) \rightleftharpoons \ce{CS2}(g)\label{13.3.35a} \]
con constante de equilibrio asociada
\[K_P=\dfrac{P_{\ce{CS2}}}{(P_{\ce S})^2} \label{13.3.35b} \]
Resumen
Para cualquier reacción que esté en equilibrio, el cociente de reacción Q es igual a la constante de equilibrio K para la reacción. Si un reactivo o producto es un sólido puro, un líquido puro, o el disolvente en una solución diluida, la concentración de este componente no aparece en la expresión para la constante de equilibrio. En equilibrio, los valores de las concentraciones de los reactivos y productos son constantes. Sus valores particulares pueden variar dependiendo de las condiciones, pero el valor del cociente de reacción siempre será igual a K (K c cuando se usan concentraciones o K P cuando se usan presiones parciales).
Un equilibrio homogéneo es un equilibrio en el que todos los componentes están en la misma fase. Un equilibrio heterogéneo es un equilibrio en el que los componentes se encuentran en dos o más fases. Podemos decidir si una reacción está en equilibrio comparando el cociente de reacción con la constante de equilibrio para la reacción.
Ecuaciones Clave
- \(Q=\dfrac{[\ce C]^x[\ce D]^y}{[\ce A]^m[\ce B]^n}\hspace{20px}\textrm{where }m\ce A+n\ce B⇌x\ce C+y\ce D\)
- \(Q_P=\dfrac{(P_C)^x(P_D)^y}{(P_A)^m(P_B)^n}\hspace{20px}\textrm{where }m\ce A+n\ce B⇌x\ce C+y\ce D\)
- P = MRT
- K P =\(K_c\) (RT) Δ n
Glosario
- constante de equilibrio (K)
- valor del cociente de reacción para un sistema en equilibrio
- equilibrios heterogéneos
- equilibrios entre reactivos y productos en diferentes fases
- equilibrios homogéneos
- equilibrios dentro de una sola fase
- K c
- constante de equilibrio para reacciones basadas en concentraciones de reactivos y productos
- K P
- constante de equilibrio para reacciones en fase gaseosa basadas en presiones parciales de reactivos y productos
- ley de acción masiva
- cuando una reacción reversible ha alcanzado el equilibrio a una temperatura dada, el cociente de reacción permanece constante
- cociente de reacción (Q)
- relación del producto de concentraciones molares (o presiones) de los productos a la de los reactivos, elevándose cada concentración (o presión) a la potencia igual al coeficiente en la ecuación


